高中化学人教版选修6第三单元 物质的检测 酸碱中和滴定法18张PPT
文档属性
| 名称 | 高中化学人教版选修6第三单元 物质的检测 酸碱中和滴定法18张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-11 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
酸碱中和滴定法
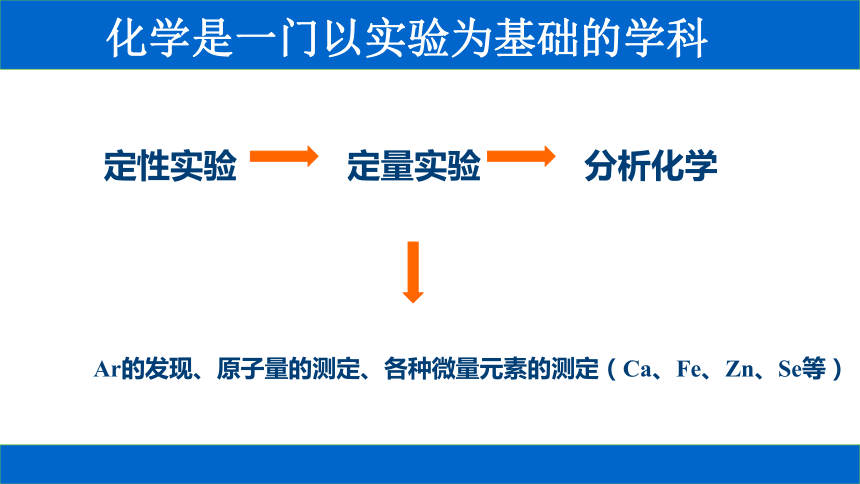
化学是一门以实验为基础的学科
定性实验
定量实验
分析化学
Ar的发现、原子量的测定、各种微量元素的测定(Ca、Fe、Zn、Se等)
成功关键:
复 习——酸碱中和滴定实验原理
以一元强酸与一元强碱的反应为例:
0
碱
式
滴
定
管
0
酸
式
滴
定
管
(1) V标准和V待测溶液体积的准确测量。
(2)滴定终点(酸碱恰好中和时)的准确判断。
c(待测)
c (标准)
V(标准)
V(待测)
=
原 理:H+ + OH- = H2O
恰好中和时: n(H+) = n(OH-)
即 c (H+ )V (H+ ) = c (OH- )V(OH- )
问题一:通过何种方法判断酸碱恰好中和?
【主要依据】
pH试纸 ;
酸碱指示剂 ;
pH计 ;
【pH的测定】
pH=7
酚酞、石蕊、甲基橙
演示实验—酸碱中和滴定实验pH曲线的绘制
【实验用品】
试剂:0.1000mol/L的HCl溶液,0.0100mol/L的NaOH的溶液
仪器:酸式滴定管,碱式滴定管,烧杯,铁架台,数据采集器,pH计,酸碱中和实验器,磁力搅拌器,磁子
【实验内容】
用0.1000mol/L的HCl溶液滴定30.00mL 0.0100mol/LNaOH 溶液,绘制pH-V酸碱滴定曲线。
问题二:pH值变化规律?
pH突跃:
在接近滴定终点(pH=7)时,很少量(0.04mL,约1滴)的酸或碱就会引起溶液pH值的突变。
pH计算
向20mL0.1mol/LNaOH溶液中滴加0.1mol/LHCl溶液,pH随HCl溶液体积的变化。
V
(加入HCl )mL V
(剩余NaOH)mL V(过量HCl)mL C(OH—)
mol/L pH
0 20.00 1.00×10-1
18.00 2.00 5.26×10-3
19.80 0.20 5.02×10-4
19.98 0.02 5.00×10-5
20.00 0 1.00×10-7
20.02 0.02 2.00×10-10
20.20 0.20 2.01×10-11
5.4
突跃范围
13.00
11.72
10.70
9.70
7.00
4.30
3.30
1滴0.04
ml
误差-0.1%
误差+0.1%
问题三:滴定终点和化学计量点什么关系?
滴定终点:
能够引起pH突跃的点。位于pH突跃范围之内,与恰好中和点(化学计量点)相差甚微。
化学计量点:
酸碱恰好完全中和时的点。
对于强酸强碱而言,即pH=7时。
红色
紫色
蓝色
5
8
常见的酸碱指示剂变色范围 P49
问题四:指示剂的选择
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
酚 酞:
甲基橙:
红色
橙色
黄色
无色
粉红
红色
8.2
10
3.1
4.4
4.3 突跃范围 9.7
酚酞 甲基橙
强酸滴强碱
强碱滴强酸
粉红 →无
无 →粉红
黄→橙
橙→黄
石 蕊:
指示剂的选择原则
A. 指示剂的变色范围全部或部分落 在pH突跃范围之内
B. 颜色变化明显
用量
2-3 滴
滴定终点的判断
颜色变化后,半分钟(30s)内不再改变
问题四:指示剂的选择
酚酞
甲基橙
问题五:酸碱中和滴定实验步骤
(1)准备阶段
①检漏
②水洗
③润洗
④注液
(液面于0刻度以上2-3cm处)
⑤赶气泡
⑥调节液面
(液面调至0或以下某一刻度,记录初始刻度V0)
⑦放出待测液V待
(锥形瓶中加2-3滴指示剂)
注:锥形瓶不能用待测液润洗
问题五:酸碱中和滴定实验步骤
(2)滴定阶段
左手控制滴定管活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶内颜色的变化。
先快后慢,直到指示剂颜色发生明显的变化,且半分钟内溶液的颜色不变。
(用标准液 C标 滴定待测液 C待 )
(3)读数并记录
达到滴定终点后,记下终点刻度V1。计算所消耗标液的体积V1-V0
(4)重复上述操作2-3次
(5)计算
根据公式求浓度,取平均值。
问题五:酸碱中和滴定实验步骤
c(待测)
c (标准)
V(标准)
V(待测)
=
已知
V1-V0
事先量好
合作探究
小组合作,设计实验方案,测定未知浓度盐酸溶液的浓度。
实验药品:
待测溶液—未知浓度的 HCl 溶液,
标准溶液—0.1000mol/L NaOH 溶液
酚酞,甲基橙,蒸馏水
分组实验:
一组:甲基橙做指示剂
二组:酚酞做指示剂
主要实验步骤:
润洗 分别用3-5mL标准液、待测液润洗相应滴定管;
酸式滴定管中注入待测HCl溶液,放出20mL于锥形瓶中,滴加2-3滴指示剂;
碱式滴定管中注入标准NaOH溶液,调液面于0刻度或以下,记录体积V1;
开始滴定
左手控制活塞,右手摇锥形瓶,眼睛注视锥形瓶颜色变化,先快后慢,待指示剂变色30s不褪色时,即为滴定终点。记录体积V2;
计算
曲线对比
PH
12
10
8
6
4
2
10
20
30
40
突变范围
反应终点
中和滴定曲线
T
H
A
N
K
Y
O
U
!
酸碱中和滴定法
化学是一门以实验为基础的学科
定性实验
定量实验
分析化学
Ar的发现、原子量的测定、各种微量元素的测定(Ca、Fe、Zn、Se等)
成功关键:
复 习——酸碱中和滴定实验原理
以一元强酸与一元强碱的反应为例:
0
碱
式
滴
定
管
0
酸
式
滴
定
管
(1) V标准和V待测溶液体积的准确测量。
(2)滴定终点(酸碱恰好中和时)的准确判断。
c(待测)
c (标准)
V(标准)
V(待测)
=
原 理:H+ + OH- = H2O
恰好中和时: n(H+) = n(OH-)
即 c (H+ )V (H+ ) = c (OH- )V(OH- )
问题一:通过何种方法判断酸碱恰好中和?
【主要依据】
pH试纸 ;
酸碱指示剂 ;
pH计 ;
【pH的测定】
pH=7
酚酞、石蕊、甲基橙
演示实验—酸碱中和滴定实验pH曲线的绘制
【实验用品】
试剂:0.1000mol/L的HCl溶液,0.0100mol/L的NaOH的溶液
仪器:酸式滴定管,碱式滴定管,烧杯,铁架台,数据采集器,pH计,酸碱中和实验器,磁力搅拌器,磁子
【实验内容】
用0.1000mol/L的HCl溶液滴定30.00mL 0.0100mol/LNaOH 溶液,绘制pH-V酸碱滴定曲线。
问题二:pH值变化规律?
pH突跃:
在接近滴定终点(pH=7)时,很少量(0.04mL,约1滴)的酸或碱就会引起溶液pH值的突变。
pH计算
向20mL0.1mol/LNaOH溶液中滴加0.1mol/LHCl溶液,pH随HCl溶液体积的变化。
V
(加入HCl )mL V
(剩余NaOH)mL V(过量HCl)mL C(OH—)
mol/L pH
0 20.00 1.00×10-1
18.00 2.00 5.26×10-3
19.80 0.20 5.02×10-4
19.98 0.02 5.00×10-5
20.00 0 1.00×10-7
20.02 0.02 2.00×10-10
20.20 0.20 2.01×10-11
5.4
突跃范围
13.00
11.72
10.70
9.70
7.00
4.30
3.30
1滴0.04
ml
误差-0.1%
误差+0.1%
问题三:滴定终点和化学计量点什么关系?
滴定终点:
能够引起pH突跃的点。位于pH突跃范围之内,与恰好中和点(化学计量点)相差甚微。
化学计量点:
酸碱恰好完全中和时的点。
对于强酸强碱而言,即pH=7时。
红色
紫色
蓝色
5
8
常见的酸碱指示剂变色范围 P49
问题四:指示剂的选择
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
酚 酞:
甲基橙:
红色
橙色
黄色
无色
粉红
红色
8.2
10
3.1
4.4
4.3 突跃范围 9.7
酚酞 甲基橙
强酸滴强碱
强碱滴强酸
粉红 →无
无 →粉红
黄→橙
橙→黄
石 蕊:
指示剂的选择原则
A. 指示剂的变色范围全部或部分落 在pH突跃范围之内
B. 颜色变化明显
用量
2-3 滴
滴定终点的判断
颜色变化后,半分钟(30s)内不再改变
问题四:指示剂的选择
酚酞
甲基橙
问题五:酸碱中和滴定实验步骤
(1)准备阶段
①检漏
②水洗
③润洗
④注液
(液面于0刻度以上2-3cm处)
⑤赶气泡
⑥调节液面
(液面调至0或以下某一刻度,记录初始刻度V0)
⑦放出待测液V待
(锥形瓶中加2-3滴指示剂)
注:锥形瓶不能用待测液润洗
问题五:酸碱中和滴定实验步骤
(2)滴定阶段
左手控制滴定管活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶内颜色的变化。
先快后慢,直到指示剂颜色发生明显的变化,且半分钟内溶液的颜色不变。
(用标准液 C标 滴定待测液 C待 )
(3)读数并记录
达到滴定终点后,记下终点刻度V1。计算所消耗标液的体积V1-V0
(4)重复上述操作2-3次
(5)计算
根据公式求浓度,取平均值。
问题五:酸碱中和滴定实验步骤
c(待测)
c (标准)
V(标准)
V(待测)
=
已知
V1-V0
事先量好
合作探究
小组合作,设计实验方案,测定未知浓度盐酸溶液的浓度。
实验药品:
待测溶液—未知浓度的 HCl 溶液,
标准溶液—0.1000mol/L NaOH 溶液
酚酞,甲基橙,蒸馏水
分组实验:
一组:甲基橙做指示剂
二组:酚酞做指示剂
主要实验步骤:
润洗 分别用3-5mL标准液、待测液润洗相应滴定管;
酸式滴定管中注入待测HCl溶液,放出20mL于锥形瓶中,滴加2-3滴指示剂;
碱式滴定管中注入标准NaOH溶液,调液面于0刻度或以下,记录体积V1;
开始滴定
左手控制活塞,右手摇锥形瓶,眼睛注视锥形瓶颜色变化,先快后慢,待指示剂变色30s不褪色时,即为滴定终点。记录体积V2;
计算
曲线对比
PH
12
10
8
6
4
2
10
20
30
40
突变范围
反应终点
中和滴定曲线
T
H
A
N
K
Y
O
U
!
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
