8.2 金属的化学性质 同步练习(含解析)
文档属性
| 名称 | 8.2 金属的化学性质 同步练习(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-11 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
人教版2019-2020学年九年级下学期
课题2 金属的化学性质
一、选择题(每小题3分,共30分)
1.X、Y、Z为三种金属,已知①②③Y与稀硫酸不反应,则下列符合要求的X、Y、Z分别是( )
A.Fe Cu Ag B.Cu Hg Ag C.Mg Zn Fe D.Fe Ag Cu
2.把金属X放入溶液中,其表面有红色物质析出,放入溶液中无变化.则X、Cu、Zn三种金属的活动性顺序由强到弱,正确的是( )
A.Zn、Cu、X B.Cu、X、Zn C.Zn、X、Cu D.X、Zn、Cu
3.我国商代已经制造出精美的青铜器,春秋战国时期已会治铁和炼铜。人类开发利用下列金属单质的时间顺序与金属活动性的强弱有着上述某种内在的联系。由此推断,下列金属中,人类开发利用最晚的是( )
A.Al B.Cu C.Fe D.Zn
4.国产打飞机C919机壳采用了先进的铝锂合金材料。已知金属锂(Li)的活动性比铝强。下列有关说法错误的是( )
A.铝锂合金硬度大,密度小
B.铝在空气中表面会形成致密的氧化膜
C.锂能与盐酸反应,放出热量,生成氢气
D.锂能与氧气反应,生成的中Li显+2价
5.如图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处吊着一根绝缘的细线(两圈不接触),使之平衡.小心地从烧杯中央滴入硫酸铜溶液,观察到的现象是( )
A.铁圈和银圈左右摇摆不定
B.保持平衡
C.铁圈向下倾斜
D.银圈向下倾斜
6.在已平衡的天平两边分别放一个等质量的烧杯,烧杯中装有等质量、等质量分数的足量稀盐酸,在左边的烧杯中加入5.6g金属铁,在右边烧杯中加入5.5g镁和铜的混合物,充分反应后,天平仍然保持平衡。则右边烧杯中加入的混合物中,镁和铜的质量比为( )
A.36:19 B.12:43 C.24:31 D.13:42
7.下列有关实验现象的描述中,正确的是( )
A.加热试管内的碱式碳酸铜,绿色粉末逐渐变黑,试管口有小水滴,
B.细铁丝在氧气中燃烧,火星四射,生成红棕色固体
C.镁条在空气中燃烧,产生黑烟,生成黑色粉末
D.向少量氧化铜中加入稀硫酸,有气泡产生,黑色粉未逐渐消失,溶液变蓝
8.已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是( )
A.X氧化物的化学式只能表示为XO
B.Y能将X从它的盐溶液中置换出来
C.Z在自然界中只能以单质形式存在
D.三种金属的活动性顺序:X>Y>Z
9.把X、Y两种金属分别放入另外两种金属Z、M的盐溶液中,实验结果如下表,其中/表示金属与盐不反应,“√”表示金属与盐能反应。
上述四种金属活动性由强到弱的顺序是( )
A.Z、M、X、Y B.M、X、Z、Y C.Z、X、M、Y D.Z、Y、X、M
10.现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价)。则下列说法中不正确的是( )
A生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲> 乙>丙
二、填空题(每小题2分,共10分)
11.在空气中,铝的表面容易形成一层致密的______薄膜,从而阻止铝进一步______
12.在金属活动性顺里,金属的位置越靠前,活动性就越______
13.由一种单质与一种化合物反应,生成另一种单质和另一种化合物的化学反应叫做_____反应。
14.金属的化学性质主要为:(1)几乎所有金属都能够与______反应;(2)较活泼的金属能够置换出盐酸、稀硫酸中的______;(3)较活泼的金属可以把不活泼的金属从它们_______的溶液中置换出来。
15.如图是家用白炽灯,请结合所学知识回答下列问题:
(1)白炽灯中含有金属元素的材料有______
(2)在白炽灯中充入氮气的作用是_______
(3)白炽灯的灯头是用铝而不用铁的,是由于铝具有很好的抗腐蚀性,用化学方程式证明原因_______
(4)铝比铁活泼,但是铝的抗腐蚀性却比铁强,请写出能证明铝比铁活泼的化学方程式__________
三、解答题(共5题,共50分)
16.金属活动性顺序在工农业生产和科学研究中有重要应用.
(1)铝比较活泼,为什么铝制品却有很好的抗腐蚀性能?
(2)农业上不能用铁制容器配制农药波尔多液(含硫酸铜),请用方程式解释.
17.金属材料包括纯金属及其合金,合金的用途更为广泛:
(1)合金与纯金属相比具有哪些优良的性能(答两点即可)?
(2)作为钱币的合金需要具有哪些性质?(答两点即可)
18.某化学小组利用下图装置进行探究实验
(1)若烧杯中盛有稀盐酸,可观察到什么现象?写出反应的化学方程式。
(2)若烧杯中盛有蒸馏水,将该装置放置一段时间后,可观察到什么现象
19.小可同学为测定某铁合金的含铁量,做了如下实验,称取11.4克样品,放入质量为50.0克的烧杯中再往烧杯中加入100.0克的稀盐酸(杂质不与酸反应、不溶于水)并对烧杯进行了四次称量,记录据如下:
求:(1)反应产生的氢气的质量
(2)该铁合金中铁的质量分数(保留一位小数)
20.其同学用锌和稀硫酸制取氢气。向气体发生装置中加入一定量锌粒,将30g稀硫酸分三次加入,每生产气体的质量如下表。
(1)共制得氢气多少g.
(2)第二次所用10g稀硫酸的质量分数。
四、实验探究题(10分)
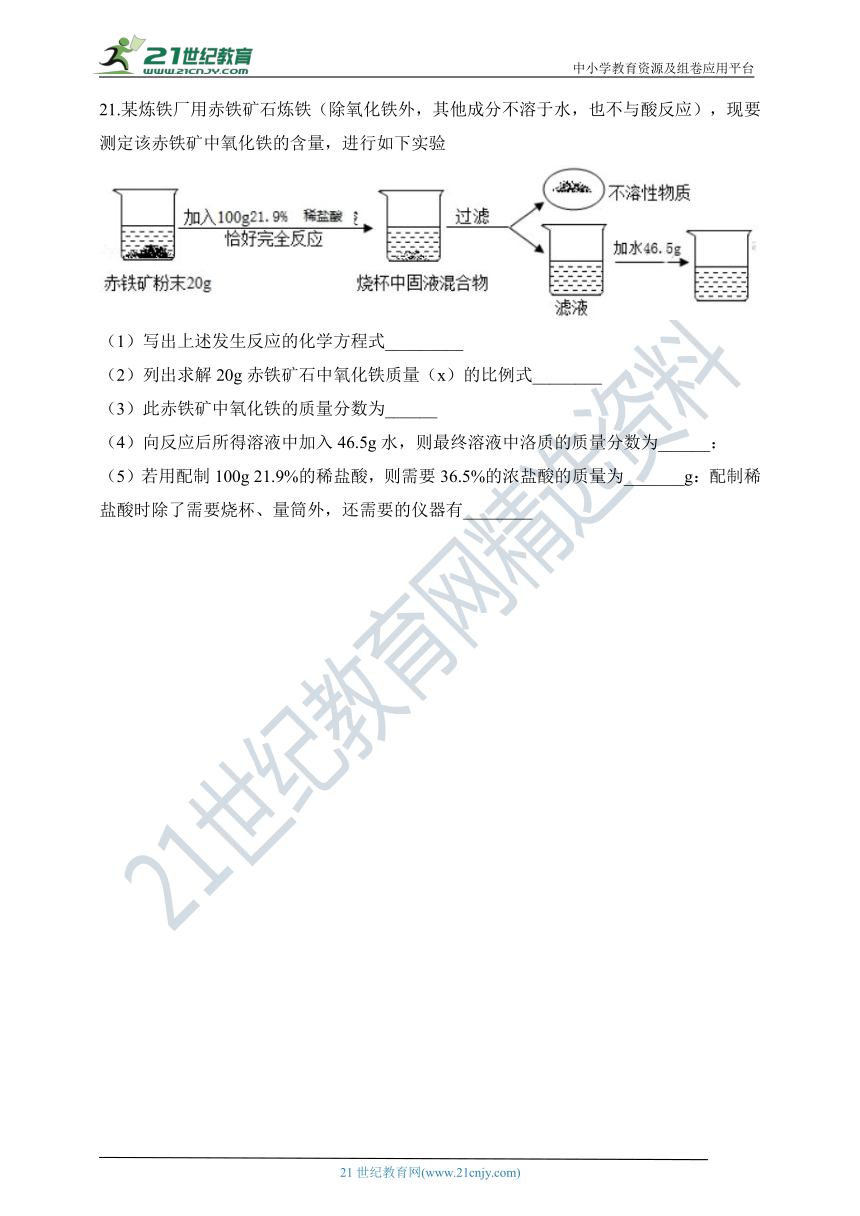
21.某炼铁厂用赤铁矿石炼铁(除氧化铁外,其他成分不溶于水,也不与酸反应),现要测定该赤铁矿中氧化铁的含量,进行如下实验
(1)写出上述发生反应的化学方程式_________
(2)列出求解20g赤铁矿石中氧化铁质量(x)的比例式________
(3)此赤铁矿中氧化铁的质量分数为______
(4)向反应后所得溶液中加入46.5g水,则最终溶液中洛质的质量分数为______:
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为_______g:配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有________
答案
1.【解析】结合Y不和稀硫酸反应,可知Y应该是Cu或Ag,结合反应方程2,可知Y的活性比Z的活性强,可知Y应该是Cu,而Z应该是Ag,对于1反应方程,可知,X应该是Fe,故选A。
2.【解析】结合金属X可以置换Cu,可知X的活性比Cu强,而放入无反应,则X的活性比Zn弱,故选C。
3.【解析】此题考查金属活性分布,结合题意可知,活性较弱的先被开发,而活性较强的后开发,根据选项,可知Al的活性最强,故利用最晚,故选A。
4.【解析】在中,由于氧显-2价,可推出Li显+1价。故选D。
5.【解析】Fe能够置换出Cu,而Cu的质量分数大于Fe,故铁圈将会向下倾斜,而Ag不与硫酸铜溶液反应,故选C。
6.【解析】根据方程0
列等式,解得,所以含铁的烧杯剩余5.4g
而对于方程
列等式,解得,所以Mg含量为1.2g,而Cu的含量为4.3g,故质量比值为,故选B。
7.【解析】碱式碳酸铜为绿色粉末,受热后生成黑色的氧化铜,水和二氧化碳;细铁丝在氧气中燃烧,火星四射生成黑色固体;镁在空气中燃烧产生大量白烟,生成白色粉末;向少量的氧化铜中加入稀硫酸,黑色粉末逐渐溶解,溶液变为蓝色,没有气泡产生。故选A。
8.【解析】结合金属X可以与氧气反应,推测应该可以为K,Al,Ca等,而将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化可以推测Y应该为Fe,而Z可能为Ag等,故A选项化学式可以为,错误;而B选项中,Y的活性比X的活性小,故不能置换,C选项中,比如,故错误,故选D。
9.【解析】结合Z不反应,可知Z的活性高于X与Y,而M与X反应,可知M的活性低于X,高于Y,故选C。
10.【解析】A选项,结合图形,可知A正确;B选项,设金属的质量分数为M,建立等式,可知
,可知在m相同的条件下,M与氢气质量成反比,故相对原子质量为
丙>乙>甲,故错误;C选项,看产生氢气的速度,谁的速度快,谁的活性就强,正确;D选项中,产生氢气越多,消耗硫酸质量越大,故正确,故选B。
11.【解析】氧化铝 氧化
12.【解析】强
13.【解析】置换
14.【解析】氧气 氢 化合物
15.【解析】(1)白炽灯中含有金属元素的材料有钨丝、铜丝、焊锡、铝。故填:钨丝、铜丝、焊锡、铝。
(2)在白炽灯中充入氮气的作用是防止钨丝被氧化。故填:防止钨丝被氧化。
(9)铝具有很好的抗腐蚀性,是因为铝能和氧气反应生成氧化铝保护膜,反应的化学方程式为:,故填:.
(4)铝比铁活泼,能和硫酸亚铁反应生成硫酸铝和铁,反应的化学方程式为:
,故填:
16.【解析】(1)通常情况下铝制品很耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化
(2)铁和硫酸铜反应生成铜和硫酸亚铁,化学方程式为:;故答案为:(1)在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化;(2)
17.【解析】(1)合金通常具有比純金属硬度大、熔点低、耐魔蚀的优点,故答案为:硬度大熔点低、耐魔蚀;
(2)作为钱币的合金需要具有耐磨、抗腐蚀、无毒的性质,故填:耐磨、抗腐蚀
18.【解析】答案:(1)铁片表面有气泡产生,试管内液面下降,溶液变成浅绿
色.
(2)铁片与水、空气接触部分出现红褐色物质(或铁锈),试管内液面上升
19.【解析】【解答】解:(1)分析题干给出的数据以及表格的数据可知此反应进行完全,根据质量守恒定律,可得产生氢气的质量为:11.4g+100g+50g-161g=0.4g
(2)设产生0.4g氢气需要铁的质量为x,则有
56 2
x 0.4g
x=11.2g
所以铁的质量分数为
答:反应产生的氢气的质量为0.4g,该铁合金中铁的质量分数为98.2%
20.【解析】根据表格可以看出,生成的氢气的质量0.04g+0.04+0.02g=0.1g
(2)解:设10g硫酸中含有溶质的质量为x,
98 2x
x 0.04g
x=1.96g
第二次所用硫酸的质量分数为:
21.【解析】
(3)80%
(4)100%;
(5)60g;玻璃棒、胶头滴管。
该过程发生反应是氧化铁和盐酸反应生成氯化铁和水,对应的化学方程式
、
设20g赤铁矿石中氧化铁质量为x,生成的氯化铁的质量为y消耗的HCl的质量为100g21.9%= 21.9g
219 160 162.5
21.9g y x
x= 16g
y= 16.25g
此赤铁矿中氧化铁的质量分数为
向反应后所得溶液中加入46.5g水,则最终溶液中洛质的质量分数为
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为;配制稀盐酸时除了需要烧杯、量筒外,还需要仪器有玻璃棒、胶头滴管。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
