苏教版 高二化学专题2 .2.1 原子核外电子排布的周期性(23张PPT)
文档属性
| 名称 | 苏教版 高二化学专题2 .2.1 原子核外电子排布的周期性(23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 308.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-12 07:11:54 | ||
图片预览





文档简介
课件23张PPT。《原子核外电子排布的周期性》 授课教师:
审核教师:高二化学1.能从原子核外电子排布的规则理解核外电子排布的周期性,能从外围电子排布角度理解元素周期表中元素的分区及周期、族的划分,培养宏观辨识与微观探析的学科核心素养。
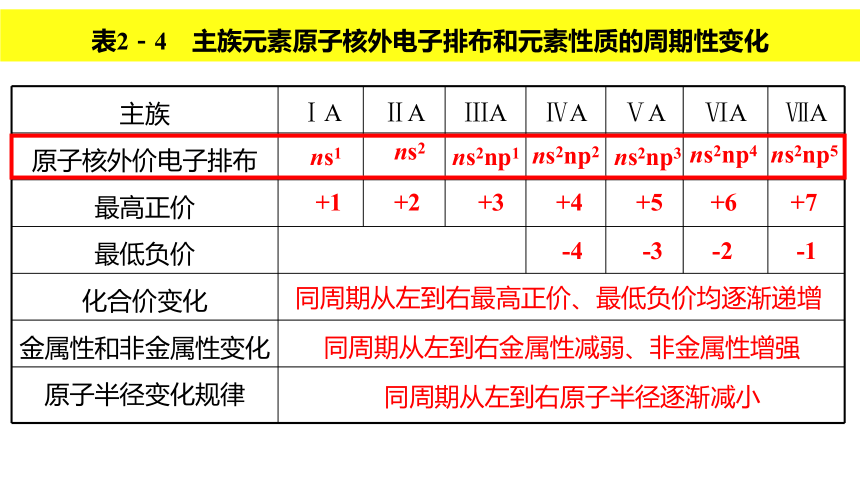
2.通过原子结构与元素在周期表中位置关系的相互推导,形成“结构—位置”的推导模型,强化证据推理与模型认知的学科核心素养。核心素养发展目标课本第18页 原子核外电子排布的周期性变化导致元素性质的周期性变化。你能根据原子核外电子排布的周期性变化规律,尝试进行归纳吗?请填写表2-4。 同周期从左到右最高正价、最低负价均逐渐递增 同周期从左到右金属性减弱、非金属性增强 同周期从左到右原子半径逐渐减小ns1ns2ns2np1ns2np5ns2np4ns2np3ns2np2表2-4 主族元素原子核外电子排布和元素性质的周期性变化 查阅附录中的元素周期表,思考以下两个问题,并完成课本19页上的表2-5。
(1)每一周期元素原子的外围电子排布呈现什么样的变化规律?
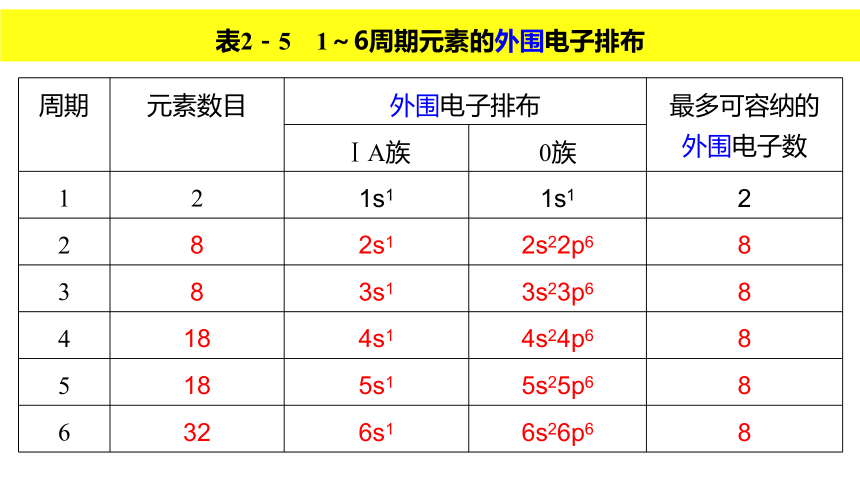
(2)稀有气体元素、主族元素以及过渡金属元素原子的外围电子排布各有什么特点?课本第18~19页 表2-5 1~6周期元素的外围电子排布 ①外围电子数目的变化:
除第1周期外,每隔一定数目的元素,外围电子数目重复出现从
逐渐递增到 的周期性变化。
②外围电子排布的变化:
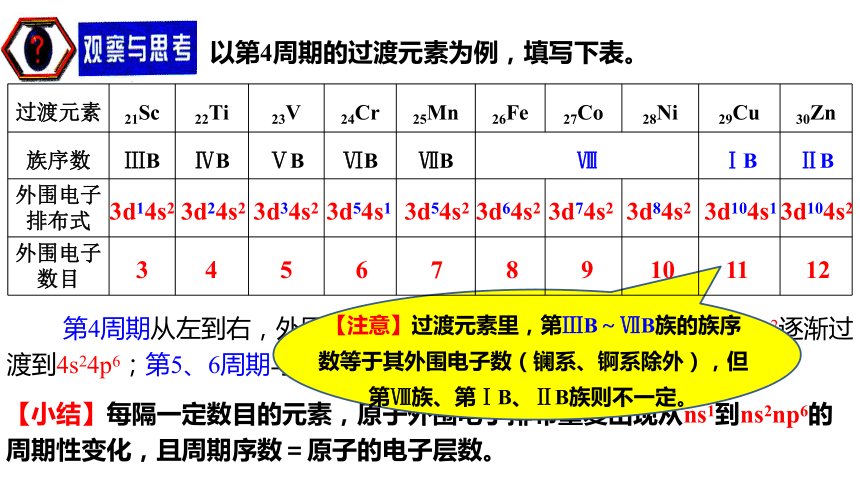
第2、3周期从左到右,外围电子排布重复出现从 到 的周期性变化。18ns1ns2np6知识点一、原子结构与元素周期表的关系1.原子核外电子排布与周期的划分 从第4周期开始,出现了过渡元素,第4、5、6周期元素的外围电子排布变化规律如何?以第4周期的过渡元素为例,填写下表。 第4周期从左到右,外围电子排布重复出现从4s1到经过3d1~104s1~2逐渐过渡到4s24p6;第5、6周期与第4周期变化规律相似。【小结】每隔一定数目的元素,原子外围电子排布重复出现从ns1到ns2np6的周期性变化,且周期序数=原子的电子层数。3d24s23d34s23d54s13d54s23d104s13d104s23d14s23 4 5 6 7 8 9 10 11 12 3d64s23d74s23d84s2根据外围电子排布式将下列各主族元素的外围电子数、列数填入表中。ns1ns2ns2np1ns2np2ns2np3ns2np4ns2np51 2 3 4 5 6 71 2 13 14 15 16 17【小结】主族序数=最外层电子数=外围电子数。①族的划分依据是原子的外围电子排布 。
②稀有气体的外围电子排布为1s2或ns2np6。
③同主族元素原子的外围电子排布完全相同,全部排在ns或nsnp轨道上。
④过渡元素同一纵行原子的外围电子排布基本相同,为(n-1)d1~10ns1~2。知识点一、原子结构与元素周期表的关系2.原子核外电子排布与族的划分划重点(1)周期序数=电子层数。
(2)主族序数=最外层电子数=外围电子数。
(3)过渡元素里,第ⅢB~ⅦB族的族序数等于其外围电子数(镧系、锕系除外),但第Ⅷ族、第ⅠB、ⅡB族则不一定。【说明】中学里过渡元素只考查第4周期,建议同学们背上!例1 某元素位于周期表中第4周期ⅤA族,则该元素的名称和外围电子排布式均正确的是
A.砷,4s24p3 B.溴,4s24p5
C.磷,4s24p3 D.锑,5s25p3√解析 由于该元素为主族元素,外围电子数=主族序数,故外围电子数为5,排除B项;
又因周期序数=电子层数,排除D项;
由元素在周期表中的位置可知:元素的外围电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3,为33号元素砷,故A项正确。例2 写出13Al、24Cr、26Fe、27Co、30Zn等元素原子的核外电子排布式,并判断它们在元素周期表中的位置。
(1)13Al:________________,_________________。1s22s22p63s23p1第3周期ⅢA族解析 依据电子排布式,周期序数=电子层数,所以位于第3周期;Al是主族元素,又因主族序数=外围电子数,所以位于第ⅢA族。(2)24Cr:__________________,_______________。1s22s22p63s23p63d54s1第4周期ⅥB族解析 依据电子排布式,Cr的电子层数为4,所以位于第4周期;由于电子最后填充d轨道,其价电子排布式为3d54s1,价电子总数为6,所以位于第ⅥB族。(3)26Fe:__________________,______________。解析 依据电子排布式,Co的电子层数为4,所以位于第4周期;由于电子最后填充d轨道,其价电子排布式为3d74s2,价电子总数为9,但也位于第Ⅷ族。(4)27Co:__________________,______________。解析 依据电子排布式,Fe的电子层数为4,所以位于第4周期;由于电子最后填充d轨道,其价电子排布式为3d64s2,价电子总数为8,所以位于第Ⅷ族。1s22s22p63s23p63d64s2第4周期Ⅷ族1s22s22p63s23p63d74s2第4周期Ⅷ族(5)30Zn:___________________,________________。解析 依据电子排布式,Zn的电子层数为4,所以位于第4周期;由于Zn价电子排布式为3d104s2,价电子总数为12,所以位于元素周期表第12列,即第ⅡB族。1s22s22p63s23p63d104s2第4周期ⅡB族【注意】过渡元素里,第ⅢB~ⅦB族的族序数等于其外围电子数(镧系、锕系除外),但第Ⅷ族、第ⅠB、ⅡB族则不一定。(1)元素周期表区的划分依据是什么?
(2)区的名称与电子的能级符号有什么关系?课本第19页 知识点二、元素周期表中区的划分1.根据元素原子的 的特征,将元素周期表分成五个区域:s区、p区、d区、ds区和f区。外围电子排布2.各区元素外围电子排布特点:f区:镧系、锕系例3 根据电子排布的特点,Cu在周期表中属于
A.ds区 B.p区 C.d 区 D.s区√解析 铜为29号元素,核外电子排布式为1s2 2s2 2p6 3s2 3p6 3d104s1。故Cu在元素周期表中属于ds区。例4 具有以下结构的原子一定属于p区元素的是
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④最外层电子形成全满结构的原子
A.①② B.①③
C.①④ D.③④√解析 最外层有3个电子的原子,其最外层电子排布式一定为ns2np1,位于第ⅢA族,①正确;
最外层有3个未成对电子的原子,其最外层电子排布式一定为ns2np3,位于第ⅤA族,③正确;
最外层电子排布式为ns2的原子,既可能是第ⅡA族元素的原子如Mg,也可能是过渡元素的原子如Fe或Zn,还可能是稀有气体He原子,②错误;
最外层电子形成全满结构的原子,包括ns2、ns2np6等结构的原子,可能位于多个区,④错误。(若元素的最外层电子数≥3,则该一定位于第ⅢA~ⅦA族或0族。)学习小结 同学们,这节课我们就上到这儿。接下来请大家完成课堂作业。请仔细审题,认真思考,工整书写,规范答题,提高准确率,充分展示这一节课的学习收获吧!
审核教师:高二化学1.能从原子核外电子排布的规则理解核外电子排布的周期性,能从外围电子排布角度理解元素周期表中元素的分区及周期、族的划分,培养宏观辨识与微观探析的学科核心素养。
2.通过原子结构与元素在周期表中位置关系的相互推导,形成“结构—位置”的推导模型,强化证据推理与模型认知的学科核心素养。核心素养发展目标课本第18页 原子核外电子排布的周期性变化导致元素性质的周期性变化。你能根据原子核外电子排布的周期性变化规律,尝试进行归纳吗?请填写表2-4。 同周期从左到右最高正价、最低负价均逐渐递增 同周期从左到右金属性减弱、非金属性增强 同周期从左到右原子半径逐渐减小ns1ns2ns2np1ns2np5ns2np4ns2np3ns2np2表2-4 主族元素原子核外电子排布和元素性质的周期性变化 查阅附录中的元素周期表,思考以下两个问题,并完成课本19页上的表2-5。
(1)每一周期元素原子的外围电子排布呈现什么样的变化规律?
(2)稀有气体元素、主族元素以及过渡金属元素原子的外围电子排布各有什么特点?课本第18~19页 表2-5 1~6周期元素的外围电子排布 ①外围电子数目的变化:
除第1周期外,每隔一定数目的元素,外围电子数目重复出现从
逐渐递增到 的周期性变化。
②外围电子排布的变化:
第2、3周期从左到右,外围电子排布重复出现从 到 的周期性变化。18ns1ns2np6知识点一、原子结构与元素周期表的关系1.原子核外电子排布与周期的划分 从第4周期开始,出现了过渡元素,第4、5、6周期元素的外围电子排布变化规律如何?以第4周期的过渡元素为例,填写下表。 第4周期从左到右,外围电子排布重复出现从4s1到经过3d1~104s1~2逐渐过渡到4s24p6;第5、6周期与第4周期变化规律相似。【小结】每隔一定数目的元素,原子外围电子排布重复出现从ns1到ns2np6的周期性变化,且周期序数=原子的电子层数。3d24s23d34s23d54s13d54s23d104s13d104s23d14s23 4 5 6 7 8 9 10 11 12 3d64s23d74s23d84s2根据外围电子排布式将下列各主族元素的外围电子数、列数填入表中。ns1ns2ns2np1ns2np2ns2np3ns2np4ns2np51 2 3 4 5 6 71 2 13 14 15 16 17【小结】主族序数=最外层电子数=外围电子数。①族的划分依据是原子的外围电子排布 。
②稀有气体的外围电子排布为1s2或ns2np6。
③同主族元素原子的外围电子排布完全相同,全部排在ns或nsnp轨道上。
④过渡元素同一纵行原子的外围电子排布基本相同,为(n-1)d1~10ns1~2。知识点一、原子结构与元素周期表的关系2.原子核外电子排布与族的划分划重点(1)周期序数=电子层数。
(2)主族序数=最外层电子数=外围电子数。
(3)过渡元素里,第ⅢB~ⅦB族的族序数等于其外围电子数(镧系、锕系除外),但第Ⅷ族、第ⅠB、ⅡB族则不一定。【说明】中学里过渡元素只考查第4周期,建议同学们背上!例1 某元素位于周期表中第4周期ⅤA族,则该元素的名称和外围电子排布式均正确的是
A.砷,4s24p3 B.溴,4s24p5
C.磷,4s24p3 D.锑,5s25p3√解析 由于该元素为主族元素,外围电子数=主族序数,故外围电子数为5,排除B项;
又因周期序数=电子层数,排除D项;
由元素在周期表中的位置可知:元素的外围电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3,为33号元素砷,故A项正确。例2 写出13Al、24Cr、26Fe、27Co、30Zn等元素原子的核外电子排布式,并判断它们在元素周期表中的位置。
(1)13Al:________________,_________________。1s22s22p63s23p1第3周期ⅢA族解析 依据电子排布式,周期序数=电子层数,所以位于第3周期;Al是主族元素,又因主族序数=外围电子数,所以位于第ⅢA族。(2)24Cr:__________________,_______________。1s22s22p63s23p63d54s1第4周期ⅥB族解析 依据电子排布式,Cr的电子层数为4,所以位于第4周期;由于电子最后填充d轨道,其价电子排布式为3d54s1,价电子总数为6,所以位于第ⅥB族。(3)26Fe:__________________,______________。解析 依据电子排布式,Co的电子层数为4,所以位于第4周期;由于电子最后填充d轨道,其价电子排布式为3d74s2,价电子总数为9,但也位于第Ⅷ族。(4)27Co:__________________,______________。解析 依据电子排布式,Fe的电子层数为4,所以位于第4周期;由于电子最后填充d轨道,其价电子排布式为3d64s2,价电子总数为8,所以位于第Ⅷ族。1s22s22p63s23p63d64s2第4周期Ⅷ族1s22s22p63s23p63d74s2第4周期Ⅷ族(5)30Zn:___________________,________________。解析 依据电子排布式,Zn的电子层数为4,所以位于第4周期;由于Zn价电子排布式为3d104s2,价电子总数为12,所以位于元素周期表第12列,即第ⅡB族。1s22s22p63s23p63d104s2第4周期ⅡB族【注意】过渡元素里,第ⅢB~ⅦB族的族序数等于其外围电子数(镧系、锕系除外),但第Ⅷ族、第ⅠB、ⅡB族则不一定。(1)元素周期表区的划分依据是什么?
(2)区的名称与电子的能级符号有什么关系?课本第19页 知识点二、元素周期表中区的划分1.根据元素原子的 的特征,将元素周期表分成五个区域:s区、p区、d区、ds区和f区。外围电子排布2.各区元素外围电子排布特点:f区:镧系、锕系例3 根据电子排布的特点,Cu在周期表中属于
A.ds区 B.p区 C.d 区 D.s区√解析 铜为29号元素,核外电子排布式为1s2 2s2 2p6 3s2 3p6 3d104s1。故Cu在元素周期表中属于ds区。例4 具有以下结构的原子一定属于p区元素的是
①最外层有3个电子的原子 ②最外层电子排布式为ns2的原子 ③最外层有3个未成对电子的原子 ④最外层电子形成全满结构的原子
A.①② B.①③
C.①④ D.③④√解析 最外层有3个电子的原子,其最外层电子排布式一定为ns2np1,位于第ⅢA族,①正确;
最外层有3个未成对电子的原子,其最外层电子排布式一定为ns2np3,位于第ⅤA族,③正确;
最外层电子排布式为ns2的原子,既可能是第ⅡA族元素的原子如Mg,也可能是过渡元素的原子如Fe或Zn,还可能是稀有气体He原子,②错误;
最外层电子形成全满结构的原子,包括ns2、ns2np6等结构的原子,可能位于多个区,④错误。(若元素的最外层电子数≥3,则该一定位于第ⅢA~ⅦA族或0族。)学习小结 同学们,这节课我们就上到这儿。接下来请大家完成课堂作业。请仔细审题,认真思考,工整书写,规范答题,提高准确率,充分展示这一节课的学习收获吧!
