苏教版 高二化学专题2 1.2原子核外电子的排布(24张PPT)
文档属性
| 名称 | 苏教版 高二化学专题2 1.2原子核外电子的排布(24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 850.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-12 00:00:00 | ||
图片预览







文档简介
课件24张PPT。《原子核外电子的排布》任课教师:高二年级化学描述原子核外电子的运动状态涉及:
电子层、原子轨道、电子自旋
原子核外电子的排布遵循:
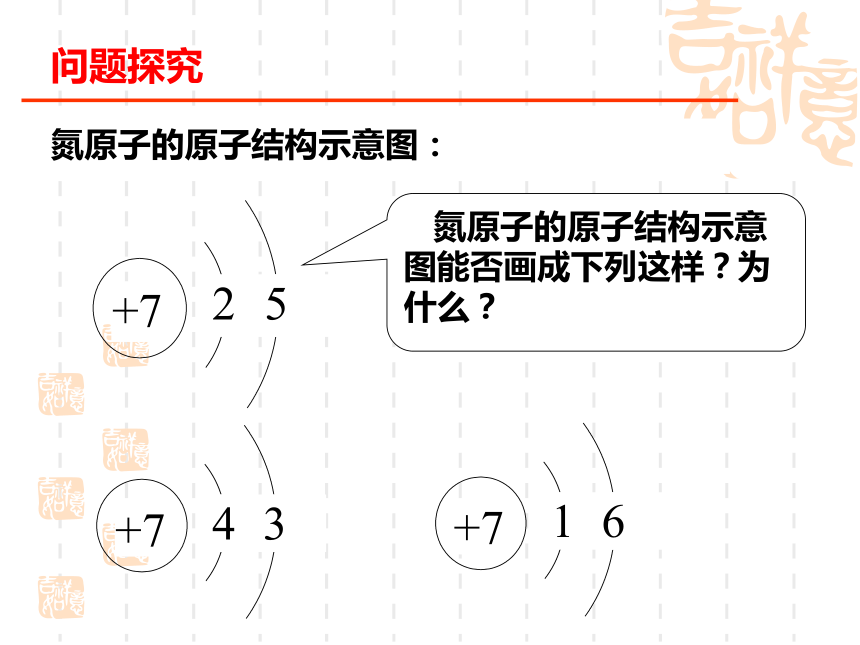
能量最低原理、泡利不相容原理、 洪特规则原子核外电子的运动氮原子的原子结构示意图: 氮原子的原子结构示意图能否画成下列这样?为什么?
问题探究一、原子核外电子排布遵循的原理和规则1.能量最低原理: 原子核外电子在排布时要先占有能量低的轨道,然后再依次进入能量较高的轨道,这样使整个原子处于最低的能量状态。思考:原子轨道的能量高低顺序1s 2s2p 3s3p3d 4s4p4d4f 5s5p5d5f5g 6s6p6d … K A.1s、2p、3d、4s
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3pC问题解决一、原子核外电子排布遵循的原理和规则2.泡利(Pauli)不相容原理: 每个原子轨道上最多只能容纳
两个自旋状态不同的电子。泡利(Wolfgang Ernst Pauli)
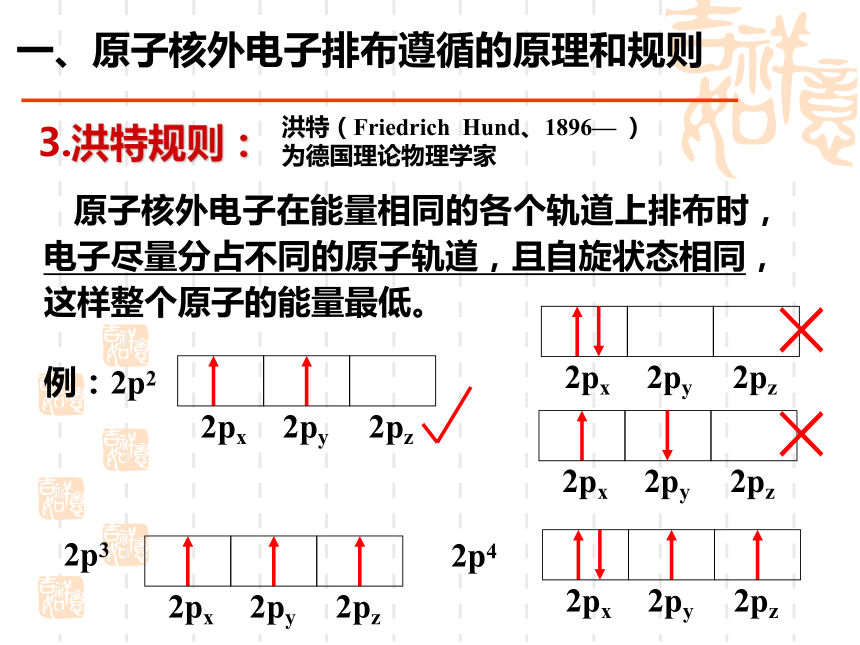
(1900~1958) × 一、原子核外电子排布遵循的原理和规则3.洪特规则:
原子核外电子在能量相同的各个轨道上排布时,
电子尽量分占不同的原子轨道,且自旋状态相同,
这样整个原子的能量最低。洪特(Friedrich??Hund、1896— )
为德国理论物理学家2p3例:2p22p4× × 二.原子核外电子排布表示方法:1.原子结构示意图N 根据核外电子的排布原则,你认为氮原子核外的7电子应该排布在哪些轨道上?每个轨道上排了几个电子?
问题与思考 根据核外电子的排布原则,你认为氮原子核外的7
电子应该排布在哪些轨道上?每个轨道上排了几个
电子?
问题与思考N电子层:原子轨道:原子轨道数:容纳的电子数: 1s2 K L 1s 2s 2p 1 1+3 2电子排布式2+32s22p3电子层数轨道类型该轨道上排入的电子数二.原子核外电子排布表示方法:2.电子排布式的书写
(1)标准式: ① 微粒符号
② 轨道符号(带电子层序数)
③ 容纳电子个数(右上角)
12Mg 3s1s2s2p2262 1s22s22p63s23p64s1 1s22s22p63s23p63d1× 19K 写出下列微粒的原子结构示意图和电子排布式:
11Na、11Na+、20Ca、35Br 问题解决Na 1s22s22p63s1Ca 1s22s22p63s23p64s2Br 1s22s22p63s23p63d104s24p5Na+ 1s22s22p6 为了避免电子排布式书写过繁,可以将内层已达
稀有气体结构的部分缩写成原子实。
原子实:[稀有气体元素符号]
2、10、18、36、54、86(2)简便式二.原子核外电子排布表示方法:Na 1s22s22p63s1
[Ne]3s1问题解决写出硫、钙、溴用原子实表示的电子排布式16S20Ca35Br注意:对大多数离子和稀有气体原子的电子排布式,不简写。如:Na+ 应1s22s22p6,不是[Ne]。二.原子核外电子排布表示方法:3.外围电子排布式 副族、Ⅷ原子的外围电子就是:最外层电子和部分次外层电子就是电子排布式省去原子实所剩余的部分;
在化学反应中,原子外围电子发生变化,而“原
子实”不受影响。
主族、零族原子的外围电子就是:最外层电子。
例:Na的电子排布式: 1s2 2s22p6 3s1 或[Ne]3S1
外围电子排布式:3S1问题解决写出硫、氩、溴、铁的外围电子排布式16S 35Br 26Fe 18Ar 3s23p43s23p64s24p5 不是3d104s24p53d64s2二.原子核外电子排布表示方法:4.轨道表示式的书写
用一个小方框表示一个原子轨道,在方框中用“↑ ”或“↓ ”表示该轨道上排入的电子的式子。电子排布式:1s22s22p3轨道表示式:NN二.原子核外电子排布表示方法: 轨道表示式的书写格式:
①元素符号
②轨道框(一个轨道一个框,能量相同的轨道连在一起)
③电子及自旋状态(↑、↓)
④轨道符号(轨道框下面)N问题解决写出C、Na、Mg的轨道表示式MgC
Na问题与思考
24Cr原子的电子排布式:1s22s22p63s23p63d44s2
29Cu原子的电子排布图:是1s22s22p63s23p63d104s1 请写出24Cr原子的电子排布式,并且与书上元素
周期表作一个对比,你会发现什么问题?1s22s22p63s23p63d94s2是1s22s22p63s23p63d54s1× × 二.原子核外电子排布表示方法:5. 洪特规则的特例相对稳定的状态
体系能量较低全充满(p6,d10,f14)全空时(p0,d0,f0)半充满(p3,d5,f7)问题解决 (1) Al: 1s2 2s22p6 3s13p2
(2) Cl: 1s2 2s22p6 3s23p5
(3) S: 1s2 2s22p6 3s33p3
(4) K: 1s2 2s22p6 3s23p63d1
(5) Ne: 1s2 2s22p6 判断下列原子的电子排布式是否正确;如不正确,说明它违反了什么原理?能量最低原理泡利不相容原理能量最低原理× × × 3s33p33d1 3s13p2 本课总结:一、原子核外电子排布遵循的原理和规则二、原子核外电子排布的表示式原子核外电子的排布能量最低原理泡利不相容原理洪特规则电子排布式轨道表示式外围电子排布式 同学们,这节课我们就上到这儿。接下来请大家完成课堂作业。请仔细审题,认真思考,工整书写,规范答题,提高准确率,充分展示这一节课的学习收获吧!
电子层、原子轨道、电子自旋
原子核外电子的排布遵循:
能量最低原理、泡利不相容原理、 洪特规则原子核外电子的运动氮原子的原子结构示意图: 氮原子的原子结构示意图能否画成下列这样?为什么?
问题探究一、原子核外电子排布遵循的原理和规则1.能量最低原理: 原子核外电子在排布时要先占有能量低的轨道,然后再依次进入能量较高的轨道,这样使整个原子处于最低的能量状态。思考:原子轨道的能量高低顺序1s 2s2p 3s3p3d 4s4p4d4f 5s5p5d5f5g 6s6p6d … K
B.1s、2s、3s、2p
C.2s、2p、3s、3p
D.4p、3d、4s、3pC问题解决一、原子核外电子排布遵循的原理和规则2.泡利(Pauli)不相容原理: 每个原子轨道上最多只能容纳
两个自旋状态不同的电子。泡利(Wolfgang Ernst Pauli)
(1900~1958) × 一、原子核外电子排布遵循的原理和规则3.洪特规则:
原子核外电子在能量相同的各个轨道上排布时,
电子尽量分占不同的原子轨道,且自旋状态相同,
这样整个原子的能量最低。洪特(Friedrich??Hund、1896— )
为德国理论物理学家2p3例:2p22p4× × 二.原子核外电子排布表示方法:1.原子结构示意图N 根据核外电子的排布原则,你认为氮原子核外的7电子应该排布在哪些轨道上?每个轨道上排了几个电子?
问题与思考 根据核外电子的排布原则,你认为氮原子核外的7
电子应该排布在哪些轨道上?每个轨道上排了几个
电子?
问题与思考N电子层:原子轨道:原子轨道数:容纳的电子数: 1s2 K L 1s 2s 2p 1 1+3 2电子排布式2+32s22p3电子层数轨道类型该轨道上排入的电子数二.原子核外电子排布表示方法:2.电子排布式的书写
(1)标准式: ① 微粒符号
② 轨道符号(带电子层序数)
③ 容纳电子个数(右上角)
12Mg 3s1s2s2p2262 1s22s22p63s23p64s1 1s22s22p63s23p63d1× 19K 写出下列微粒的原子结构示意图和电子排布式:
11Na、11Na+、20Ca、35Br 问题解决Na 1s22s22p63s1Ca 1s22s22p63s23p64s2Br 1s22s22p63s23p63d104s24p5Na+ 1s22s22p6 为了避免电子排布式书写过繁,可以将内层已达
稀有气体结构的部分缩写成原子实。
原子实:[稀有气体元素符号]
2、10、18、36、54、86(2)简便式二.原子核外电子排布表示方法:Na 1s22s22p63s1
[Ne]3s1问题解决写出硫、钙、溴用原子实表示的电子排布式16S20Ca35Br注意:对大多数离子和稀有气体原子的电子排布式,不简写。如:Na+ 应1s22s22p6,不是[Ne]。二.原子核外电子排布表示方法:3.外围电子排布式 副族、Ⅷ原子的外围电子就是:最外层电子和部分次外层电子就是电子排布式省去原子实所剩余的部分;
在化学反应中,原子外围电子发生变化,而“原
子实”不受影响。
主族、零族原子的外围电子就是:最外层电子。
例:Na的电子排布式: 1s2 2s22p6 3s1 或[Ne]3S1
外围电子排布式:3S1问题解决写出硫、氩、溴、铁的外围电子排布式16S 35Br 26Fe 18Ar 3s23p43s23p64s24p5 不是3d104s24p53d64s2二.原子核外电子排布表示方法:4.轨道表示式的书写
用一个小方框表示一个原子轨道,在方框中用“↑ ”或“↓ ”表示该轨道上排入的电子的式子。电子排布式:1s22s22p3轨道表示式:NN二.原子核外电子排布表示方法: 轨道表示式的书写格式:
①元素符号
②轨道框(一个轨道一个框,能量相同的轨道连在一起)
③电子及自旋状态(↑、↓)
④轨道符号(轨道框下面)N问题解决写出C、Na、Mg的轨道表示式MgC
Na问题与思考
24Cr原子的电子排布式:1s22s22p63s23p63d44s2
29Cu原子的电子排布图:是1s22s22p63s23p63d104s1 请写出24Cr原子的电子排布式,并且与书上元素
周期表作一个对比,你会发现什么问题?1s22s22p63s23p63d94s2是1s22s22p63s23p63d54s1× × 二.原子核外电子排布表示方法:5. 洪特规则的特例相对稳定的状态
体系能量较低全充满(p6,d10,f14)全空时(p0,d0,f0)半充满(p3,d5,f7)问题解决 (1) Al: 1s2 2s22p6 3s13p2
(2) Cl: 1s2 2s22p6 3s23p5
(3) S: 1s2 2s22p6 3s33p3
(4) K: 1s2 2s22p6 3s23p63d1
(5) Ne: 1s2 2s22p6 判断下列原子的电子排布式是否正确;如不正确,说明它违反了什么原理?能量最低原理泡利不相容原理能量最低原理× × × 3s33p33d1 3s13p2 本课总结:一、原子核外电子排布遵循的原理和规则二、原子核外电子排布的表示式原子核外电子的排布能量最低原理泡利不相容原理洪特规则电子排布式轨道表示式外围电子排布式 同学们,这节课我们就上到这儿。接下来请大家完成课堂作业。请仔细审题,认真思考,工整书写,规范答题,提高准确率,充分展示这一节课的学习收获吧!
