人教版九年级化学 第十一单元 课题1 生活中常见的盐—盐的化学性质(共13张PPT)
文档属性
| 名称 | 人教版九年级化学 第十一单元 课题1 生活中常见的盐—盐的化学性质(共13张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-13 10:58:32 | ||
图片预览




文档简介
(共13张PPT)
1.盐类物质是指含有 金属 离子(或 NH4+ )和 酸根 离子构成的化合物,如: 碳酸铵 (NH4)2CO3 硝酸铵 NH4NO3 硫酸钾 K2SO4 氯化铝 AlCl3
2.食盐主要成分NaCl,可以消除积雪的原因:降低水的凝固点;工业用盐是亚硝酸钠NaNO2 有毒。
3.大理石、石灰石的主要成分是CaCO3 ,可用于建筑材料和补钙剂;
4.Na2CO3,俗称为 纯碱 、苏打 ,可用于玻璃,造纸,纺织工业;碳酸氢钠NaHCO3 ,俗称为 小苏打 ,除了治疗 胃酸 过多症,还用作食品发酵剂。
【才艺展示】写出下列化学方程式:
碳酸氢钠与稀盐酸反应
碳酸钠与澄清石灰水反应
NaHCO3 + HCl =NaCl+ H2O+CO2↑
Na2CO3 + Ca(OH)2 =CaCO3↓+2NaOH
【学习目标】掌握盐与酸、碱、盐之间的反应;了解复分解反应发生的条件;熟记常见物质溶解性。
第十一 单元 盐 化肥
课题1 生活中常见的盐
第二课时 盐的化学性质
■知识点一 盐的化学性质
【知识回顾】回顾金属和金属盐溶液之间的反应实验,并填写好表格。
FeSO4 + Cu
2 Cu(NO3)2+2Ag
—
—
3 2 2AlCl3 + 3Cu
—
红
浅绿
银白
蓝
红
无
Next
新盐
新金属
附加条件:反应物的盐必须可溶于水。
如:AgCl+Fe —不反应,因为AgCl不溶于水。
盐的化学性质 反应的化学方程式 实验现象
①
盐 + 金属=
+
________ CuSO4 + Fe — 铁表面出现 色固
体,溶液变 色
AgNO3 + Cu — 铜表面出现 色固体,溶液变 色
CuCl2 + Al — 铝表面出现 色固体,溶液变 色
■知识点一 盐的化学性质
2 CaCl2+ H2O+CO2↑
2 2NaCl+ H2O+CO2↑
BaSO4↓+2HCl
AgCl↓+HNO3
气泡
大量气泡
白
白
Next
新盐
新酸
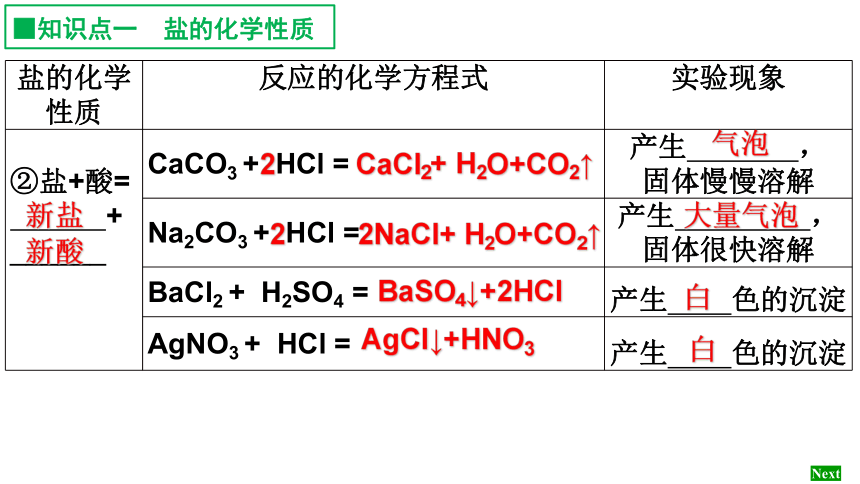
盐的化学性质 反应的化学方程式 实验现象
②盐+酸=
+
______
CaCO3 + HCl = 产生 ,
固体慢慢溶解
Na2CO3 + HCl = 产生 ,
固体很快溶解
BaCl2 + H2SO4 = 产生 色的沉淀
AgNO3 + HCl = 产生 色的沉淀
■知识点一 盐的化学性质
CaCO3↓+2NaOH
2 Na2SO4 +Cu(OH)2 ↓
3 3NaCl +Fe(OH)3 ↓
白
蓝
红褐
新盐
新碱
Next
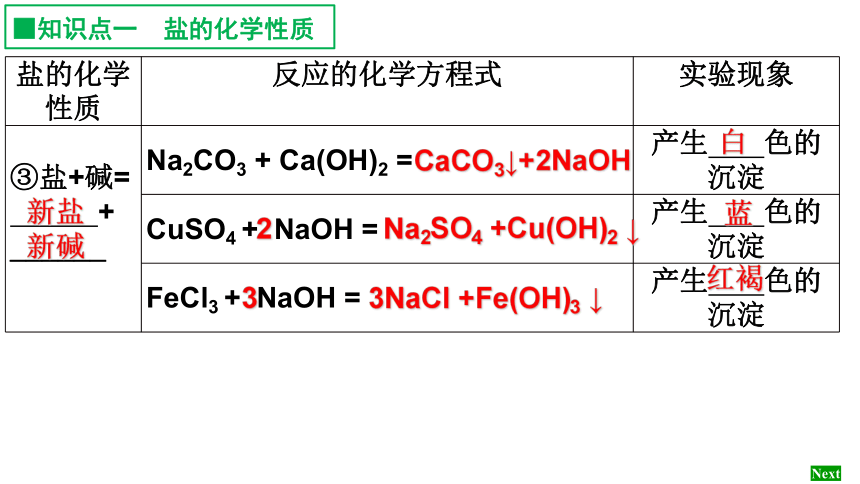
盐的化学性质 反应的化学方程式 实验现象
③盐+碱=
+
______
Na2CO3 + Ca(OH)2 = 产生 色的
沉淀
CuSO4 + NaOH = 产生 色的
沉淀
FeCl3 + NaOH = 产生 色的
沉淀
■知识点一 盐的化学性质
BaCO3↓+2NaCl
BaSO4↓+2NaCl
白
白
盐3
盐4
Next
复分解反应:分析上述“师生活动一”中的反应,都是
互相交换成分,生成 的反应,
这样的反应叫做复分解反应。
(通式:AB+CD = AD+CB,口诀:双交换,价不变)
两种化合物
另外两种化合物
盐的化学性质 反应的化学方程式 实验现象
④盐1+盐2=
+
_______ Na2CO3 + BaCl2 = 产生 色
的沉淀
Na2SO4 + BaCl2 = 产生 色
的沉淀
◆实战演练一◆
1.氢氟酸可用于在玻璃上蚀刻图案,此过程发生的反应为:4HF+SiO2=SiF4↑+2H2O,该反应属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
2. 下列反应属于复分解反应的是( )
A.Fe+2HCl=FeCl2+H2↑ B.CO2+ 2NaOH=Na2CO3+H2O
C.H2CO3=CO2↑+H2O D.CaCO3+2HCl=CaCl2+H2O+CO2 ↑
D
D
Next
■知识点二 金属、氧化物、酸、碱、盐之间的反应小结
【师生活动二】右图是金属、氧化物、酸、碱、盐之间的反应关系图(图中连线表示能够发生反应),回答下列问题:
(1)请按表中序号各举一个符合物质类别的化学反应(写化学方程式):
① ,
② ,
③ ,
④ ,
⑤ ,
⑥ ,
⑦ ,
⑧ 。
CuO+H2SO4
HCl+NaOH
HCl+AgNO3
Ca(OH)2 +Na2CO3
Na2CO3 +BaCl2
Fe+H2SO4
Fe+CuSO4
=CuSO4 +H2O
=NaCl+H2O
=AgCl↓+HNO3
=CaCO3↓+2NaOH
=BaCO3↓+2NaCl
=FeSO4+H2↑
=FeSO4+Cu
Next
Ca(OH)2 +CO2
=CaCO3↓+H2O
■知识点二 金属、氧化物、酸、碱、盐之间的反应小结
①CuO+H2SO4
②HCl+NaOH
③HCl+AgNO3
④Ca(OH)2 +Na2CO3
⑤Na2CO3 +BaCl2
⑥Fe+H2SO4
⑦Fe+CuSO4
=CuSO4 +H2O
=NaCl+H2O
=AgCl↓+HNO3
=CaCO3↓+2NaOH
=BaCO3↓+2NaCl
=FeSO4+H2↑
=FeSO4+Cu
Next
(2)其中属于复分解反应的是 ,
(3)属于置换反应的是 ,
(4)不属基本反应类型的是 ,
(5)能生成“盐”的反应有 。
⑧Ca(OH)2 +CO2
=CaCO3↓+H2O
①②③④⑤
⑥⑦
⑧
①②③④⑤⑥⑦⑧
■知识点三 常见碱和盐的溶解性
1.常见碱和盐的溶解性规律。 (阅读书本P114,小结常见碱和盐的溶解性规律)。
碱溶钾、钙、钠、钡、氨。
KOH,Ca(OH)2, NaOH,
Ba(OH)2 , NH3·H2O
钾、钠、铵、硝盐全溶。
K+、Na+ 、 NH4+、NO3-
碳酸盐溶钾、钠、铵
K2CO3,Na2CO3 ,(NH4)2CO3
硫酸盐不溶硫酸钡 (BaSO4)
氯化物不溶氯化银 (AgCl)
NaOH
Ba(OH)2
Ca(OH)2
NH4OH
KOH
Next
K2CO3
Na2CO3
(NH4)2CO3
BaSO4
AgCl
2.熟记碱和盐常见的的沉淀:
■知识点三 常见碱和盐的溶解性
Cu(OH)2
Fe(OH)3
Mg(OH)2
MgCO3
CaCO3
BaCO3
BaSO4
AgCl
蓝色
红褐色
白色
白色
白色
白色
白色
白色
碱
碱
碱
盐
盐
盐
盐
盐
╳
╳
√
√
√
√
√
√
Next
名称 氢氧化铜 氢氧化铁 氢氧化镁 碳酸镁 碳酸钙 碳酸钡 硫酸钡 氯化银
化学式
颜色
分类
溶于
酸否
◆实战演练二◆
“部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,右表是截取溶解性表中的一部分,回答下列问题:
(1)碳酸镁的溶解性是 。
(2) ①处物质的化学式是 ;
②处物质的名称是 ;
③处物质的物质类别是 。
(3)写出一种不溶性盐的化学式 ;
微溶性碱的化学式 ,既是碳酸盐又
是钠盐的化学式 。
(4)只用水就能区分CaCO3和CaCl2的原因是它们的
不同。
微溶
H2SO4
硫酸铁
氧化物
CaCO3
Ca(OH)2
Na2CO3
溶解性
End
阴离子 阳离子 OH— Cl— SO42— CO32—
H+ ③ 溶、挥 溶① 溶、挥
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Mg2+ 不 溶 溶 微
Fe3+ 不④ 溶 溶② ―
Cu2+ 不 溶 溶 ―
1.盐类物质是指含有 金属 离子(或 NH4+ )和 酸根 离子构成的化合物,如: 碳酸铵 (NH4)2CO3 硝酸铵 NH4NO3 硫酸钾 K2SO4 氯化铝 AlCl3
2.食盐主要成分NaCl,可以消除积雪的原因:降低水的凝固点;工业用盐是亚硝酸钠NaNO2 有毒。
3.大理石、石灰石的主要成分是CaCO3 ,可用于建筑材料和补钙剂;
4.Na2CO3,俗称为 纯碱 、苏打 ,可用于玻璃,造纸,纺织工业;碳酸氢钠NaHCO3 ,俗称为 小苏打 ,除了治疗 胃酸 过多症,还用作食品发酵剂。
【才艺展示】写出下列化学方程式:
碳酸氢钠与稀盐酸反应
碳酸钠与澄清石灰水反应
NaHCO3 + HCl =NaCl+ H2O+CO2↑
Na2CO3 + Ca(OH)2 =CaCO3↓+2NaOH
【学习目标】掌握盐与酸、碱、盐之间的反应;了解复分解反应发生的条件;熟记常见物质溶解性。
第十一 单元 盐 化肥
课题1 生活中常见的盐
第二课时 盐的化学性质
■知识点一 盐的化学性质
【知识回顾】回顾金属和金属盐溶液之间的反应实验,并填写好表格。
FeSO4 + Cu
2 Cu(NO3)2+2Ag
—
—
3 2 2AlCl3 + 3Cu
—
红
浅绿
银白
蓝
红
无
Next
新盐
新金属
附加条件:反应物的盐必须可溶于水。
如:AgCl+Fe —不反应,因为AgCl不溶于水。
盐的化学性质 反应的化学方程式 实验现象
①
盐 + 金属=
+
________ CuSO4 + Fe — 铁表面出现 色固
体,溶液变 色
AgNO3 + Cu — 铜表面出现 色固体,溶液变 色
CuCl2 + Al — 铝表面出现 色固体,溶液变 色
■知识点一 盐的化学性质
2 CaCl2+ H2O+CO2↑
2 2NaCl+ H2O+CO2↑
BaSO4↓+2HCl
AgCl↓+HNO3
气泡
大量气泡
白
白
Next
新盐
新酸
盐的化学性质 反应的化学方程式 实验现象
②盐+酸=
+
______
CaCO3 + HCl = 产生 ,
固体慢慢溶解
Na2CO3 + HCl = 产生 ,
固体很快溶解
BaCl2 + H2SO4 = 产生 色的沉淀
AgNO3 + HCl = 产生 色的沉淀
■知识点一 盐的化学性质
CaCO3↓+2NaOH
2 Na2SO4 +Cu(OH)2 ↓
3 3NaCl +Fe(OH)3 ↓
白
蓝
红褐
新盐
新碱
Next
盐的化学性质 反应的化学方程式 实验现象
③盐+碱=
+
______
Na2CO3 + Ca(OH)2 = 产生 色的
沉淀
CuSO4 + NaOH = 产生 色的
沉淀
FeCl3 + NaOH = 产生 色的
沉淀
■知识点一 盐的化学性质
BaCO3↓+2NaCl
BaSO4↓+2NaCl
白
白
盐3
盐4
Next
复分解反应:分析上述“师生活动一”中的反应,都是
互相交换成分,生成 的反应,
这样的反应叫做复分解反应。
(通式:AB+CD = AD+CB,口诀:双交换,价不变)
两种化合物
另外两种化合物
盐的化学性质 反应的化学方程式 实验现象
④盐1+盐2=
+
_______ Na2CO3 + BaCl2 = 产生 色
的沉淀
Na2SO4 + BaCl2 = 产生 色
的沉淀
◆实战演练一◆
1.氢氟酸可用于在玻璃上蚀刻图案,此过程发生的反应为:4HF+SiO2=SiF4↑+2H2O,该反应属于( )
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
2. 下列反应属于复分解反应的是( )
A.Fe+2HCl=FeCl2+H2↑ B.CO2+ 2NaOH=Na2CO3+H2O
C.H2CO3=CO2↑+H2O D.CaCO3+2HCl=CaCl2+H2O+CO2 ↑
D
D
Next
■知识点二 金属、氧化物、酸、碱、盐之间的反应小结
【师生活动二】右图是金属、氧化物、酸、碱、盐之间的反应关系图(图中连线表示能够发生反应),回答下列问题:
(1)请按表中序号各举一个符合物质类别的化学反应(写化学方程式):
① ,
② ,
③ ,
④ ,
⑤ ,
⑥ ,
⑦ ,
⑧ 。
CuO+H2SO4
HCl+NaOH
HCl+AgNO3
Ca(OH)2 +Na2CO3
Na2CO3 +BaCl2
Fe+H2SO4
Fe+CuSO4
=CuSO4 +H2O
=NaCl+H2O
=AgCl↓+HNO3
=CaCO3↓+2NaOH
=BaCO3↓+2NaCl
=FeSO4+H2↑
=FeSO4+Cu
Next
Ca(OH)2 +CO2
=CaCO3↓+H2O
■知识点二 金属、氧化物、酸、碱、盐之间的反应小结
①CuO+H2SO4
②HCl+NaOH
③HCl+AgNO3
④Ca(OH)2 +Na2CO3
⑤Na2CO3 +BaCl2
⑥Fe+H2SO4
⑦Fe+CuSO4
=CuSO4 +H2O
=NaCl+H2O
=AgCl↓+HNO3
=CaCO3↓+2NaOH
=BaCO3↓+2NaCl
=FeSO4+H2↑
=FeSO4+Cu
Next
(2)其中属于复分解反应的是 ,
(3)属于置换反应的是 ,
(4)不属基本反应类型的是 ,
(5)能生成“盐”的反应有 。
⑧Ca(OH)2 +CO2
=CaCO3↓+H2O
①②③④⑤
⑥⑦
⑧
①②③④⑤⑥⑦⑧
■知识点三 常见碱和盐的溶解性
1.常见碱和盐的溶解性规律。 (阅读书本P114,小结常见碱和盐的溶解性规律)。
碱溶钾、钙、钠、钡、氨。
KOH,Ca(OH)2, NaOH,
Ba(OH)2 , NH3·H2O
钾、钠、铵、硝盐全溶。
K+、Na+ 、 NH4+、NO3-
碳酸盐溶钾、钠、铵
K2CO3,Na2CO3 ,(NH4)2CO3
硫酸盐不溶硫酸钡 (BaSO4)
氯化物不溶氯化银 (AgCl)
NaOH
Ba(OH)2
Ca(OH)2
NH4OH
KOH
Next
K2CO3
Na2CO3
(NH4)2CO3
BaSO4
AgCl
2.熟记碱和盐常见的的沉淀:
■知识点三 常见碱和盐的溶解性
Cu(OH)2
Fe(OH)3
Mg(OH)2
MgCO3
CaCO3
BaCO3
BaSO4
AgCl
蓝色
红褐色
白色
白色
白色
白色
白色
白色
碱
碱
碱
盐
盐
盐
盐
盐
╳
╳
√
√
√
√
√
√
Next
名称 氢氧化铜 氢氧化铁 氢氧化镁 碳酸镁 碳酸钙 碳酸钡 硫酸钡 氯化银
化学式
颜色
分类
溶于
酸否
◆实战演练二◆
“部分酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,右表是截取溶解性表中的一部分,回答下列问题:
(1)碳酸镁的溶解性是 。
(2) ①处物质的化学式是 ;
②处物质的名称是 ;
③处物质的物质类别是 。
(3)写出一种不溶性盐的化学式 ;
微溶性碱的化学式 ,既是碳酸盐又
是钠盐的化学式 。
(4)只用水就能区分CaCO3和CaCl2的原因是它们的
不同。
微溶
H2SO4
硫酸铁
氧化物
CaCO3
Ca(OH)2
Na2CO3
溶解性
End
阴离子 阳离子 OH— Cl— SO42— CO32—
H+ ③ 溶、挥 溶① 溶、挥
Na+ 溶 溶 溶 溶
Ca2+ 微 溶 微 不
Mg2+ 不 溶 溶 微
Fe3+ 不④ 溶 溶② ―
Cu2+ 不 溶 溶 ―
同课章节目录
