课题2 原子的构成 第4课时 相对原子质量 课件(42张PPT)
文档属性
| 名称 | 课题2 原子的构成 第4课时 相对原子质量 课件(42张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-13 00:00:00 | ||
图片预览











文档简介
(共42张PPT)
几种原子的质量:
一个氢原子的质量
0.000 000 000 000 000 000 000 000 001674kg
=1.674×10-27kg
一个碳原子的质量
0.000 000 000 000 000 000 000 000 01993kg
=1.993×10-26kg
原子的质量很小,记忆、计算都很不方便,怎么办?
一个铁原子的质量
0.000 000 000 000 000 000 000 000 09288kg
=9.288×10-26kg
克拉:
克拉(Ct)是宝石的质量(重量)单位,现定1克拉等于0.2克或200毫克。一克拉又分为100分,如50分即0.5克拉,以用作计算较为细小的宝石。
克拉一词,源自希腊语中的克拉「keration」,指长角豆树(或稻子豆carobseed),是一种从东亚洲广泛普及到中东的植物。由于其果子被称为具有近乎一致的重量,且钻石的重量是4c中最容易度量的特征,因而早期长角豆树就被用作珠宝和贵金属的重量单位。一克拉即等于一粒小角树种子的重量。
光年:
宇宙中天体间的距离很远很远,如果采用我们日常使用的米、千米(公里)作计量单位,那计量天体距离的数字动辄十几位、几十位,很不方便。于是天文学家就创造了一种新的计量单位--光年,即光在真空中用去一年时间所走过的距离。距离=速度×时间,光速约为每秒30万千米(每秒299,792,458米)。
1光年为9,460,730,472,580,800米。
相对原子质量
计量原子质量时,选取谁做标准呢?
相对原子质量测定的发展史
道尔顿
贝采里乌斯
康尼查罗
理查兹
相对原子质量测定的发展史
1957年提出以碳12原子的1/12为基准的方案。这一方案得到德国著名质谱学家马陶赫的支持。 1960年国际纯粹与应用化学联合会接受了这项建议,于是一个为世界公认的新相对原子质量准诞生了。
1961年,在蒙特利尔召开的国际纯粹与应用化学联合会上,正式通过这一新基准。
相对原子质量测定的发展史
中国科学院院士,于1983年当选为国际原子量委员会委员。主持测定了铟、铱、铕、铈、铒、锗、锌、镝几种元素相对原子质量的新值,被国际原子量采用为国际新标准。
中国 张青莲
相对原子质量概念
以一个碳-12原子(其中含6个质子和6个中子)质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。(符号为Ar)
苹果 100g
哈密瓜 400g
西瓜 1600g
把一个苹果作为参照物,计其相对质量为1
C12
H
O
相对原子质量计算
以一个碳-12原子(其中含6个质子和6个中子)质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。(符号为Ar)
公式:
一个碳12原子质量(kg) ×1/12
相对原子质量=
一个原子 的实际质量(kg)
思考:
已知一个C-12原子的质量为nKg,一个A原子的质量为mKg,则A原子的相对原子质量是多少?
m Kg
n Kg ×1/12
A原子的相对原子质量=
=
12m
n
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量(取整数)
已知1个碳原子的质量1.993×10-26Kg
1
练习1:已知1个碳原子的质量是1.993×10-26Kg,一个氢原子的质量为1.674×10-27kg, 求出氢原子的相对原子质量?
氢原子的相对原子质量=
1.674×10-27Kg
1
1.993×10-26Kg ×1/12
Ar(H)
=
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量
已知1个碳原子的质量1.993×10-26Kg
1
16
练习2:已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg, 求出氧原子的相对原子质量?
2.657×10-26Kg
16
1.993×10-26Kg ×1/12
氧原子的相对原子质量=
Ar(O)
=
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量
已知1个碳原子的质量1.993×10-26Kg
1
16
23
练习3:已知1个碳原子的质量1.993×10-26Kg,
一个钠原子的质量为3.818×10-26kg,求其相对
原子质量。
3.818×10-26kg
1.993×10-26kg×1/12
= 23
钠原子的相对原子质量=
Ar(Na)
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量
已知1个碳原子的质量1.993×10-26Kg
1
16
23
56
练习4:已知1个碳原子的质量1.993×10-26Kg,
一个铁原子的质量为9.288×10-26kg,求其相对原子质量。
铁原子的相对原子质量=
Ar(Fe)
9.288×10-26kg
1.993×10-26Kg ×1/12
56
=
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
1
16
23
56
1 H
氢
1.008
原子序数
元素符号
元素名称
相对原子质量
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
思考:阅读下列表格你能找到什么信息?
1
16
23
56
注意:
相对原子质量_______原子的实际质量,是个 。
(2)原子实际质量的单位是_____。
(3)相对原子质量的单位 。
不等于
比值
千克
“1”,通常省略不写
练习:
下列叙述中,正确的是( )
A.相对原子质量就是原子质量的简称
B.相对原子质量可以用克或千克作单位
C.相对原子质量是一个比值,单位为“1”
D.计算相对原子质量是以氢原子质量为标准计算
C
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
思考:阅读下列表格你能找到什么信息?
1
16
23
56
mc
×
1
12
mA
mB
mA
mc
×
1
12
Ar(A)
Ar(B)
mB
=
=
(4)原子实际质量越大,它的相对原子质量数值越_ _。
大
练习:
1、甲、乙两种原子的质量之比是2︰3,若甲的相对原子质量为12,则乙的相对原子质量为( )
A、18 B、9 C、27 D、24
2、一种碳原子和镁原子的相对原子质量分别12和24,则碳原子和镁原子的质量比是( )
A、2∶1 B、1∶2
C、1∶24 D、24∶1
A
B
练习:
现有相同质量的铜片和铝片,哪个含有的原子数目更多?
相对原子质量: Cu—63.5 Al—27
铝片
思考:阅读下列表格你能找到什么信息?
原子种类 质子数 中子数
氢 1 0
碳 6 6
氧 8 8
钠 11 12
铁 26 30
相对原子质量
1
12
16
23
56
相对原子质量Ar=质子数+中子数
思考:阅读下列表格你能找到什么信息?
粒子种类 质 量
质子 1.6726×10-27kg
中子 1.6749×10-27kg
电子 质子质量的1/1836
碳12原子
质量的1/12 1.67×10-27kg
1.电子的质量很小,整个原子的质量主要集中在原子核上。
2.质子和中子的质量跟相对原子质量标准相比较,均约等于1 。
思考:为什么相对原子质量等于质子数加中子数?
粒子种类 质量
质子 1.6726×10-27Kg
中子 1.6749×10-27Kg
碳12原子的1/12 1.67×10-27Kg
相对原子质量=
某种原子的质量
1/12 m碳
= 质子数+中子数
=
1/12 m碳
质子数 1个质子的质量+中子数 一个中子的质量
×
×
思考:为什么相对原子质量等于质子数加中子数?
粒子种类 质量
质子 1.6726×10-27Kg
中子 1.6749×10-27Kg
碳12原子的1/12 1.67×10-27Kg
原子质量=
质子数+中子数
=
1
1
质子的质量+中子的质量
每个质子质量×质子个数+每个中子质量×中子个数
原子相对质量=
交流:
本节课你都学到了哪些知识?
练习:
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
H 1 ? 0 ?
Mg 12 ? ? 24
Fe ? 26 ? 56
1、填表:
1
1
1
12
12
12
26
30
26
练习:
2、原子中决定相对原子质量大小的主要是( )
A.质子数和电子数 B.质子数和中子数
C.中子数和电子数 D.核电荷数
B
练习:
3、1991年,我国著名化学家张青莲与另一位科学家合作,测定了铟(In)元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为 ,中子数为 。
49
66
练习:
4、已知某原子中的电子、质子、中子等粒子数之和为40,其中14个粒子不带电,则该原子的相对原子质量为 。
27
谢谢观看
几种原子的质量:
一个氢原子的质量
0.000 000 000 000 000 000 000 000 001674kg
=1.674×10-27kg
一个碳原子的质量
0.000 000 000 000 000 000 000 000 01993kg
=1.993×10-26kg
原子的质量很小,记忆、计算都很不方便,怎么办?
一个铁原子的质量
0.000 000 000 000 000 000 000 000 09288kg
=9.288×10-26kg
克拉:
克拉(Ct)是宝石的质量(重量)单位,现定1克拉等于0.2克或200毫克。一克拉又分为100分,如50分即0.5克拉,以用作计算较为细小的宝石。
克拉一词,源自希腊语中的克拉「keration」,指长角豆树(或稻子豆carobseed),是一种从东亚洲广泛普及到中东的植物。由于其果子被称为具有近乎一致的重量,且钻石的重量是4c中最容易度量的特征,因而早期长角豆树就被用作珠宝和贵金属的重量单位。一克拉即等于一粒小角树种子的重量。
光年:
宇宙中天体间的距离很远很远,如果采用我们日常使用的米、千米(公里)作计量单位,那计量天体距离的数字动辄十几位、几十位,很不方便。于是天文学家就创造了一种新的计量单位--光年,即光在真空中用去一年时间所走过的距离。距离=速度×时间,光速约为每秒30万千米(每秒299,792,458米)。
1光年为9,460,730,472,580,800米。
相对原子质量
计量原子质量时,选取谁做标准呢?
相对原子质量测定的发展史
道尔顿
贝采里乌斯
康尼查罗
理查兹
相对原子质量测定的发展史
1957年提出以碳12原子的1/12为基准的方案。这一方案得到德国著名质谱学家马陶赫的支持。 1960年国际纯粹与应用化学联合会接受了这项建议,于是一个为世界公认的新相对原子质量准诞生了。
1961年,在蒙特利尔召开的国际纯粹与应用化学联合会上,正式通过这一新基准。
相对原子质量测定的发展史
中国科学院院士,于1983年当选为国际原子量委员会委员。主持测定了铟、铱、铕、铈、铒、锗、锌、镝几种元素相对原子质量的新值,被国际原子量采用为国际新标准。
中国 张青莲
相对原子质量概念
以一个碳-12原子(其中含6个质子和6个中子)质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。(符号为Ar)
苹果 100g
哈密瓜 400g
西瓜 1600g
把一个苹果作为参照物,计其相对质量为1
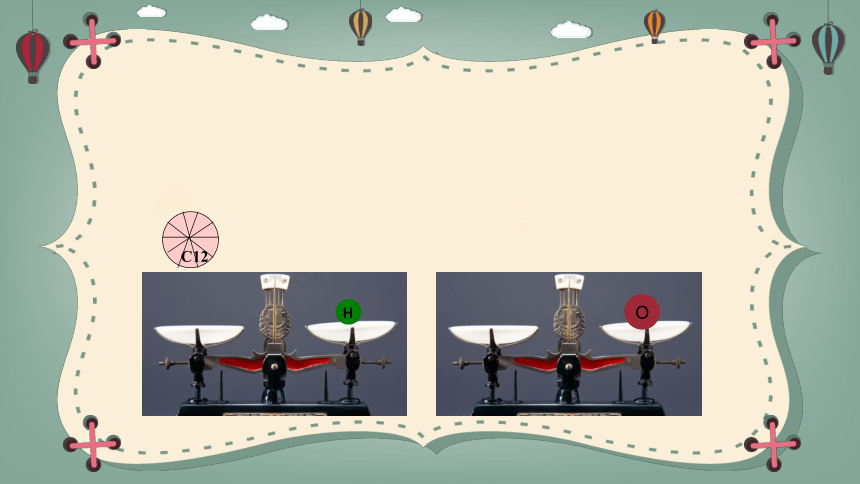
C12
H
O
相对原子质量计算
以一个碳-12原子(其中含6个质子和6个中子)质量的1/12为标准,其他原子的质量跟它相比较所得的比值,作为这种原子的相对原子质量。(符号为Ar)
公式:
一个碳12原子质量(kg) ×1/12
相对原子质量=
一个原子 的实际质量(kg)
思考:
已知一个C-12原子的质量为nKg,一个A原子的质量为mKg,则A原子的相对原子质量是多少?
m Kg
n Kg ×1/12
A原子的相对原子质量=
=
12m
n
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量(取整数)
已知1个碳原子的质量1.993×10-26Kg
1
练习1:已知1个碳原子的质量是1.993×10-26Kg,一个氢原子的质量为1.674×10-27kg, 求出氢原子的相对原子质量?
氢原子的相对原子质量=
1.674×10-27Kg
1
1.993×10-26Kg ×1/12
Ar(H)
=
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量
已知1个碳原子的质量1.993×10-26Kg
1
16
练习2:已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg, 求出氧原子的相对原子质量?
2.657×10-26Kg
16
1.993×10-26Kg ×1/12
氧原子的相对原子质量=
Ar(O)
=
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量
已知1个碳原子的质量1.993×10-26Kg
1
16
23
练习3:已知1个碳原子的质量1.993×10-26Kg,
一个钠原子的质量为3.818×10-26kg,求其相对
原子质量。
3.818×10-26kg
1.993×10-26kg×1/12
= 23
钠原子的相对原子质量=
Ar(Na)
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
请计算下列原子的相对原子质量
已知1个碳原子的质量1.993×10-26Kg
1
16
23
56
练习4:已知1个碳原子的质量1.993×10-26Kg,
一个铁原子的质量为9.288×10-26kg,求其相对原子质量。
铁原子的相对原子质量=
Ar(Fe)
9.288×10-26kg
1.993×10-26Kg ×1/12
56
=
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
1
16
23
56
1 H
氢
1.008
原子序数
元素符号
元素名称
相对原子质量
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
思考:阅读下列表格你能找到什么信息?
1
16
23
56
注意:
相对原子质量_______原子的实际质量,是个 。
(2)原子实际质量的单位是_____。
(3)相对原子质量的单位 。
不等于
比值
千克
“1”,通常省略不写
练习:
下列叙述中,正确的是( )
A.相对原子质量就是原子质量的简称
B.相对原子质量可以用克或千克作单位
C.相对原子质量是一个比值,单位为“1”
D.计算相对原子质量是以氢原子质量为标准计算
C
原子
种类 1个原子的质量 相对原
子质量
氢 1.674×10-27kg
氧 2.657×10-26kg
钠 3.818×10-26kg
铁 9.288×10-26kg
思考:阅读下列表格你能找到什么信息?
1
16
23
56
mc
×
1
12
mA
mB
mA
mc
×
1
12
Ar(A)
Ar(B)
mB
=
=
(4)原子实际质量越大,它的相对原子质量数值越_ _。
大
练习:
1、甲、乙两种原子的质量之比是2︰3,若甲的相对原子质量为12,则乙的相对原子质量为( )
A、18 B、9 C、27 D、24
2、一种碳原子和镁原子的相对原子质量分别12和24,则碳原子和镁原子的质量比是( )
A、2∶1 B、1∶2
C、1∶24 D、24∶1
A
B
练习:
现有相同质量的铜片和铝片,哪个含有的原子数目更多?
相对原子质量: Cu—63.5 Al—27
铝片
思考:阅读下列表格你能找到什么信息?
原子种类 质子数 中子数
氢 1 0
碳 6 6
氧 8 8
钠 11 12
铁 26 30
相对原子质量
1
12
16
23
56
相对原子质量Ar=质子数+中子数
思考:阅读下列表格你能找到什么信息?
粒子种类 质 量
质子 1.6726×10-27kg
中子 1.6749×10-27kg
电子 质子质量的1/1836
碳12原子
质量的1/12 1.67×10-27kg
1.电子的质量很小,整个原子的质量主要集中在原子核上。
2.质子和中子的质量跟相对原子质量标准相比较,均约等于1 。
思考:为什么相对原子质量等于质子数加中子数?
粒子种类 质量
质子 1.6726×10-27Kg
中子 1.6749×10-27Kg
碳12原子的1/12 1.67×10-27Kg
相对原子质量=
某种原子的质量
1/12 m碳
= 质子数+中子数
=
1/12 m碳
质子数 1个质子的质量+中子数 一个中子的质量
×
×
思考:为什么相对原子质量等于质子数加中子数?
粒子种类 质量
质子 1.6726×10-27Kg
中子 1.6749×10-27Kg
碳12原子的1/12 1.67×10-27Kg
原子质量=
质子数+中子数
=
1
1
质子的质量+中子的质量
每个质子质量×质子个数+每个中子质量×中子个数
原子相对质量=
交流:
本节课你都学到了哪些知识?
练习:
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
H 1 ? 0 ?
Mg 12 ? ? 24
Fe ? 26 ? 56
1、填表:
1
1
1
12
12
12
26
30
26
练习:
2、原子中决定相对原子质量大小的主要是( )
A.质子数和电子数 B.质子数和中子数
C.中子数和电子数 D.核电荷数
B
练习:
3、1991年,我国著名化学家张青莲与另一位科学家合作,测定了铟(In)元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为 ,中子数为 。
49
66
练习:
4、已知某原子中的电子、质子、中子等粒子数之和为40,其中14个粒子不带电,则该原子的相对原子质量为 。
27
谢谢观看
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
