高考化学百日冲刺基础知识回归与巩固:《化学实验装置》(PDF版)
文档属性
| 名称 | 高考化学百日冲刺基础知识回归与巩固:《化学实验装置》(PDF版) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-13 09:00:23 | ||
图片预览


文档简介
高考化学百日冲刺基础知识回归与巩固:
化学实验装置
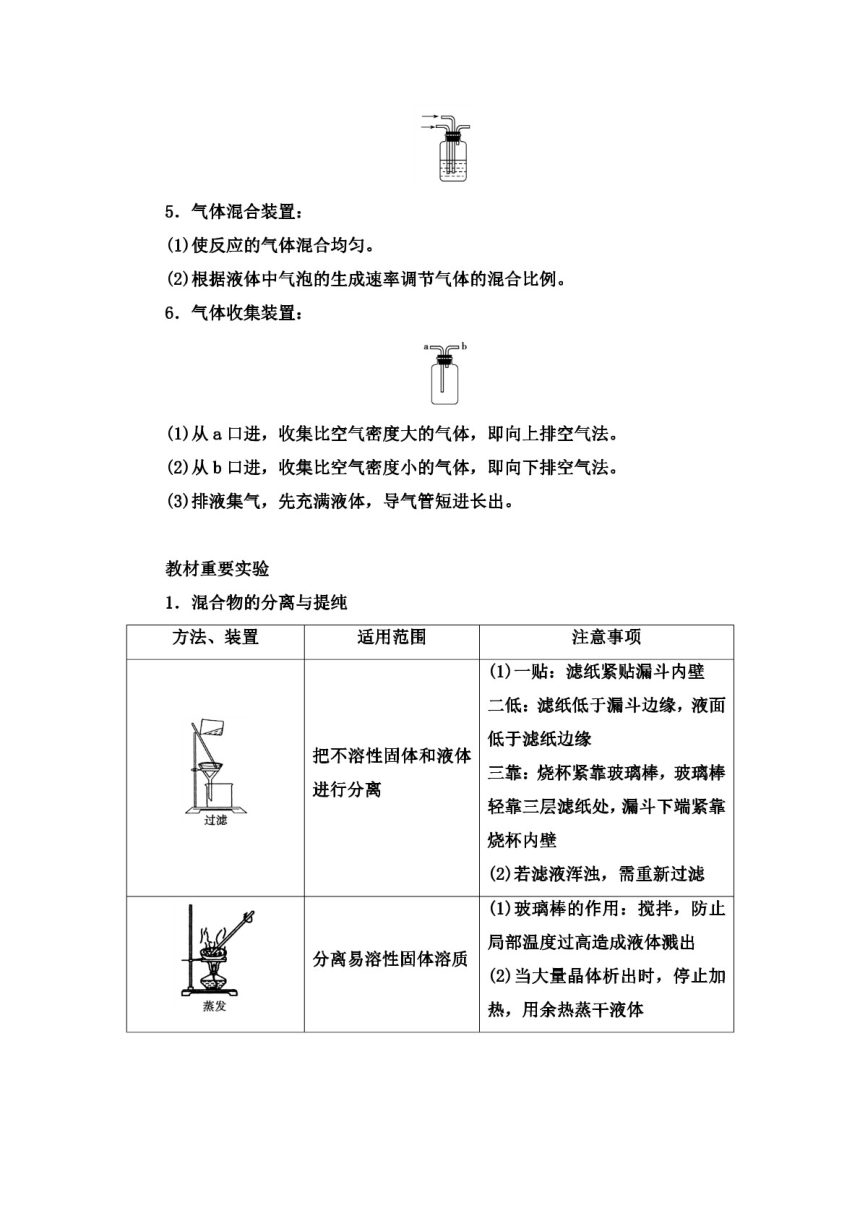
化学实验中常见的6组仪器“套装”
1.防倒吸装置:
水
丙
丁
戊
2.尾气处理防污染装置:
气球
燃烧式
收集式
吸收式I
吸收式Ⅱ
(1)易溶性有毒气体,如NH3、HCl、S02用吸收式Ⅱ进行尾气处理。
(2)C0等不易被吸收的有害气体可用燃烧式或收集式处理。
3.量气装置:
甲日日乙
B
C
4.冷凝回流装置:
(1)当反应物易挥发时,为防止反应物过多挥发损耗,可进行冷凝回流。
(2)甲相当于空气冷凝,乙、丙是用水冷凝,注意水从下口通入,上口流出
5.气体混合装置:
(1)使反应的气体混合均匀。
(2)根据液体中气泡的生成速率调节气体的混合比例。
6.气体收集装置:
(1)从a口进,收集比空气密度大的气体,即向上排空气法。
(2)从b口进,收集比空气密度小的气体,即向下排空气法。
(3)排液集气,先充满液体,导气管短进长出。
教材重要实验
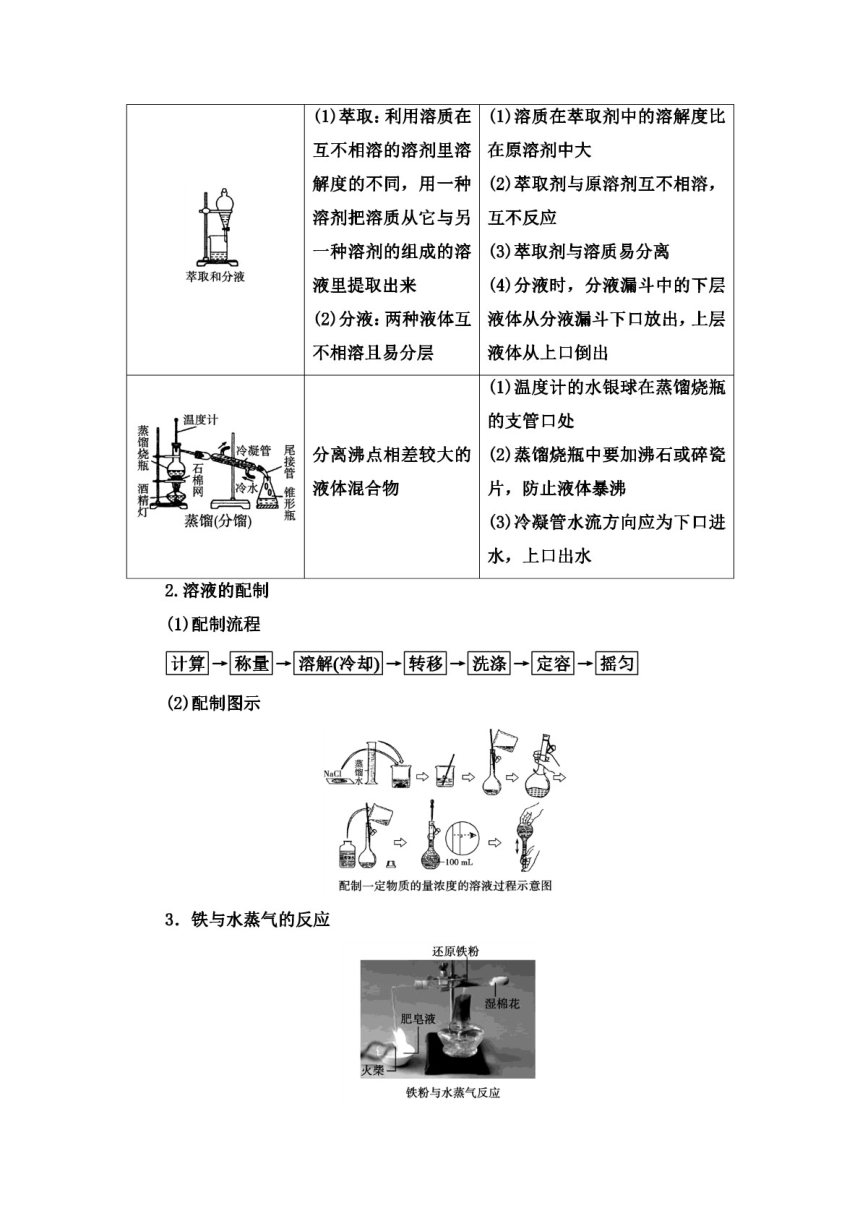
1.混合物的分离与提纯
方法、装置
适用范围
注意事项
(1)一贴:滤纸紧贴漏斗内壁
二低:滤纸低于漏斗边缘,液面
把不溶性固体和液体/滤纸边缘
三靠:烧杯紧靠玻璃棒,玻璃棒
进行分离
轻靠三层滤纸处,漏斗下端紧靠
过滤
烧杯内壁
(2)若滤液浑浊,需重新过滤
(1)玻璃棒的作用:搅拌,防止
局部温度过高造成液体溅出
分离易溶性固体溶质
(2)当大量晶体析出时,停止加
蒸发
热,用余热蒸干液体
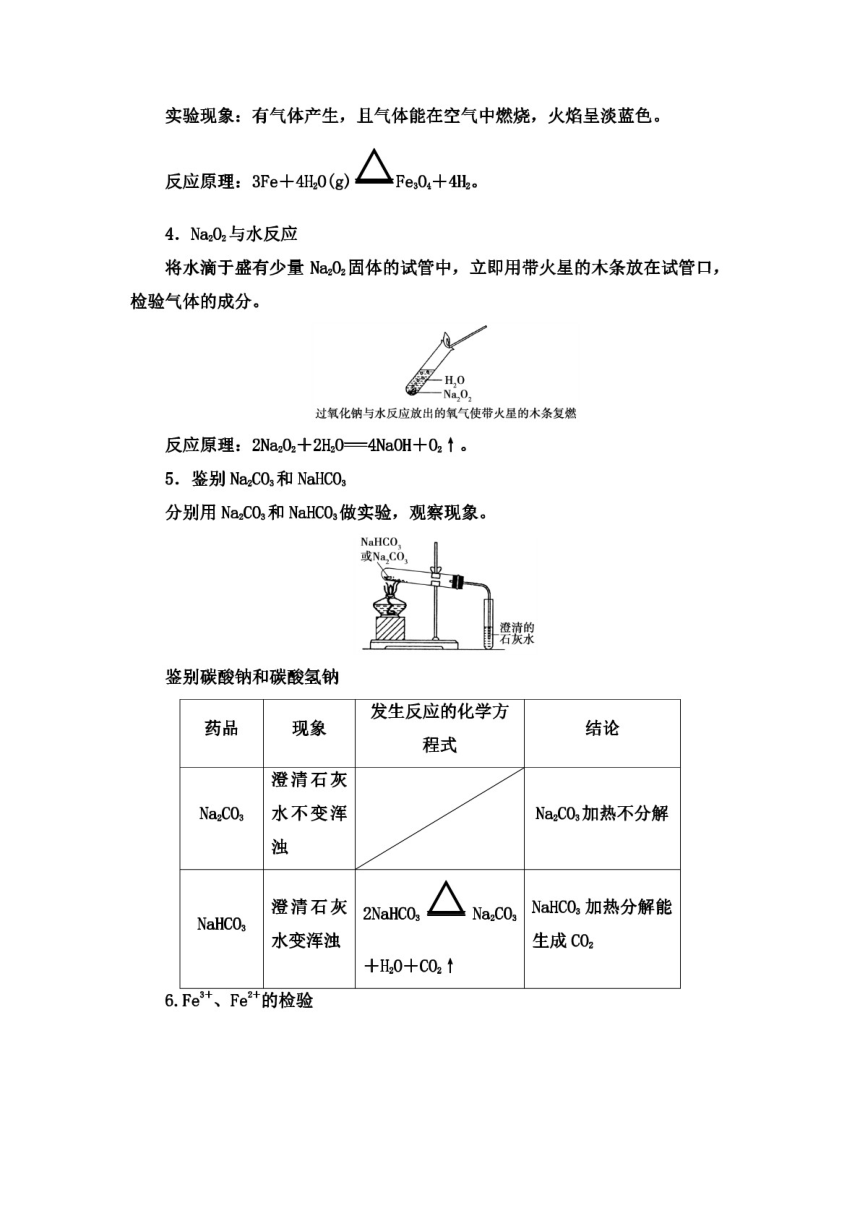
(1)萃取利用溶质在(1)溶质在萃取剂中的溶解度比
互不相溶的溶剂里溶在原溶剂中大
解度的不同,用一种(2)萃取剂与原溶剂互不相溶,
溶剂把溶质从它与另互不反应
种溶剂的组成的溶(3)萃取剂与溶质易分离
萃取和分液
液里提取出来
(4)分液时,分液漏斗中的下层
(2)分液:两种液体互液体从分液漏斗下口放出,上层
不相溶且易分层
液体从上口倒出
(1)温度计的水银球在蒸馏烧瓶
蒸1温度计
的支管口处
烧
冷凝管摆分离沸点相差较大的(2)蒸馏烧瓶中要加沸石或碎瓷
瓶
m嚮永重液体混合物
片,防止液体暴沸
精
形
蒸馏(分馏
(3)冷凝管水流方向应为下口进
水,上口出水
2.溶液的配制
(1)配制流程
计算→称量→溶解冷却→转秘→洗涤→〖定容→摇匀
(2)配制图示
NdF8
配制一定物质的量浓度的溶液过程示意图
3.铁与水蒸气的反应
还原铁粉
湿棉花
肥皂液
灭柴
铁粉与水蒸气反应
实验现象:有气体产生,且气体能在空气中燃烧,火焰呈淡蓝色。
反应原理:3Fe+4H20(g)厶Fe04+4H
4.Na202与水反应
将水滴于盛有少量Na2O2固体的试管中,立即用带火星的木条放在试管口,
检验气体的成分。
H O
Na.O
过氧化钠与水反应放出的氧气使带火星的木条复燃
反应原理:2Na202+2H20=4NaOH+02↑。
5.鉴别Na2CO3和 NaHCO3
分别用Na2C03和 NahcO做实验,观察现象。
NaHCo
或Na,CO
澄清的
石灰水
鉴别碳酸钠和碳酸氢钠
发生反应的化学方
药品
现象
结论
程式
澄清石灰
NaCO3水不变浑
Na2CO3加热不分解
浊
Nahco
澄清石灰|2NaHO
△
Na|a0加热分解能
水变浑浊
生成CO
H0+CO2↑
6.Fe3+、Fe2的检验
化学实验装置
化学实验中常见的6组仪器“套装”
1.防倒吸装置:
水
丙
丁
戊
2.尾气处理防污染装置:
气球
燃烧式
收集式
吸收式I
吸收式Ⅱ
(1)易溶性有毒气体,如NH3、HCl、S02用吸收式Ⅱ进行尾气处理。
(2)C0等不易被吸收的有害气体可用燃烧式或收集式处理。
3.量气装置:
甲日日乙
B
C
4.冷凝回流装置:
(1)当反应物易挥发时,为防止反应物过多挥发损耗,可进行冷凝回流。
(2)甲相当于空气冷凝,乙、丙是用水冷凝,注意水从下口通入,上口流出
5.气体混合装置:
(1)使反应的气体混合均匀。
(2)根据液体中气泡的生成速率调节气体的混合比例。
6.气体收集装置:
(1)从a口进,收集比空气密度大的气体,即向上排空气法。
(2)从b口进,收集比空气密度小的气体,即向下排空气法。
(3)排液集气,先充满液体,导气管短进长出。
教材重要实验
1.混合物的分离与提纯
方法、装置
适用范围
注意事项
(1)一贴:滤纸紧贴漏斗内壁
二低:滤纸低于漏斗边缘,液面
把不溶性固体和液体/滤纸边缘
三靠:烧杯紧靠玻璃棒,玻璃棒
进行分离
轻靠三层滤纸处,漏斗下端紧靠
过滤
烧杯内壁
(2)若滤液浑浊,需重新过滤
(1)玻璃棒的作用:搅拌,防止
局部温度过高造成液体溅出
分离易溶性固体溶质
(2)当大量晶体析出时,停止加
蒸发
热,用余热蒸干液体
(1)萃取利用溶质在(1)溶质在萃取剂中的溶解度比
互不相溶的溶剂里溶在原溶剂中大
解度的不同,用一种(2)萃取剂与原溶剂互不相溶,
溶剂把溶质从它与另互不反应
种溶剂的组成的溶(3)萃取剂与溶质易分离
萃取和分液
液里提取出来
(4)分液时,分液漏斗中的下层
(2)分液:两种液体互液体从分液漏斗下口放出,上层
不相溶且易分层
液体从上口倒出
(1)温度计的水银球在蒸馏烧瓶
蒸1温度计
的支管口处
烧
冷凝管摆分离沸点相差较大的(2)蒸馏烧瓶中要加沸石或碎瓷
瓶
m嚮永重液体混合物
片,防止液体暴沸
精
形
蒸馏(分馏
(3)冷凝管水流方向应为下口进
水,上口出水
2.溶液的配制
(1)配制流程
计算→称量→溶解冷却→转秘→洗涤→〖定容→摇匀
(2)配制图示
NdF8
配制一定物质的量浓度的溶液过程示意图
3.铁与水蒸气的反应
还原铁粉
湿棉花
肥皂液
灭柴
铁粉与水蒸气反应
实验现象:有气体产生,且气体能在空气中燃烧,火焰呈淡蓝色。
反应原理:3Fe+4H20(g)厶Fe04+4H
4.Na202与水反应
将水滴于盛有少量Na2O2固体的试管中,立即用带火星的木条放在试管口,
检验气体的成分。
H O
Na.O
过氧化钠与水反应放出的氧气使带火星的木条复燃
反应原理:2Na202+2H20=4NaOH+02↑。
5.鉴别Na2CO3和 NaHCO3
分别用Na2C03和 NahcO做实验,观察现象。
NaHCo
或Na,CO
澄清的
石灰水
鉴别碳酸钠和碳酸氢钠
发生反应的化学方
药品
现象
结论
程式
澄清石灰
NaCO3水不变浑
Na2CO3加热不分解
浊
Nahco
澄清石灰|2NaHO
△
Na|a0加热分解能
水变浑浊
生成CO
H0+CO2↑
6.Fe3+、Fe2的检验
同课章节目录
