苏教版高三化学选修6专题4课题3:反应条件对化学平衡的影响课件(共27张PPT)
文档属性
| 名称 | 苏教版高三化学选修6专题4课题3:反应条件对化学平衡的影响课件(共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-13 09:33:37 | ||
图片预览




文档简介
(共27张PPT)
课题3
反应条件对化学平衡的影响
Linsharplrdspear
2020-02-18
《实验化学》专题4
提出问题
汽车尾气的主要成分是什么?
汽车尾气净化的主要原理是什么?
从我们已有知识,从原理上你会采取哪些措施来减少尾气的排放?
汽车尾气引起的环境问题愈发的尖锐
科学家正致力于研究减少汽车尾气中有毒物质的排放
知识预备:化学平衡状态和化学平衡移动
加快化学反应速率;
使反应平衡正向移动;
基本知识再现1:
对于可逆反应,一定条件下达到了平衡:
(1)若化学反应速率发生了改变,平衡一定发生移动吗?
(2)若平衡发生移动,化学反应速率一定改变吗?
1.某温度下,密闭容器中发生 反应2CO(g)+2NO(g) ? N2(g)+2CO2(g) △H<0 ,建立化学平衡后,t1改变条件对该反应的正、逆反应速率的影响如图所示:
(1)增大C(NO)对反应速率影响的图像是 ,平衡 移动。
B
向右
题组训练
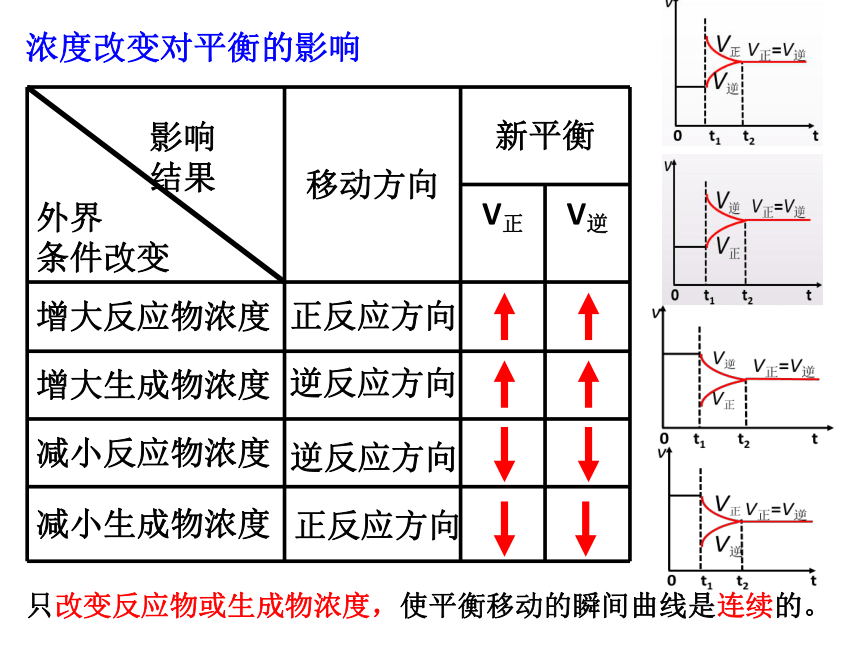
只改变反应物或生成物浓度,使平衡移动的瞬间曲线是连续的。
浓度改变对平衡的影响
正反应方向
逆反应方向
逆反应方向
正反应方向
影响
结果
外界
条件改变 移动方向 新平衡
V正
V逆
增大反应物浓度
增大生成物浓度
减小反应物浓度
减小生成物浓度
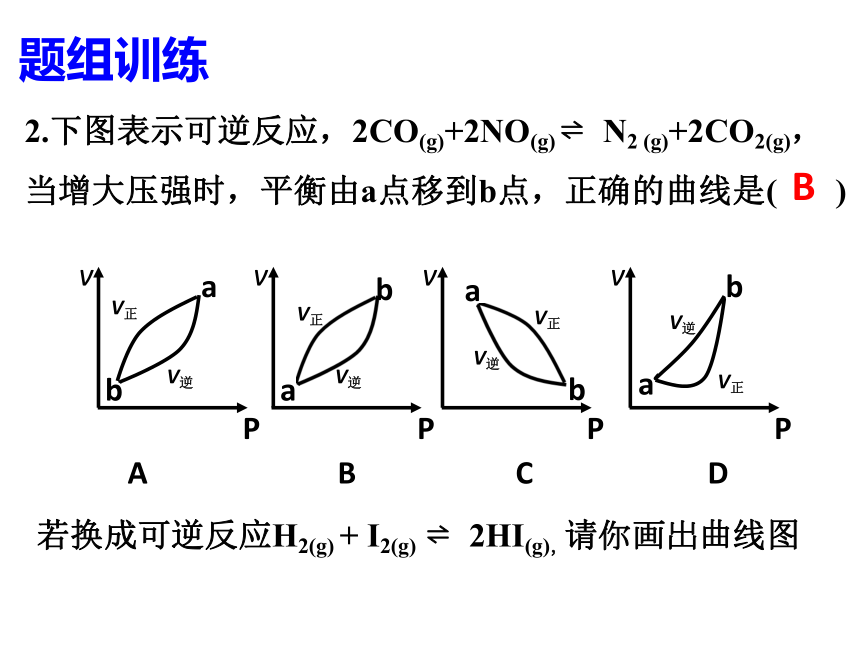
2.下图表示可逆反应,2CO(g)+2NO(g) ? N2 (g)+2CO2(g),当增大压强时,平衡由a点移到b点,正确的曲线是( )
A B C D
若换成可逆反应H2(g) + I2(g) ? 2HI(g),请你画出曲线图
B
题组训练
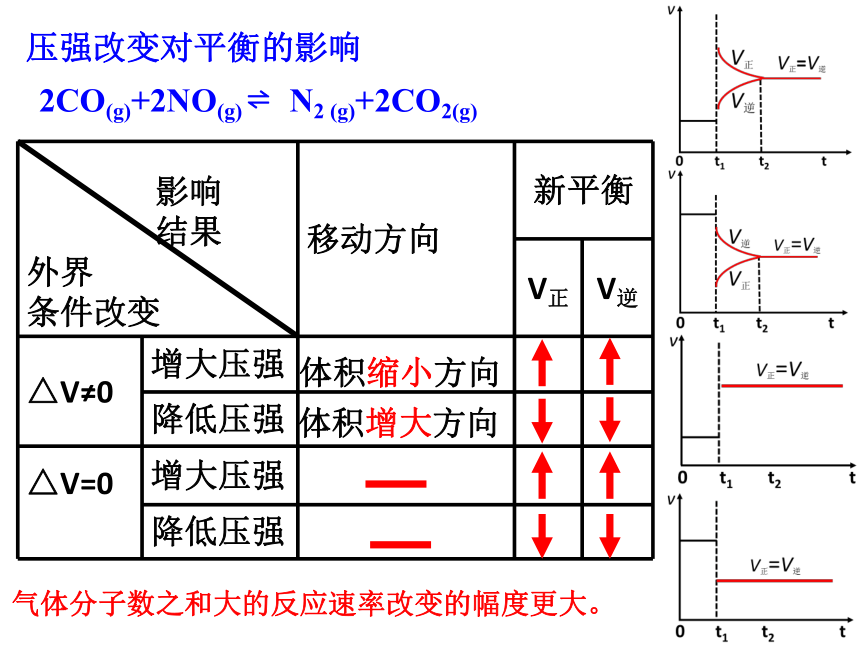
气体分子数之和大的反应速率改变的幅度更大。
体积缩小方向
体积增大方向
2CO(g)+2NO(g) ? N2 (g)+2CO2(g)
压强改变对平衡的影响
影响
结果
外界
条件改变 移动方向 新平衡
V正 V逆
△V≠0 增大压强
降低压强
△V=0
增大压强
降低压强
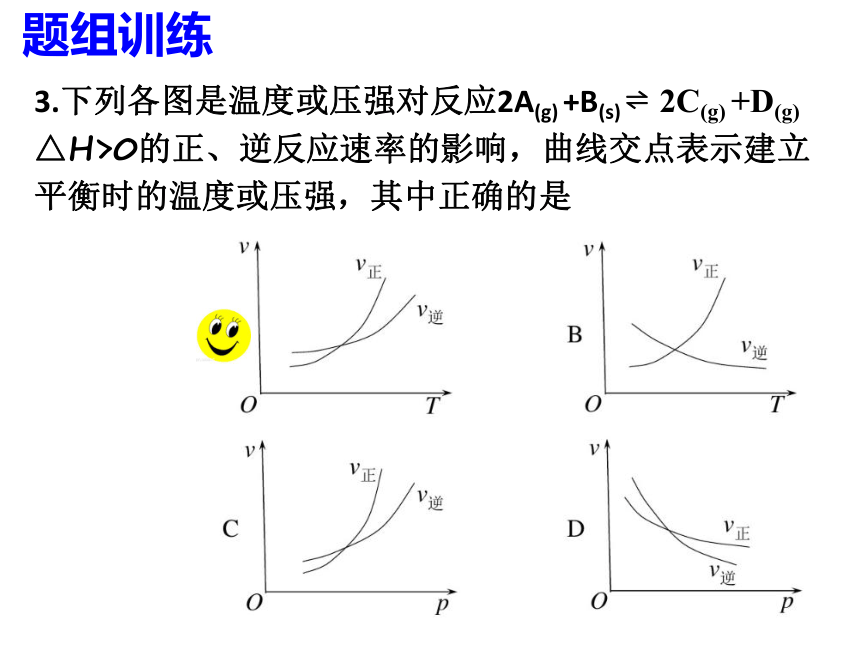
3.下列各图是温度或压强对反应2A(g) +B(s) ?2C(g) +D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
题组训练
吸热反应方向的速率变化幅度更大
吸热方向
放热方向
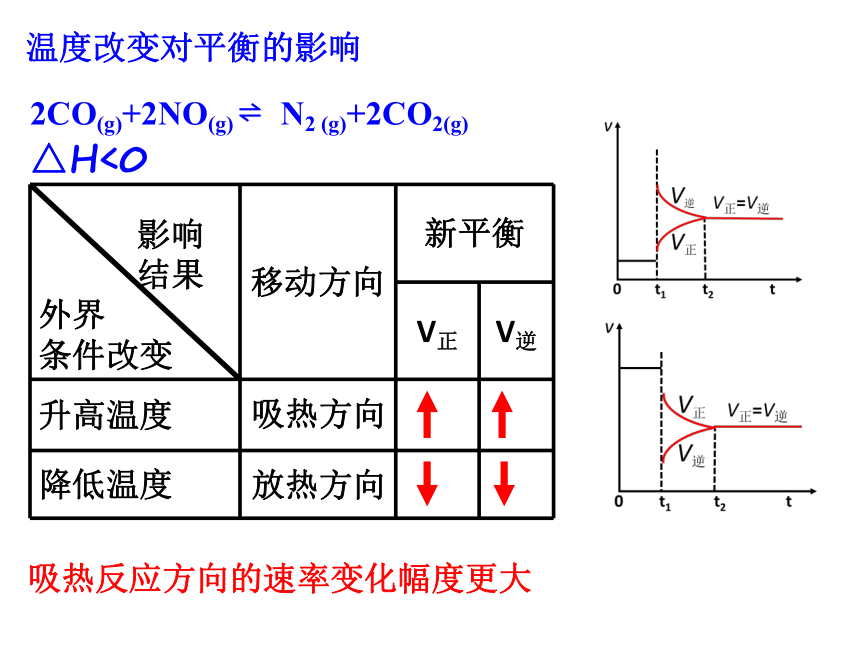
2CO(g)+2NO(g) ? N2 (g)+2CO2(g) △H<0
温度改变对平衡的影响
影响
结果
外界
条件改变 移动方向 新平衡
V正 V逆
升高温度
降低温度
题组训练
催化剂
催化剂对化学平衡移动无影响,它能同等程度地改变正、逆反应速率,可以改变化学反应达到平衡所需的时间。
小结:
1. 化学反应速率的改变不一定会影响化学平衡的移动;
2. 只有当化学反应速率改变的幅度不一样,才会发生平衡移动;
3.化学平衡发生移动,化学反应速率必然改变。
原平衡
V正=V逆
原平衡被破坏
V正’≠V逆’
新平衡
V正’’=V逆’’
勒夏特列原理---平衡移动原理(实质是“叛逆”): 如果改变影响平衡的一个条件(浓度、压强、温度),平衡就向能够减弱这种改变的方向移动
基本知识再现2:
工农业生产中如何运用勒夏特列原理来选择反应条件:
(1)合成氨工业条件选择温度越高越好吗?
(2) SO2接触氧化工业条件选择压强越高越好吗?
1.合成氨工业条件选择
N2+3H2 ? 2NH3 △H<0
特征:
速率:
平衡:
综合:
实际:
所有物质都是气体,正反应体积缩小,放热
高温、高压、浓度、催化剂
低温、高压、及时分离出氨气
适当温度、高压、催化剂、及时分离出氨气
500℃,高压(20-50MPa)、铁触媒、氨气液化
2. SO2接触氧化工业条件选择
2SO2+O2 ? 2SO3 △H<0
特征:
速率:
平衡:
综合:
实际:
所有物质都是气体,正反应体积缩小,放热
高温、高压、催化剂、浓度(O2)
低温、高压、浓度(O2)
适当温度、高压、催化剂、氧气过量
高温,常压、催化剂、氧气过量
研究表明,NO和CO 反应比较难反应(反应速率很慢),请你试用碰撞理论来解释原因?可采取哪些措施加快反应速率?
单位时间单位体积有效碰撞次数增多
反应速率加快
活化分子百分数
增加
单位体积内活化分子数增加
增大反应物浓度
催化剂
升高温度
增大气体压强
深度思考1:
5.下列事实中,是什么因素影响了化学反应速率?
(1)同浓度、同体积的盐酸中放入大小相同的锌片和镁条,产生气体有快有慢;
(2)融化的KClO3放出气体很慢,撒入少量的MnO2后很快有气体产生了;
(3)锌粉与碘混合后,无明显现象,当加入几滴水时,立即有紫红色蒸气产生;
(4)无色的KI晶体与白色的HgCl2粉末混合时,无明显现象,若将其加入水中,立即有红色的HgI2生成;
(5)集气瓶中充满Cl2和H2的混合气体,在瓶外点燃镁条时发生爆炸;
(6)铁片与稀硫酸制取氢气时,滴加少量CuSO4溶液,可加快产生H2的速率。
反应物的性质
催化剂
催化剂
溶剂
光和热
原电池
题组训练
思路1:加快化学反应速率
措施:合适的催化剂、加热、加压、增大反应物浓度、增大接触面积……
研究表明,NO和CO 反应的转化率比较低,请结合勒夏特列原理,采取哪些措施来减少尾气的排放?
深度思考2:
思路2:使反应平衡右移
措施:降温、加压、减小生成物浓度、增大反应物浓度……
思路1:加快化学反应速率
措施:催化剂、加热、加压、增大反应物浓度、增大接触面积……
综合措施:
合适的催化剂,适宜的温度
增大接触面积,移走生成物
密闭容器:2CO(g)+2NO(g) ? N2(g)+2CO2(g) △H<0 ,
适宜的温度
合适的催化剂
用三效催化剂和电子控制发动机系统,可使碳氢化合物和一氧化碳排放减少90%--95%,氮氧化物减少80%--90%,使汽车尾气得到很大的治理与净化。
增大接触面积
催化剂做成网状结构,或者“蜂窝煤” 结构,增大接触面积,加快反应速率。
问题解决
1. 加快反应速率
减小生成物的浓度
将CO2和N2转移出去,可以考虑在尾气排放装置加上一个小型风扇,加速尾气排放,生成物减少,反应正向更彻底。
问题解决
2. 平衡移动
1. 增大排气管,即增大排气管截面的面积,面积越大催化越完全。
2. 将排气管做成螺旋状,增加了长度,延长反应时间,催化反应更完全,减少尾气排放。
3. 延长反应时间
4. 从源头解决:
如控制汽油的辛烷值,使用无铅汽油,控制空燃比,改用乙醇等清洁燃料,使用电动汽车等等。
能力提升
1.解决生活中具体的化学问题思路:
2.速率、平衡理论在化工生产上的应用,
进行化工生产条件选择时:
既要考虑反应速率的问题 ------反应速率要尽可能的快
又要考虑化学平衡的问题 ------平衡要尽可能地向右移动,即反应物的转化率尽可能高,原料利用率尽可能充分。
实验1:氯化钴溶液颜色的变化
观察稀释酸性CoCl2溶液时颜色的变化
操作: 向3mL0.5mol·L-1CoCl2溶液中慢慢滴加约6mL浓盐酸,观察现象
将上述试管中的溶液分成两份,向其中一溶液中加入约3mL蒸馏水,与另一溶液作对比,观察现象
蓝色 粉红色
蓝色加深
增大了Cl-浓度,
平衡向左移动
蓝色转化为粉红色
平衡向右移动
实 验 现 象 现 象 分 析
CoCl2+浓盐酸
加入3mL蒸馏水
(2)观察受热时CoCl2溶液颜色的变化
操作:取一支试管,加入3 mL95%乙醇溶液和少量(2-3小粒)氯化钴晶体,振荡使其溶解,再滴滴加蒸馏水,至溶液恰好呈粉红色,然后用酒精灯加热该试管片刻。观察上述实验过程中溶液颜色的变化
加乙醇溶解后溶液呈蓝色
稀释时,溶液由蓝色→紫色→很快变成粉红色(平衡向左移动);
加热时,又由粉红色→紫色→蓝色(平衡向右移动)
实验2:探究影响乙酸乙酯水解程度的因素
试管1:
4 mL蒸馏水+2滴甲基橙 + 2 mL乙酸乙酯
试管2:
4 mL5 mol·L-1 H2SO4 +2滴甲基橙 + 2 mL乙酸乙酯
试管3:
4 mL10 mol·L-1NaOH溶液+2滴石蕊 + 2 mL乙酸乙酯
振荡后用透明胶带纸对液相界面做好标记。将三只试管同时插入热水浴(65℃-70℃)中,加热6-10分钟(加热过程可振荡)。取出试管观察液相界面情况。
溶液显黄色
现象
1.试管液相无明显变化;
2.试管液相界面略有上升;
3.试管液相界面明显上升,石蕊蓝色褪去。
溶液呈红色
溶液呈蓝色
课题3
反应条件对化学平衡的影响
Linsharplrdspear
2020-02-18
《实验化学》专题4
提出问题
汽车尾气的主要成分是什么?
汽车尾气净化的主要原理是什么?
从我们已有知识,从原理上你会采取哪些措施来减少尾气的排放?
汽车尾气引起的环境问题愈发的尖锐
科学家正致力于研究减少汽车尾气中有毒物质的排放
知识预备:化学平衡状态和化学平衡移动
加快化学反应速率;
使反应平衡正向移动;
基本知识再现1:
对于可逆反应,一定条件下达到了平衡:
(1)若化学反应速率发生了改变,平衡一定发生移动吗?
(2)若平衡发生移动,化学反应速率一定改变吗?
1.某温度下,密闭容器中发生 反应2CO(g)+2NO(g) ? N2(g)+2CO2(g) △H<0 ,建立化学平衡后,t1改变条件对该反应的正、逆反应速率的影响如图所示:
(1)增大C(NO)对反应速率影响的图像是 ,平衡 移动。
B
向右
题组训练
只改变反应物或生成物浓度,使平衡移动的瞬间曲线是连续的。
浓度改变对平衡的影响
正反应方向
逆反应方向
逆反应方向
正反应方向
影响
结果
外界
条件改变 移动方向 新平衡
V正
V逆
增大反应物浓度
增大生成物浓度
减小反应物浓度
减小生成物浓度
2.下图表示可逆反应,2CO(g)+2NO(g) ? N2 (g)+2CO2(g),当增大压强时,平衡由a点移到b点,正确的曲线是( )
A B C D
若换成可逆反应H2(g) + I2(g) ? 2HI(g),请你画出曲线图
B
题组训练
气体分子数之和大的反应速率改变的幅度更大。
体积缩小方向
体积增大方向
2CO(g)+2NO(g) ? N2 (g)+2CO2(g)
压强改变对平衡的影响
影响
结果
外界
条件改变 移动方向 新平衡
V正 V逆
△V≠0 增大压强
降低压强
△V=0
增大压强
降低压强
3.下列各图是温度或压强对反应2A(g) +B(s) ?2C(g) +D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
题组训练
吸热反应方向的速率变化幅度更大
吸热方向
放热方向
2CO(g)+2NO(g) ? N2 (g)+2CO2(g) △H<0
温度改变对平衡的影响
影响
结果
外界
条件改变 移动方向 新平衡
V正 V逆
升高温度
降低温度
题组训练
催化剂
催化剂对化学平衡移动无影响,它能同等程度地改变正、逆反应速率,可以改变化学反应达到平衡所需的时间。
小结:
1. 化学反应速率的改变不一定会影响化学平衡的移动;
2. 只有当化学反应速率改变的幅度不一样,才会发生平衡移动;
3.化学平衡发生移动,化学反应速率必然改变。
原平衡
V正=V逆
原平衡被破坏
V正’≠V逆’
新平衡
V正’’=V逆’’
勒夏特列原理---平衡移动原理(实质是“叛逆”): 如果改变影响平衡的一个条件(浓度、压强、温度),平衡就向能够减弱这种改变的方向移动
基本知识再现2:
工农业生产中如何运用勒夏特列原理来选择反应条件:
(1)合成氨工业条件选择温度越高越好吗?
(2) SO2接触氧化工业条件选择压强越高越好吗?
1.合成氨工业条件选择
N2+3H2 ? 2NH3 △H<0
特征:
速率:
平衡:
综合:
实际:
所有物质都是气体,正反应体积缩小,放热
高温、高压、浓度、催化剂
低温、高压、及时分离出氨气
适当温度、高压、催化剂、及时分离出氨气
500℃,高压(20-50MPa)、铁触媒、氨气液化
2. SO2接触氧化工业条件选择
2SO2+O2 ? 2SO3 △H<0
特征:
速率:
平衡:
综合:
实际:
所有物质都是气体,正反应体积缩小,放热
高温、高压、催化剂、浓度(O2)
低温、高压、浓度(O2)
适当温度、高压、催化剂、氧气过量
高温,常压、催化剂、氧气过量
研究表明,NO和CO 反应比较难反应(反应速率很慢),请你试用碰撞理论来解释原因?可采取哪些措施加快反应速率?
单位时间单位体积有效碰撞次数增多
反应速率加快
活化分子百分数
增加
单位体积内活化分子数增加
增大反应物浓度
催化剂
升高温度
增大气体压强
深度思考1:
5.下列事实中,是什么因素影响了化学反应速率?
(1)同浓度、同体积的盐酸中放入大小相同的锌片和镁条,产生气体有快有慢;
(2)融化的KClO3放出气体很慢,撒入少量的MnO2后很快有气体产生了;
(3)锌粉与碘混合后,无明显现象,当加入几滴水时,立即有紫红色蒸气产生;
(4)无色的KI晶体与白色的HgCl2粉末混合时,无明显现象,若将其加入水中,立即有红色的HgI2生成;
(5)集气瓶中充满Cl2和H2的混合气体,在瓶外点燃镁条时发生爆炸;
(6)铁片与稀硫酸制取氢气时,滴加少量CuSO4溶液,可加快产生H2的速率。
反应物的性质
催化剂
催化剂
溶剂
光和热
原电池
题组训练
思路1:加快化学反应速率
措施:合适的催化剂、加热、加压、增大反应物浓度、增大接触面积……
研究表明,NO和CO 反应的转化率比较低,请结合勒夏特列原理,采取哪些措施来减少尾气的排放?
深度思考2:
思路2:使反应平衡右移
措施:降温、加压、减小生成物浓度、增大反应物浓度……
思路1:加快化学反应速率
措施:催化剂、加热、加压、增大反应物浓度、增大接触面积……
综合措施:
合适的催化剂,适宜的温度
增大接触面积,移走生成物
密闭容器:2CO(g)+2NO(g) ? N2(g)+2CO2(g) △H<0 ,
适宜的温度
合适的催化剂
用三效催化剂和电子控制发动机系统,可使碳氢化合物和一氧化碳排放减少90%--95%,氮氧化物减少80%--90%,使汽车尾气得到很大的治理与净化。
增大接触面积
催化剂做成网状结构,或者“蜂窝煤” 结构,增大接触面积,加快反应速率。
问题解决
1. 加快反应速率
减小生成物的浓度
将CO2和N2转移出去,可以考虑在尾气排放装置加上一个小型风扇,加速尾气排放,生成物减少,反应正向更彻底。
问题解决
2. 平衡移动
1. 增大排气管,即增大排气管截面的面积,面积越大催化越完全。
2. 将排气管做成螺旋状,增加了长度,延长反应时间,催化反应更完全,减少尾气排放。
3. 延长反应时间
4. 从源头解决:
如控制汽油的辛烷值,使用无铅汽油,控制空燃比,改用乙醇等清洁燃料,使用电动汽车等等。
能力提升
1.解决生活中具体的化学问题思路:
2.速率、平衡理论在化工生产上的应用,
进行化工生产条件选择时:
既要考虑反应速率的问题 ------反应速率要尽可能的快
又要考虑化学平衡的问题 ------平衡要尽可能地向右移动,即反应物的转化率尽可能高,原料利用率尽可能充分。
实验1:氯化钴溶液颜色的变化
观察稀释酸性CoCl2溶液时颜色的变化
操作: 向3mL0.5mol·L-1CoCl2溶液中慢慢滴加约6mL浓盐酸,观察现象
将上述试管中的溶液分成两份,向其中一溶液中加入约3mL蒸馏水,与另一溶液作对比,观察现象
蓝色 粉红色
蓝色加深
增大了Cl-浓度,
平衡向左移动
蓝色转化为粉红色
平衡向右移动
实 验 现 象 现 象 分 析
CoCl2+浓盐酸
加入3mL蒸馏水
(2)观察受热时CoCl2溶液颜色的变化
操作:取一支试管,加入3 mL95%乙醇溶液和少量(2-3小粒)氯化钴晶体,振荡使其溶解,再滴滴加蒸馏水,至溶液恰好呈粉红色,然后用酒精灯加热该试管片刻。观察上述实验过程中溶液颜色的变化
加乙醇溶解后溶液呈蓝色
稀释时,溶液由蓝色→紫色→很快变成粉红色(平衡向左移动);
加热时,又由粉红色→紫色→蓝色(平衡向右移动)
实验2:探究影响乙酸乙酯水解程度的因素
试管1:
4 mL蒸馏水+2滴甲基橙 + 2 mL乙酸乙酯
试管2:
4 mL5 mol·L-1 H2SO4 +2滴甲基橙 + 2 mL乙酸乙酯
试管3:
4 mL10 mol·L-1NaOH溶液+2滴石蕊 + 2 mL乙酸乙酯
振荡后用透明胶带纸对液相界面做好标记。将三只试管同时插入热水浴(65℃-70℃)中,加热6-10分钟(加热过程可振荡)。取出试管观察液相界面情况。
溶液显黄色
现象
1.试管液相无明显变化;
2.试管液相界面略有上升;
3.试管液相界面明显上升,石蕊蓝色褪去。
溶液呈红色
溶液呈蓝色
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
