鲁科版选修3 第3章第2节 共价键与分子的立体构型24张PPT
文档属性
| 名称 | 鲁科版选修3 第3章第2节 共价键与分子的立体构型24张PPT |
|
|
| 格式 | zip | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-15 00:00:00 | ||
图片预览



文档简介
(共24张PPT)
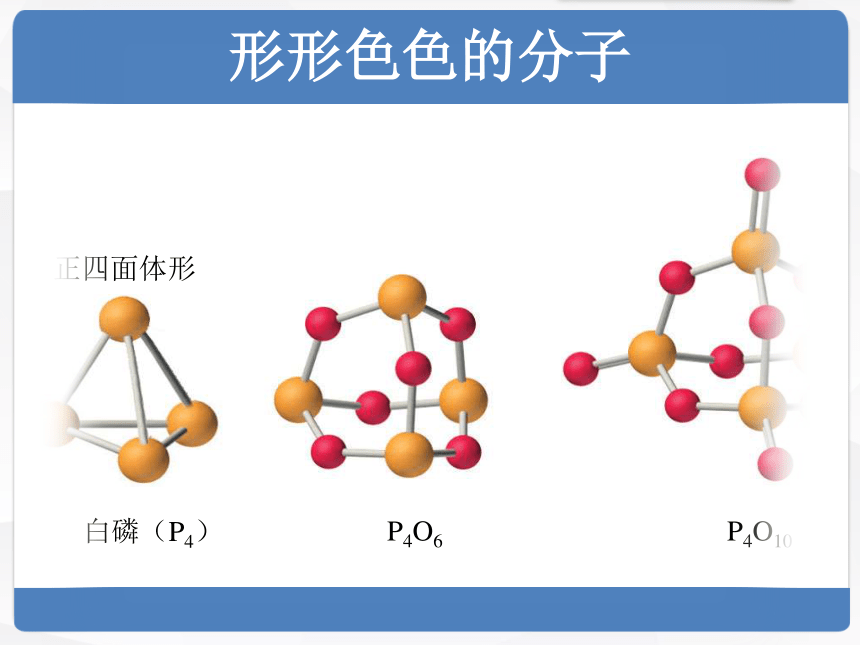
形形色色的分子
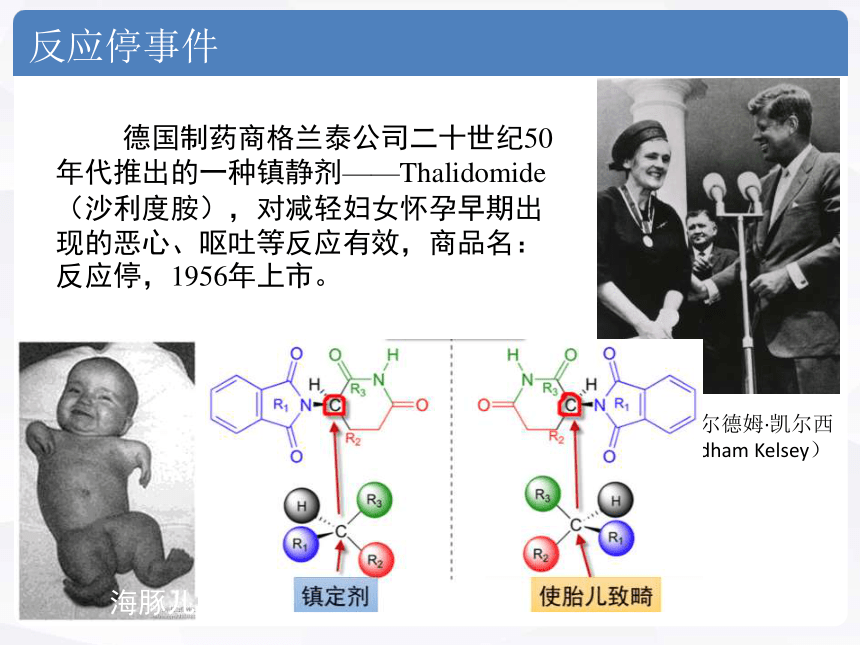
反应停事件
德国制药商格兰泰公司二十世纪50年代推出的一种镇静剂——Thalidomide(沙利度胺),对减轻妇女怀孕早期出现的恶心、呕吐等反应有效,商品名:反应停,1956年上市。
海豚儿
分子的立体构型
(第1课时)
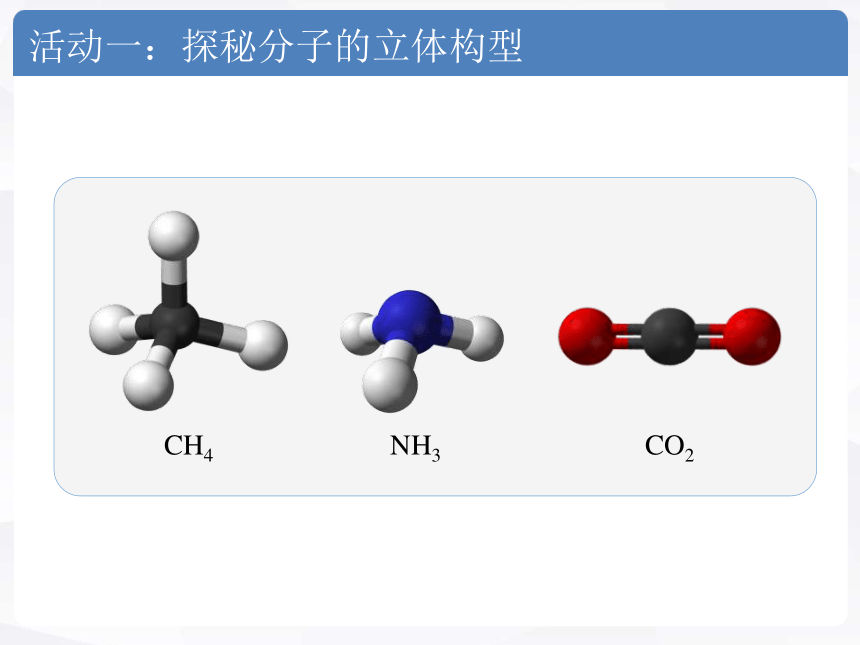
活动一:探秘分子的立体构型
CO2
NH3
CH4
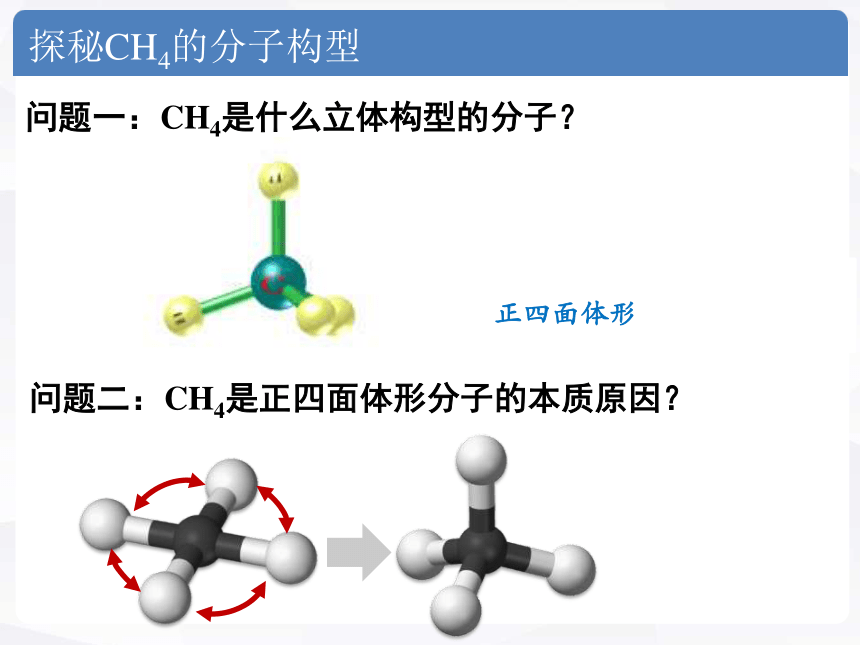
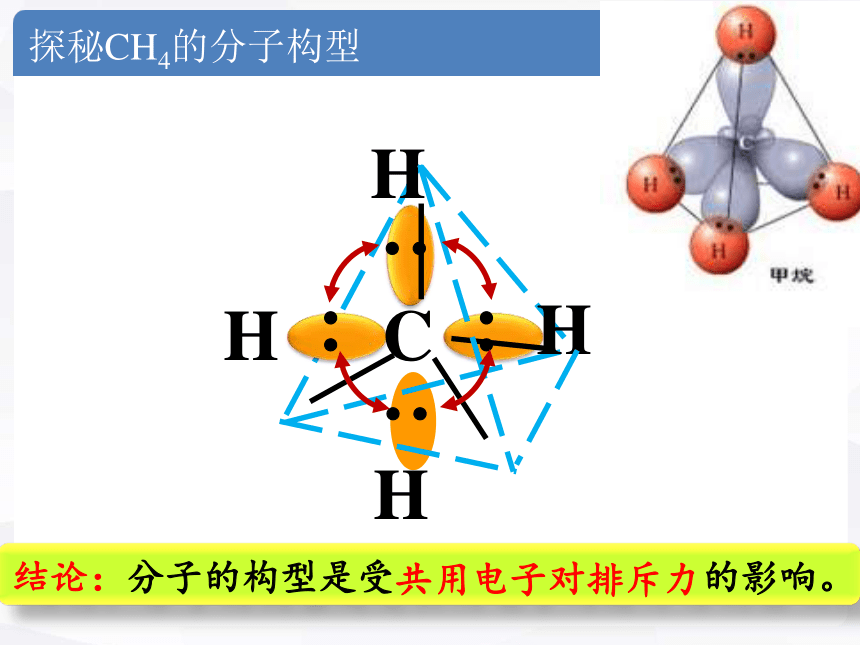
探秘CH4的分子构型
问题一:CH4是什么立体构型的分子?
正四面体形
问题二:CH4是正四面体形分子的本质原因?
探秘CH4的分子构型
C
H
H
H
H
共用电子对排斥力
探秘CH4的分子构型
4对电子相互排斥
3对电子相互排斥
2对电子相互排斥
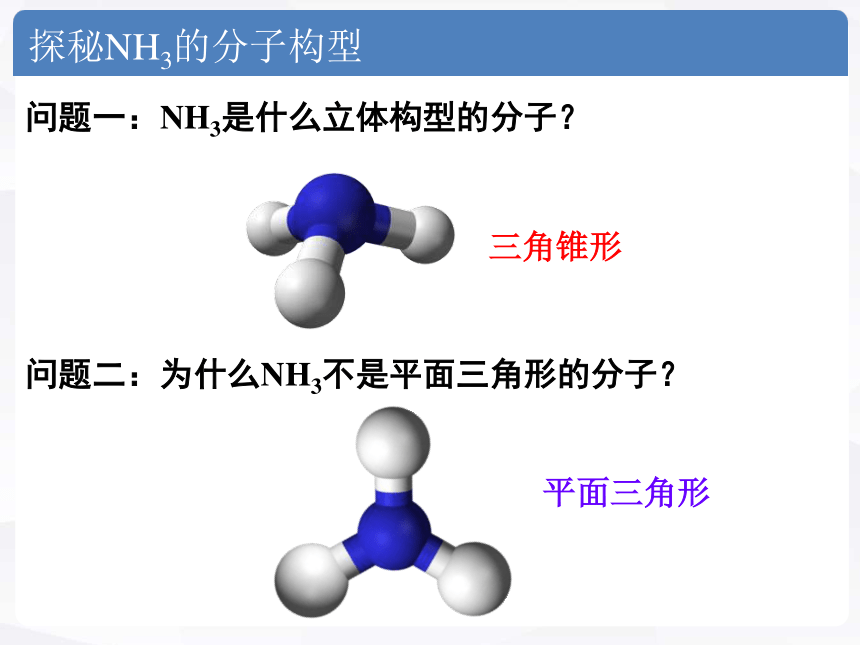
探秘NH3的分子构型
问题一:NH3是什么立体构型的分子?
问题二:为什么NH3不是平面三角形的分子?
平面三角形
三角锥形
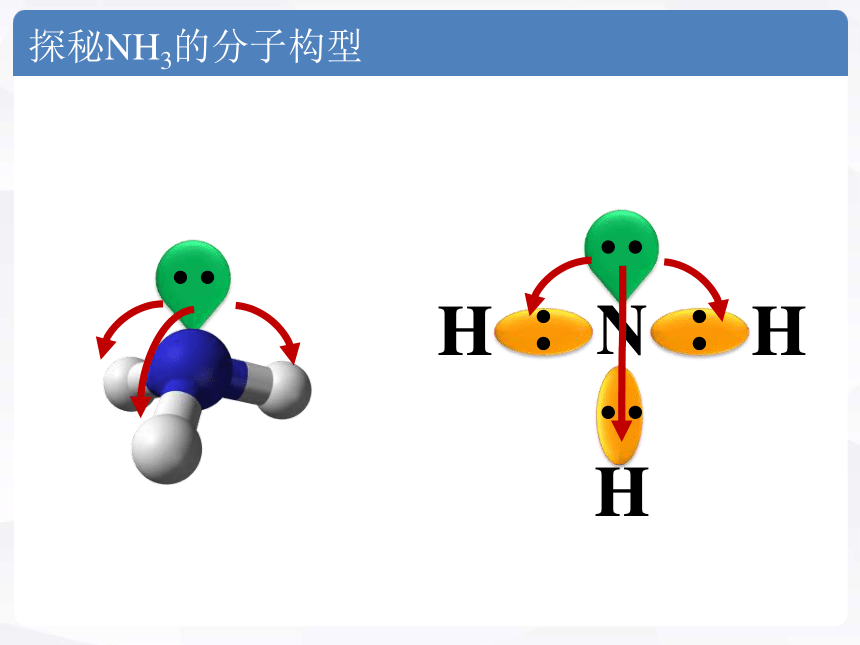
探秘NH3的分子构型
探秘NH3的分子构型
探秘NH3的分子构型
问题三:分子的构型是否受所有电子对排斥力的影响呢?
结论:分子的构型是受共用电子对和中心原子上
孤电子对排斥力的共同影响。
中心原子上
孤电子对排斥力
探秘CO2的分子构型
问题:CO2是什么立体构型的分子?
×
×
√
直线形
π 键“依附于”σ 键存在!
探秘分子的立体构型
CO2
NH3
CH4
活动二
1940年,英国化学家西奇威克正是注意到了我们所研究的这些问题,建立了一种快速判断分子构型的方法。
Nevil Sidgwick?
:理解价层电子对互斥理论
价层电子对互斥理论
,英文为:Valence Shell Electron Pair Repulsion Theory,
V S E P R
简称为:VSEPR Theory。
中心原子的价层电子对
价层电子对
适用对象:“小”分子及简单离子。
活动二:理解价层电子对互斥理论
问题一:如何判断分子(离子)的中心原子?
CH4 、NH3、CO2
PCl3、SO2、BF3、BeCl2、 H2O、NH4+、CO32-
P
C
N
C
S
B
Be
N
C
O
活动二:理解价层电子对互斥理论
问题二:如何判断分子(离子)的中心原子上的孤电子对数?
,对于主族元素,价电子数等于原子的最外层电子数。
a:中心原子价电子数
b:与中心原子结合的原子(配位原子)最多能接受的电子数
,H为1,其他原子等于“8-该原子的价电子数”。
x:与中心原子结合的原子(配位原子)数。
活动二:理解价层电子对互斥理论
0
1
0
0
0
1
0
2
中心原子上的孤电子对数 = (a-xb)
a:中心原子价电子数
b:配位原子最多还能接受的电子数
x:配位原子的数目
中心原子上的孤电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
活动二:理解价层电子对互斥理论
问题3:如何判断分子(离子)的中心原子σ键电子对数?
0
1
0
0
0
1
0
2
4
3
2
2
3
2
4
2
σ键电子对数=配位原子数=X
中心原子上的孤电子对数 σ键电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
活动二:理解价层电子对互斥理论
问题4:如何判断分子(离子)的中心原子价层电子对数?
价层电子对数=中心原子上的孤电子对数+σ键电子对数
0
1
0
0
0
1
0
2
4
3
2
2
3
2
4
2
4
4
2
2
3
3
4
4
中心原子上的孤电子对数 σ电子对数 中心原子价层电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
活动二:理解价层电子对互斥理论
问题5:价层电子对数与VSEPR模型和分子构型的关系?
0
1
0
1
2
0
直线形
平面三角形
四面体形
直线形
平面正三角形
V形
正四面体形
三角锥形
V形
VSEPR模型:中心原子的价层电子对在空间的排布。
中心原子价层电子对数 VSEPR模型 中心原子上的孤电子对数 分子(离子)
构型
2
3
4
中心原子价层电子对数 VSEPR模型
2
3
4
活动二:理解价层电子对互斥理论
0
1
0
0
0
1
0
2
4
3
2
2
3
2
4
2
4
4
2
2
3
3
4
4
问题6:如何判断分子(离子)的构型?
中心原子上的孤电子对数 σ电子对数 中心原子价层电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
小结
互斥
你能总结出VSEPR理论判断构型的操作步骤吗?
减
活动三:感受分子的立体构型
SO2
BF3
CCl4
BeCl2
拓展提升
比较CH4、NH3、H2O的分子构型?
中心原子上的孤电子对数 σ电子对数 中心原子价层电子对数
CH4 0 4 4
NH3 1 3 4
H2O 2 2 4
形形色色的分子
反应停事件
德国制药商格兰泰公司二十世纪50年代推出的一种镇静剂——Thalidomide(沙利度胺),对减轻妇女怀孕早期出现的恶心、呕吐等反应有效,商品名:反应停,1956年上市。
海豚儿
分子的立体构型
(第1课时)
活动一:探秘分子的立体构型
CO2
NH3
CH4
探秘CH4的分子构型
问题一:CH4是什么立体构型的分子?
正四面体形
问题二:CH4是正四面体形分子的本质原因?
探秘CH4的分子构型
C
H
H
H
H
共用电子对排斥力
探秘CH4的分子构型
4对电子相互排斥
3对电子相互排斥
2对电子相互排斥
探秘NH3的分子构型
问题一:NH3是什么立体构型的分子?
问题二:为什么NH3不是平面三角形的分子?
平面三角形
三角锥形
探秘NH3的分子构型
探秘NH3的分子构型
探秘NH3的分子构型
问题三:分子的构型是否受所有电子对排斥力的影响呢?
结论:分子的构型是受共用电子对和中心原子上
孤电子对排斥力的共同影响。
中心原子上
孤电子对排斥力
探秘CO2的分子构型
问题:CO2是什么立体构型的分子?
×
×
√
直线形
π 键“依附于”σ 键存在!
探秘分子的立体构型
CO2
NH3
CH4
活动二
1940年,英国化学家西奇威克正是注意到了我们所研究的这些问题,建立了一种快速判断分子构型的方法。
Nevil Sidgwick?
:理解价层电子对互斥理论
价层电子对互斥理论
,英文为:Valence Shell Electron Pair Repulsion Theory,
V S E P R
简称为:VSEPR Theory。
中心原子的价层电子对
价层电子对
适用对象:“小”分子及简单离子。
活动二:理解价层电子对互斥理论
问题一:如何判断分子(离子)的中心原子?
CH4 、NH3、CO2
PCl3、SO2、BF3、BeCl2、 H2O、NH4+、CO32-
P
C
N
C
S
B
Be
N
C
O
活动二:理解价层电子对互斥理论
问题二:如何判断分子(离子)的中心原子上的孤电子对数?
,对于主族元素,价电子数等于原子的最外层电子数。
a:中心原子价电子数
b:与中心原子结合的原子(配位原子)最多能接受的电子数
,H为1,其他原子等于“8-该原子的价电子数”。
x:与中心原子结合的原子(配位原子)数。
活动二:理解价层电子对互斥理论
0
1
0
0
0
1
0
2
中心原子上的孤电子对数 = (a-xb)
a:中心原子价电子数
b:配位原子最多还能接受的电子数
x:配位原子的数目
中心原子上的孤电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
活动二:理解价层电子对互斥理论
问题3:如何判断分子(离子)的中心原子σ键电子对数?
0
1
0
0
0
1
0
2
4
3
2
2
3
2
4
2
σ键电子对数=配位原子数=X
中心原子上的孤电子对数 σ键电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
活动二:理解价层电子对互斥理论
问题4:如何判断分子(离子)的中心原子价层电子对数?
价层电子对数=中心原子上的孤电子对数+σ键电子对数
0
1
0
0
0
1
0
2
4
3
2
2
3
2
4
2
4
4
2
2
3
3
4
4
中心原子上的孤电子对数 σ电子对数 中心原子价层电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
活动二:理解价层电子对互斥理论
问题5:价层电子对数与VSEPR模型和分子构型的关系?
0
1
0
1
2
0
直线形
平面三角形
四面体形
直线形
平面正三角形
V形
正四面体形
三角锥形
V形
VSEPR模型:中心原子的价层电子对在空间的排布。
中心原子价层电子对数 VSEPR模型 中心原子上的孤电子对数 分子(离子)
构型
2
3
4
中心原子价层电子对数 VSEPR模型
2
3
4
活动二:理解价层电子对互斥理论
0
1
0
0
0
1
0
2
4
3
2
2
3
2
4
2
4
4
2
2
3
3
4
4
问题6:如何判断分子(离子)的构型?
中心原子上的孤电子对数 σ电子对数 中心原子价层电子对数
CH4
NH3
H2O
SO2
BF3
BeCl2
CO2
NH4+
小结
互斥
你能总结出VSEPR理论判断构型的操作步骤吗?
减
活动三:感受分子的立体构型
SO2
BF3
CCl4
BeCl2
拓展提升
比较CH4、NH3、H2O的分子构型?
中心原子上的孤电子对数 σ电子对数 中心原子价层电子对数
CH4 0 4 4
NH3 1 3 4
H2O 2 2 4
