鲁科版选修3 第2章 第2节 共价键与分子的立体构型35张PPT
文档属性
| 名称 | 鲁科版选修3 第2章 第2节 共价键与分子的立体构型35张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-15 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
第2章 共价键与分子作用力
第2节 共价键与分子的空间构型
鲁科版选修三《物质结构与性质》
威海“幸福门”
感受自然之“对称美”
在宇宙的秩序
和和谐面前,
人类不能不在内
心里发出由衷的
感叹,激起无限
的好奇。
第2章 共价键与分子作用力
第2节 共价键与分子的空间构型
学习目标:
1、通过对不同分子的空间构型有不同的结构事实,
认识杂化轨道理论,并理解杂化轨道理论的四个要点。
2.通过甲烷分子、BeCl2、BF3形成过程的学习,知道杂化
轨道的类型及形成过程,并能建立杂化模型,初步认识其
分子的空间构型。培养模型认知的科学素养。
3.能够用杂化原理解释乙烯、乙炔的形成过程,建立观点、
结论和证据之间的逻辑关系。
共价键具有饱和性和方向性
所以原子间以共价键形成的
分子具有一定的空间构型
复习回顾:
原子间通过 共用电子 形成的化学键叫共价键
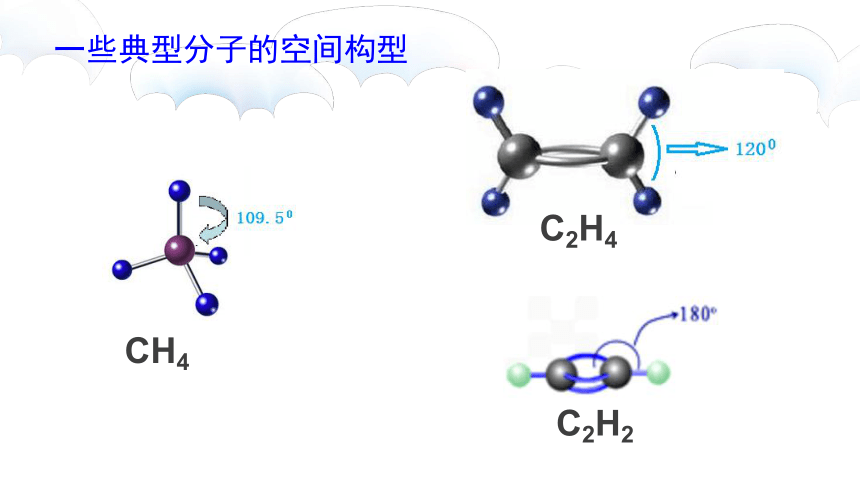
一些典型分子的空间构型
CH4
C2H4
C2H2
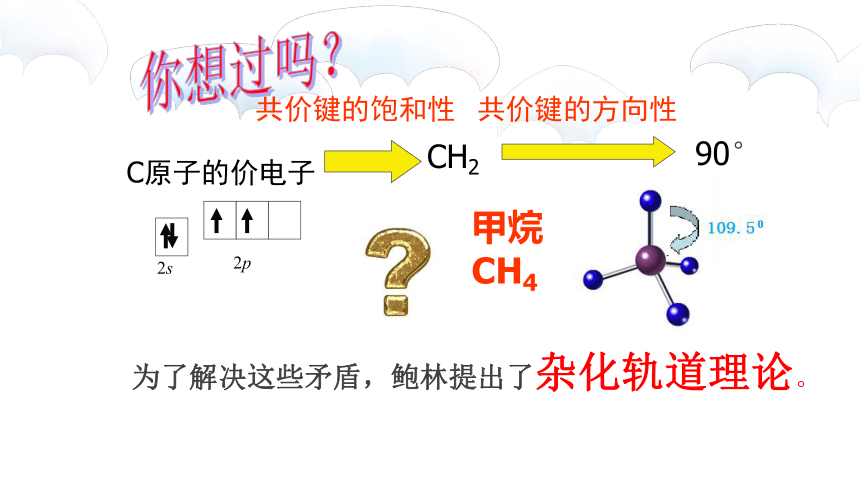
2s
2p
C原子的价电子
共价键的饱和性
CH2
为了解决这些矛盾,鲍林提出了杂化轨道理论。
甲烷CH4
你想过吗?
共价键的方向性
90°
鲍林——美国著名化学家,1954年因在化学键方面的工作获得诺贝尔化学奖,1962年因反对核弹在地面测试的行动获得诺贝尔和平奖。
鲍林在探索化学键理论时,遇到了甲烷的正四面体结构的解释问题。为了解释甲烷的正四面体结构,说明碳原子四个键的等价性,鲍林在1928一1931年,提出了杂化轨道的理论。
莱纳斯·卡尔·鲍林
学习目标一 杂化轨道理论
在外界条件影响下,原子内部能量相近的原子轨道重新组合的过程就叫做原子轨道的杂化。
组合后形成的一组新的、能量相同的原子轨道,叫做杂化原子轨道,简称杂化轨道。
杂化轨道理论要点:
1.同一原子中能量相近的原子轨道可以重
新组合,形成新的杂化轨道。
2.杂化前后轨道数目不变,新形成的几个
杂化轨道能量相同。
3.杂化轨道的形状发生了变化,
更有利于有效地重叠,成键
能力更强。
4.杂化轨道的伸展方向发生变
化,杂化轨道在空间力求最
大夹角(排斥力最小)。
轨道形状
发生变化!
轨道空间伸展方向发生变化!
轨道数目不变!
轨道能量发生变化!
不变?
改变?
目标一检测
下列有关杂化轨道的说法不正确的是( )
A.原子中能量相近的某些轨道,在成键时,能
重新组合成能量相等的新轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠
原理、能量最低原则
D.CH4分子中两个sp3杂化轨道的夹角为109.5°
B
2s
2p
激发
基态
2s
2p
激发态
sp3杂化轨道
杂化类型
CH4
sp3杂化
21:11
14
学习目标二 杂化类型及分子的空间构型
描述甲烷中共价键的形成过程:
4 + →
H C CH4
1s
sp3
σ
σ
σ
σ
总结
sp3杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
21:11
16
试试看?
气态BeCl2分子是直线形,Cl原子位于Be原子的两侧, BeCl2分子中键角为180o 。杂化轨道理论如何解释?
21:11
17
2s
2p
激发
基态
2s
2p
激发态
sp杂化
sp杂化轨道
杂化类型
BeCl2
sp(或sp1)杂化
未杂化
轨道
21:11
18
Cl
Cl
sp杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
21:11
19
BF3分子是平面正三角形, F原子位于正三角形的三个顶点,B原子位于分子中心,分子中键角均为120o,杂化轨道理论如何解释?
动动脑?
B
F
F
F
21:11
20
激发
基态
激发态
sp2杂化
sp2杂化轨道
杂化类型
BF3
2s
2p
2s
2p
sp2杂化
未杂化轨道
21:11
21
σ
σ
σ
F原子的2p轨道
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
21:11
22
杂化类型 sp sp2 sp3
参加杂化的轨道
杂化轨道数目
杂化轨道空间构型
成键轨道夹角
实例
中心原子
s+(1)p
s+(2)p
s+(3)p
直线形
正四面体形
2
3
4
平面三角形
180 °
120 °
109.5°
Be(ⅡA)
B(ⅢA)
C (ⅣA)
CH4
BeCl2
BF3
知识归纳
21:11
23
动动手
用桌上准备的糖果做三种杂化类型的杂化轨道模型
注意:1、QQ糖代表中心原子原子核
2、玉米糖代表杂化轨道(“大头” 在外)
3、注意小组分工合作
C2H4是平面形分子,分子中键角为120o 。试用杂化轨道理论加以说明。
我来挑战
1.碳原子的价电子排布应如何改变?
2.形成什么类型的杂化轨道?
21:11
25
3.乙烯分子中碳原子的成键方式及化学键类型?
2s
2p
激发
基态
2s
2p
激发态
sp2杂化轨道
C原子
sp2杂化
21:11
26
未杂化2p轨道
分析
乙烯分子中各个键的形成过程及键的类型
σ
σ
σ
σ
σ
π
乙烯: 个σ键 个π键
5
1
总结
C2H2是直线形分子,分子中键角为180o 。试用杂化轨道理论加以说明。
我来挑战
1. 碳原子的价电子排布应如何改变?
2.形成什么类型的杂化轨道?
3.乙炔分子中碳原子的成键方式及化学键类型?
21:11
28
2s
2p
激发
基态
2s
2p
激发态
sp杂化轨道
C原子
21:11
29
未杂化2p轨道
分析
sp杂化
σ
σ
σ
π
π
乙炔分子中各个键的形成过程及键的类型
总结
乙炔: 个σ键 个π键
3
2
目标二检测
1.下列能正确表示CH4分子中碳原子成键轨道的示意图为( )
D
2. 在乙烯(CH2=CH2)分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的
2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的
2p轨道形成的π键
A
3、 下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③ 苯 ④CH≡CH ⑤BeCl2 ⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
A
苯分子是平面正六边形,键角是120°,试用杂化轨道理论进行解释?
课后思考
谢谢大家
第2章 共价键与分子作用力
第2节 共价键与分子的空间构型
鲁科版选修三《物质结构与性质》
威海“幸福门”
感受自然之“对称美”
在宇宙的秩序
和和谐面前,
人类不能不在内
心里发出由衷的
感叹,激起无限
的好奇。
第2章 共价键与分子作用力
第2节 共价键与分子的空间构型
学习目标:
1、通过对不同分子的空间构型有不同的结构事实,
认识杂化轨道理论,并理解杂化轨道理论的四个要点。
2.通过甲烷分子、BeCl2、BF3形成过程的学习,知道杂化
轨道的类型及形成过程,并能建立杂化模型,初步认识其
分子的空间构型。培养模型认知的科学素养。
3.能够用杂化原理解释乙烯、乙炔的形成过程,建立观点、
结论和证据之间的逻辑关系。
共价键具有饱和性和方向性
所以原子间以共价键形成的
分子具有一定的空间构型
复习回顾:
原子间通过 共用电子 形成的化学键叫共价键
一些典型分子的空间构型
CH4
C2H4
C2H2
2s
2p
C原子的价电子
共价键的饱和性
CH2
为了解决这些矛盾,鲍林提出了杂化轨道理论。
甲烷CH4
你想过吗?
共价键的方向性
90°
鲍林——美国著名化学家,1954年因在化学键方面的工作获得诺贝尔化学奖,1962年因反对核弹在地面测试的行动获得诺贝尔和平奖。
鲍林在探索化学键理论时,遇到了甲烷的正四面体结构的解释问题。为了解释甲烷的正四面体结构,说明碳原子四个键的等价性,鲍林在1928一1931年,提出了杂化轨道的理论。
莱纳斯·卡尔·鲍林
学习目标一 杂化轨道理论
在外界条件影响下,原子内部能量相近的原子轨道重新组合的过程就叫做原子轨道的杂化。
组合后形成的一组新的、能量相同的原子轨道,叫做杂化原子轨道,简称杂化轨道。
杂化轨道理论要点:
1.同一原子中能量相近的原子轨道可以重
新组合,形成新的杂化轨道。
2.杂化前后轨道数目不变,新形成的几个
杂化轨道能量相同。
3.杂化轨道的形状发生了变化,
更有利于有效地重叠,成键
能力更强。
4.杂化轨道的伸展方向发生变
化,杂化轨道在空间力求最
大夹角(排斥力最小)。
轨道形状
发生变化!
轨道空间伸展方向发生变化!
轨道数目不变!
轨道能量发生变化!
不变?
改变?
目标一检测
下列有关杂化轨道的说法不正确的是( )
A.原子中能量相近的某些轨道,在成键时,能
重新组合成能量相等的新轨道
B.轨道数目杂化前后可以相等,也可以不等
C.杂化轨道成键时,要满足原子轨道最大重叠
原理、能量最低原则
D.CH4分子中两个sp3杂化轨道的夹角为109.5°
B
2s
2p
激发
基态
2s
2p
激发态
sp3杂化轨道
杂化类型
CH4
sp3杂化
21:11
14
学习目标二 杂化类型及分子的空间构型
描述甲烷中共价键的形成过程:
4 + →
H C CH4
1s
sp3
σ
σ
σ
σ
总结
sp3杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
109°28′
21:11
16
试试看?
气态BeCl2分子是直线形,Cl原子位于Be原子的两侧, BeCl2分子中键角为180o 。杂化轨道理论如何解释?
21:11
17
2s
2p
激发
基态
2s
2p
激发态
sp杂化
sp杂化轨道
杂化类型
BeCl2
sp(或sp1)杂化
未杂化
轨道
21:11
18
Cl
Cl
sp杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
180°
21:11
19
BF3分子是平面正三角形, F原子位于正三角形的三个顶点,B原子位于分子中心,分子中键角均为120o,杂化轨道理论如何解释?
动动脑?
B
F
F
F
21:11
20
激发
基态
激发态
sp2杂化
sp2杂化轨道
杂化类型
BF3
2s
2p
2s
2p
sp2杂化
未杂化轨道
21:11
21
σ
σ
σ
F原子的2p轨道
sp2杂化轨道的形成过程
x
y
z
x
y
z
z
x
y
z
x
y
z
120°
21:11
22
杂化类型 sp sp2 sp3
参加杂化的轨道
杂化轨道数目
杂化轨道空间构型
成键轨道夹角
实例
中心原子
s+(1)p
s+(2)p
s+(3)p
直线形
正四面体形
2
3
4
平面三角形
180 °
120 °
109.5°
Be(ⅡA)
B(ⅢA)
C (ⅣA)
CH4
BeCl2
BF3
知识归纳
21:11
23
动动手
用桌上准备的糖果做三种杂化类型的杂化轨道模型
注意:1、QQ糖代表中心原子原子核
2、玉米糖代表杂化轨道(“大头” 在外)
3、注意小组分工合作
C2H4是平面形分子,分子中键角为120o 。试用杂化轨道理论加以说明。
我来挑战
1.碳原子的价电子排布应如何改变?
2.形成什么类型的杂化轨道?
21:11
25
3.乙烯分子中碳原子的成键方式及化学键类型?
2s
2p
激发
基态
2s
2p
激发态
sp2杂化轨道
C原子
sp2杂化
21:11
26
未杂化2p轨道
分析
乙烯分子中各个键的形成过程及键的类型
σ
σ
σ
σ
σ
π
乙烯: 个σ键 个π键
5
1
总结
C2H2是直线形分子,分子中键角为180o 。试用杂化轨道理论加以说明。
我来挑战
1. 碳原子的价电子排布应如何改变?
2.形成什么类型的杂化轨道?
3.乙炔分子中碳原子的成键方式及化学键类型?
21:11
28
2s
2p
激发
基态
2s
2p
激发态
sp杂化轨道
C原子
21:11
29
未杂化2p轨道
分析
sp杂化
σ
σ
σ
π
π
乙炔分子中各个键的形成过程及键的类型
总结
乙炔: 个σ键 个π键
3
2
目标二检测
1.下列能正确表示CH4分子中碳原子成键轨道的示意图为( )
D
2. 在乙烯(CH2=CH2)分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的
2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的
2p轨道形成的π键
A
3、 下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③ 苯 ④CH≡CH ⑤BeCl2 ⑥CH4
A.①②③ B.①⑤⑥ C.②③④ D.③⑤⑥
A
苯分子是平面正六边形,键角是120°,试用杂化轨道理论进行解释?
课后思考
谢谢大家
