鲁科版 选修6 主题1 课题2 活动1 实验2-3 从海带中提取碘35张PPT
文档属性
| 名称 | 鲁科版 选修6 主题1 课题2 活动1 实验2-3 从海带中提取碘35张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-15 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
化学6《实验化学》(山东科学技术出版社)
第二单元课题一
实验2-3 从海带中提取碘
【学习目标】
一、知识与技能
1.了解从海带中提取碘的实验原理。
2. 学习从植物中分离提纯无机物的一般方法。
3. 学习萃取的有关原理,并掌握其操作,复习掌握过滤的原理及操作。
二、过程与方法
1. 通过实验了解一般的分离提纯方法在“从海带中提取碘”实验中的应用体验。
2. 通过将I-氧化为I2再进行萃取分离的过程,体会转化的方法在物质分离中的应用。
三、情感、态度与价值观
1. 体会从植物中提取某些成分的重要价值,增强将化学知识应用于生产、生活实践的意识,加强STS教育,培养学生“科学态度与社会责任”的学科素养。
2. 通过具体物质从自然界中分离提纯的实验,培养学生“科学探究与创新意识”的学科素养。
3.通过学习从植物中分离提纯无机物的一般方法,建立起从实验学习化学的方法认知模型。
教学环节
技术教育内容
科学史实:屠呦呦从青蒿中提取青
蒿素,获得诺贝尔生理或医学奖
海带制碘教学思路
学习从植物中提取有利成分的
一般路线
实验设计:如何从海带中提取碘?
设计实验:动手绘制流程图
实践活动:开展从海带中制取得到
碘的实验活动。
社会现实:认识我国海带制碘工业
的发展。
了解我国海带制碘技术的发展
开展具体的实践操作活动
【学生预习】课外阅读材料1、材料2。
通过屠呦呦的科技发现,形成从植物中提取某些成分的技术路线。
[视频引入]
屠呦呦获诺贝尔奖
【教学环节1 】活动背景
[颁奖视频]
屠呦呦从青蒿中提取得到青蒿素给我们的启示呢?
小组交流分享:屠呦呦从青蒿中发现青蒿素的实验历程。
(在班级微信群中,提前给学生发送课外阅读资料 )
【学生活动1-1】
1.屠呦呦团队发现青蒿素过程很艰辛!
2.青蒿素的发现是中国传统医药奉献给人类的一份礼物。
3.学习研究团队对国家使命的责任与担当,团结与协作,奋斗与奉献精神。
【交流分享1-1 】
[课外阅读材料1]
[课外阅读材料2]
【问题1-1】
从植物中提取某些成分的一般方法是什么?
阅读资料3,思考并结合小组交流讨论,初步形成从植物中提取某些成分的技术路线。
【学生活动1-2】
【交流分享1-2】
[课外阅读材料3]
青蒿素
→
在青蒿植物中
→
石油醚浸泡
→
分离提纯产品
从植物中提取某些成分的技术路线:
目标产品
→
确定原料
→
确定反应原理
→
设计反应路径
→
分离提纯产品
(有机物)
(存在)
(有机溶剂提取)
(理论指导实践)
【总结1】
【问题1-2】
如何从海带中提取碘?(具体例子)
为什么要提取碘?你了解碘的用途有哪些?
【教学环节2 】
实验设计
海带中碘元素的存在形式是什么?如何将待提取物转化为易于提取物?
【阅读】
课本第9页“资料在线”
【展示】
海带图片及碘的广泛用途
【问题2-1】
【问题2-2】
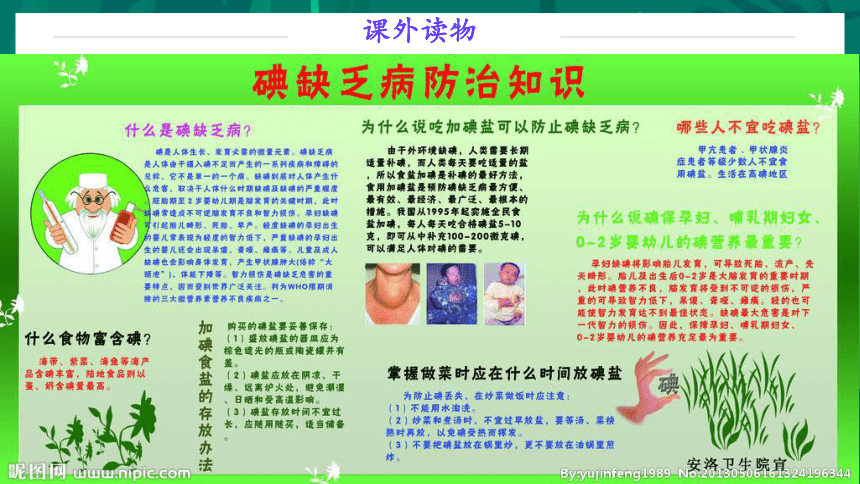
碘是人体生长发育不可缺少的微量元素之一。人若摄入碘量不足,会引起甲状腺肿大病;儿童缺碘,则严重影响其智力发展,导致智商低下,因此,人们将碘称为智慧元素。
经常吃些海带、紫菜等海藻类植物,可以防治甲状腺肿大,这是由于海带中富含碘。
[看图说话] 碘缺乏的危害?
碘的用处
工业原料,半导体材料的研制
参与人体甲状腺素合成
调节新陈代谢
生长发育不可缺少的微量元素
影响智力
课外读物
主要成分
蛋白质、糖类、脂肪、粗纤维、褐藻胶、甘露醇、维生素、有机碘化物等有机物。
氯化钠、碳酸钠、硫酸钠、碘化钠等无机盐。
次要成分
海带的成分
资料
设计从海带中提取碘的实验方案
根据有关研究结果表明:海带中99.2%的碘为水溶性碘。浸出液中碘主要以I-的形式存在,占浸出总碘量的88.3%;其次为有机碘,占10.3%;IO-3的含量最少,仅占1.4%。经灼烧后,灰烬中的碘可以转化为能溶于水的无机碘化物( I- )。
小组根据思考问题及教师所提供的知识,展开讨论交流,明确从海带中提取碘的原理知识,并进一步得出从海带中提取碘的实验技术流程图。
【小组活动2-1 】
资料
1.将有机物转化为无机物常用的方法?如何将海带中有机碘转化为无机碘(I-)?
2.如何将海带灰(固体)中的无机碘转化为水溶液中无机碘?联系日常生活中煮中草药的例子。
3.如何将无机碘(I-)转化为碘单质(I2)?根据氧化还原反应原理,可加入什么试剂?教材上使用饱和氯水是否科学合理?可用什么氧化剂代替饱和氯水更好?
【思考问题】
4.如何检验海带中有碘元素的存在或如何检验从海带中经过转变得到碘单质?
5.将海带中的碘元素转化为水溶液中的碘单质(I2)后,如何将水溶液中的碘单质(I2)富集起来?
6.如何从碘的四氯化碳溶液中得到晶体碘呢?参考资料,使用蒸馏的方法可以吗?是否还有更好的方法?(阅读课本第12页“进一步探索”)
——将有机物转化为无机物常用加热分解的方法,若要将海带中有机碘转化为无机碘,可将海带灼烧。
1.将有机物转化为无机物常用的方法?如何将海带中有机碘转化为无机碘(I-)?
2.如何将海带灰(固体)中的无机碘转化为水溶液中无机碘?联系日常生活中煮中草药的例子。
3.如何将无机碘(I-)转化为碘单质(I2)?根据氧化还原反应原理,可加入什么试剂?教材上使用饱和氯水是否科学合理?可用什么氧化剂代替饱和氯水更好?
——将海带灰放入烧杯中,加入蒸馏水,加热煮沸,冷却后过滤。
——将I-转化为I2发生氧化反应,因此需要加入氧化剂,饱和氯水过量时,会使碘单质继续氧化生成HIO3,可用双氧水代替饱和氯水,且双氧水通常称为“绿色氧化剂”。
【思考问题】
——取适量经过氧化后的溶液放入试管中,再加入淀粉溶液,振荡,溶液变蓝。或加入四氯化碳,振荡后静置,观察水层和四氯化碳(紫红色)的颜色。
4.如何检验海带中有碘元素的存在或如何检验从海带中经过转变得到碘单质?
5.将海带中的碘元素转化为水溶液中的碘单质(I2)后,如何将水溶液中的碘单质(I2)富集起来?
6.如何从碘的四氯化碳溶液中得到晶体碘呢?参考资料,使用蒸馏的方法可以吗?是否还有更好的方法?(阅读课本第12页“进一步探索”)
——根据萃取的原理,碘单质在四氯化碳中溶解能力强,而在水中的溶解能力弱,可加入四氯化碳来萃取碘、通过分液富集碘单质。
——查数据可知,四氯化碳的沸点为77。C,碘在184.4。C升华,两者相差107.4。C,这样大的温差,在理论上用蒸馏的方法应该可行的。但实验表明不能用蒸馏方法充分分离四氯化碳层中的I2,因受热时,在四氯化碳挥发的同时也有部分I2升华。工业生产实际也不是使用蒸馏的方法,而是用“反萃法”。
1.实验原理
海带中含有丰富的碘元素,其主要的存在形态为化合态。经灼烧后,灰烬中的碘可以转化为能溶于水的无机碘化物。碘离子(I-)具有较强的还原性,可被氧化剂氧化生成碘单质(I2)。生成的碘单质(I2)可用四氯化碳(CCl4)把它从水溶液中萃取出来。
2I- + 2H+ + H2O2 = I2 + 2H2O
氧化还原反应原理:
2I- + Cl2 = I2 + 2Cl-
【交流分享2-1 】
2.萃取的原理
利用物质在互不相溶(或微溶)的溶剂中溶解能力不同进行分离或提纯的方法。例如,四氯化碳与水互不相溶,而碘单质在四氯化碳中的溶解能力比在水中的溶解能力强,如果将四氯化碳与含有碘单质的水溶液混合振荡,碘单质就会从水中富集到四氯化碳中。
萃取剂的条件:萃取剂与溶剂互不相溶(或微溶);溶质在萃取剂中溶解能力强。
主要仪器:分液漏斗
干海带
灰 烬
浊 液
滤 液
混合液
上 层
下 层
碘单质
灼烧
滤 渣
水浸
过滤
酸化
CCl4
萃取
分液
反萃法
氧化
淀粉溶液
完善从海带中提取碘流程图,从海带中提取碘的实验方案。
小结
【小组活动2-2】小组汇报、展示实验设计方案。
从海带中提取碘实验操作。
利用小组事先准备好的海带灰,按照设计的流程图,分别进行溶解、过滤、氧化、萃取、分液、反萃法等一系列实验操作活动。
【教学环节3】
实践活动
【小组活动3-1 】
实验步骤及注意事项
(1)称取样品(预先准备)
①操作要点:用托盘天平称取5.0g干燥的海带,放入坩埚中。
②实验注意事项:托盘天平的正确使用。
(2)灼烧灰化(预先准备)
在通风处加热灼烧干海带,待海带完全灰化后,冷却,再将灰烬转移到小烧杯中。
②实验现象:
灼烧灰化的过程大约需要5-6分钟,干海带逐渐变的更干燥、卷曲,最后变成黑色粉末或细小颗粒。期间还会产生大量白烟,并伴有焦糊味。
①操作要点:
应在通风处加热灼烧,或使用通风设备去除白烟和难闻的气味。
应边加热边搅拌,用坩埚钳夹持坩埚,玻璃棒小心搅拌,使海带均匀受热,加快灰化的速度。
灼烧完毕,应将坩埚和玻璃棒放在石棉网上冷却,不可直接放在冷的实验台上,防止温度很高的坩埚骤冷而破裂。
③实验注意事项:
(3)溶解过滤
②实验现象:
煮沸时固体未见明显溶解,过滤后得到淡黄色的清亮溶液。
①操作要点:
向小烧杯中加入20mL蒸馏水,搅拌,煮沸2-3min,使可溶物溶解。过滤,收集滤液,弃去滤渣。
应隔着石棉网加热小烧杯中的混合物。
加热过程中应不断搅拌,加快溶解,同时防止液体受热不均而溅出。
过滤操作应注意“一贴、二低、三靠” 。
③实验注意事项:
(4)氧化及检验
①操作要点
②实验现象
③实验注意事项
在滤液中加入10滴2mol·L-1H2SO4溶液,再加入2mL、6%的H2O2溶液。取出少许混合液,用淀粉溶液检验碘单质。
加入氧化剂后溶液颜色变深,呈棕黄色。加淀粉,溶液变蓝色。
控制试剂的用量。
检验碘元素应取少量样品,不要向所有滤液中直接加淀粉溶液,否则后续实验将无法操作。
①操作要点:
将氧化检验后的余液转入分液漏斗中,加入2mLCCl4,充分振荡,将上口塞子打开,静置,待完全分层后,分液。
②实验现象:
加入CCl4振荡后,液体分层,且下层液体显紫红色,上层液体几乎无色。
(5)萃取分液(富集)
[萃取分液视频]
a.将几个小组同学得到碘的四氯化碳溶液合并于分液漏斗中,向其中逐滴加入40%的NaOH溶液,边滴边振荡,直到四氯化碳层不显红色为止。
b.分液,将水层转入烧杯中,向得到的水溶液中滴加45%的硫酸酸化,可重新生成碘单质。由于碘单质在水中的溶解度很小,可沉淀析出,分离后即可获取固态碘单质。
①操作要点
a.四氯化碳层红色褪去。
b.有沉淀析出。
②实验现象
反萃法
(6)反萃法(提纯)
1.灼烧的作用是什么?
2. 水浸时常常要将悬浊液煮沸
2~3min,目的是什么?
3.使用双氧水作氧化剂时,为
什么要进行酸化?
合作解疑
4.碘元素在整个实验过程中是如
何转化的?
1.灼烧的作用是什么?
2~3min,目的是什么?
加快碘化物在水中的溶解,以使灰烬中的I-尽可能多的进入溶液。
因海带灰的浸出液中含有碳酸钠(或碳酸钾)等使溶液显碱性的物质,酸化的目的是使溶液呈弱酸性,有利于氧化剂把I-氧化为I2。
海带中的碘元素是以化合态碘(无机碘和有机碘)存在,通过灼烧、浸泡加热、氧化后,转化为游离态碘(碘单质)。
将干海带高温灼烧,使有机物转化为CO2和H2O,呈气态逸散,同时将有机碘转化为无机碘( I- )。
2. 水浸时常常要将悬浊液煮沸
3.使用双氧水作氧化剂时,为
什么要进行酸化?
合作解疑
4.碘元素在整个实验过程中是如
何转化的?
【教学环节4】 社会现实 (课外作业延伸)
认识我国海带制碘工业的发展
【上网查询】
我国海带碘工业的发展历史。
【问题4-1 】
我国海带制碘工业如何从无到有,从中可以获得哪些启示?
【问题4-2 】
工业生产与实验设计流程之间的区别及原因。
【问题4-3 】
通过思考,深入分析工业生产技术与实验室制取物质的区别与联系。
中国海带之父——曾呈奎
世界著名的海洋生物学家、我国海藻学研究的奠基人。他的一系列原创性研究,使我国海带养殖从零一跃成为世界第一 。
先后发明人工海带夏苗低温培育、海带施肥增产、海带南移养殖等技术,使冷温带的海带在我国北方温带海域、南方暖温带和亚热带海域都能进行大规模人工养殖。
“海洋科技要走自主创新之路”
“我要给人们饭桌上添几道菜”
“我的海洋事业在中国”
【练习】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
海
藻
①灼烧
海
藻
灰
海藻灰
悬浊液
含碘离
子溶液
含碘
水溶液
含碘
苯溶液
②浸泡
③
④MnO2+ 稀H2SO4
⑤提取碘
⑥
单质碘
运用扩展
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 ( )
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
BDE
过滤
反萃法
2I-+MnO2+4H+=Mn2++I2+2H2O
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法: 。
苯与水互不相溶;碘在苯中的溶解度比在水中大
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色。如果变蓝,说明还有单质碘;反之,说明没有单质碘。
你有哪些收获?
【教学环节5】总结
1.了解从植物中提取无机物的一般方法;
2.学习萃取的原理和操作;
3.利用氧化还原反应将待提取物转化为易提取的物质,体会转化的方法在物质分离中的应用。
谢谢!
化学6《实验化学》(山东科学技术出版社)
第二单元课题一
实验2-3 从海带中提取碘
【学习目标】
一、知识与技能
1.了解从海带中提取碘的实验原理。
2. 学习从植物中分离提纯无机物的一般方法。
3. 学习萃取的有关原理,并掌握其操作,复习掌握过滤的原理及操作。
二、过程与方法
1. 通过实验了解一般的分离提纯方法在“从海带中提取碘”实验中的应用体验。
2. 通过将I-氧化为I2再进行萃取分离的过程,体会转化的方法在物质分离中的应用。
三、情感、态度与价值观
1. 体会从植物中提取某些成分的重要价值,增强将化学知识应用于生产、生活实践的意识,加强STS教育,培养学生“科学态度与社会责任”的学科素养。
2. 通过具体物质从自然界中分离提纯的实验,培养学生“科学探究与创新意识”的学科素养。
3.通过学习从植物中分离提纯无机物的一般方法,建立起从实验学习化学的方法认知模型。
教学环节
技术教育内容
科学史实:屠呦呦从青蒿中提取青
蒿素,获得诺贝尔生理或医学奖
海带制碘教学思路
学习从植物中提取有利成分的
一般路线
实验设计:如何从海带中提取碘?
设计实验:动手绘制流程图
实践活动:开展从海带中制取得到
碘的实验活动。
社会现实:认识我国海带制碘工业
的发展。
了解我国海带制碘技术的发展
开展具体的实践操作活动
【学生预习】课外阅读材料1、材料2。
通过屠呦呦的科技发现,形成从植物中提取某些成分的技术路线。
[视频引入]
屠呦呦获诺贝尔奖
【教学环节1 】活动背景
[颁奖视频]
屠呦呦从青蒿中提取得到青蒿素给我们的启示呢?
小组交流分享:屠呦呦从青蒿中发现青蒿素的实验历程。
(在班级微信群中,提前给学生发送课外阅读资料 )
【学生活动1-1】
1.屠呦呦团队发现青蒿素过程很艰辛!
2.青蒿素的发现是中国传统医药奉献给人类的一份礼物。
3.学习研究团队对国家使命的责任与担当,团结与协作,奋斗与奉献精神。
【交流分享1-1 】
[课外阅读材料1]
[课外阅读材料2]
【问题1-1】
从植物中提取某些成分的一般方法是什么?
阅读资料3,思考并结合小组交流讨论,初步形成从植物中提取某些成分的技术路线。
【学生活动1-2】
【交流分享1-2】
[课外阅读材料3]
青蒿素
→
在青蒿植物中
→
石油醚浸泡
→
分离提纯产品
从植物中提取某些成分的技术路线:
目标产品
→
确定原料
→
确定反应原理
→
设计反应路径
→
分离提纯产品
(有机物)
(存在)
(有机溶剂提取)
(理论指导实践)
【总结1】
【问题1-2】
如何从海带中提取碘?(具体例子)
为什么要提取碘?你了解碘的用途有哪些?
【教学环节2 】
实验设计
海带中碘元素的存在形式是什么?如何将待提取物转化为易于提取物?
【阅读】
课本第9页“资料在线”
【展示】
海带图片及碘的广泛用途
【问题2-1】
【问题2-2】
碘是人体生长发育不可缺少的微量元素之一。人若摄入碘量不足,会引起甲状腺肿大病;儿童缺碘,则严重影响其智力发展,导致智商低下,因此,人们将碘称为智慧元素。
经常吃些海带、紫菜等海藻类植物,可以防治甲状腺肿大,这是由于海带中富含碘。
[看图说话] 碘缺乏的危害?
碘的用处
工业原料,半导体材料的研制
参与人体甲状腺素合成
调节新陈代谢
生长发育不可缺少的微量元素
影响智力
课外读物
主要成分
蛋白质、糖类、脂肪、粗纤维、褐藻胶、甘露醇、维生素、有机碘化物等有机物。
氯化钠、碳酸钠、硫酸钠、碘化钠等无机盐。
次要成分
海带的成分
资料
设计从海带中提取碘的实验方案
根据有关研究结果表明:海带中99.2%的碘为水溶性碘。浸出液中碘主要以I-的形式存在,占浸出总碘量的88.3%;其次为有机碘,占10.3%;IO-3的含量最少,仅占1.4%。经灼烧后,灰烬中的碘可以转化为能溶于水的无机碘化物( I- )。
小组根据思考问题及教师所提供的知识,展开讨论交流,明确从海带中提取碘的原理知识,并进一步得出从海带中提取碘的实验技术流程图。
【小组活动2-1 】
资料
1.将有机物转化为无机物常用的方法?如何将海带中有机碘转化为无机碘(I-)?
2.如何将海带灰(固体)中的无机碘转化为水溶液中无机碘?联系日常生活中煮中草药的例子。
3.如何将无机碘(I-)转化为碘单质(I2)?根据氧化还原反应原理,可加入什么试剂?教材上使用饱和氯水是否科学合理?可用什么氧化剂代替饱和氯水更好?
【思考问题】
4.如何检验海带中有碘元素的存在或如何检验从海带中经过转变得到碘单质?
5.将海带中的碘元素转化为水溶液中的碘单质(I2)后,如何将水溶液中的碘单质(I2)富集起来?
6.如何从碘的四氯化碳溶液中得到晶体碘呢?参考资料,使用蒸馏的方法可以吗?是否还有更好的方法?(阅读课本第12页“进一步探索”)
——将有机物转化为无机物常用加热分解的方法,若要将海带中有机碘转化为无机碘,可将海带灼烧。
1.将有机物转化为无机物常用的方法?如何将海带中有机碘转化为无机碘(I-)?
2.如何将海带灰(固体)中的无机碘转化为水溶液中无机碘?联系日常生活中煮中草药的例子。
3.如何将无机碘(I-)转化为碘单质(I2)?根据氧化还原反应原理,可加入什么试剂?教材上使用饱和氯水是否科学合理?可用什么氧化剂代替饱和氯水更好?
——将海带灰放入烧杯中,加入蒸馏水,加热煮沸,冷却后过滤。
——将I-转化为I2发生氧化反应,因此需要加入氧化剂,饱和氯水过量时,会使碘单质继续氧化生成HIO3,可用双氧水代替饱和氯水,且双氧水通常称为“绿色氧化剂”。
【思考问题】
——取适量经过氧化后的溶液放入试管中,再加入淀粉溶液,振荡,溶液变蓝。或加入四氯化碳,振荡后静置,观察水层和四氯化碳(紫红色)的颜色。
4.如何检验海带中有碘元素的存在或如何检验从海带中经过转变得到碘单质?
5.将海带中的碘元素转化为水溶液中的碘单质(I2)后,如何将水溶液中的碘单质(I2)富集起来?
6.如何从碘的四氯化碳溶液中得到晶体碘呢?参考资料,使用蒸馏的方法可以吗?是否还有更好的方法?(阅读课本第12页“进一步探索”)
——根据萃取的原理,碘单质在四氯化碳中溶解能力强,而在水中的溶解能力弱,可加入四氯化碳来萃取碘、通过分液富集碘单质。
——查数据可知,四氯化碳的沸点为77。C,碘在184.4。C升华,两者相差107.4。C,这样大的温差,在理论上用蒸馏的方法应该可行的。但实验表明不能用蒸馏方法充分分离四氯化碳层中的I2,因受热时,在四氯化碳挥发的同时也有部分I2升华。工业生产实际也不是使用蒸馏的方法,而是用“反萃法”。
1.实验原理
海带中含有丰富的碘元素,其主要的存在形态为化合态。经灼烧后,灰烬中的碘可以转化为能溶于水的无机碘化物。碘离子(I-)具有较强的还原性,可被氧化剂氧化生成碘单质(I2)。生成的碘单质(I2)可用四氯化碳(CCl4)把它从水溶液中萃取出来。
2I- + 2H+ + H2O2 = I2 + 2H2O
氧化还原反应原理:
2I- + Cl2 = I2 + 2Cl-
【交流分享2-1 】
2.萃取的原理
利用物质在互不相溶(或微溶)的溶剂中溶解能力不同进行分离或提纯的方法。例如,四氯化碳与水互不相溶,而碘单质在四氯化碳中的溶解能力比在水中的溶解能力强,如果将四氯化碳与含有碘单质的水溶液混合振荡,碘单质就会从水中富集到四氯化碳中。
萃取剂的条件:萃取剂与溶剂互不相溶(或微溶);溶质在萃取剂中溶解能力强。
主要仪器:分液漏斗
干海带
灰 烬
浊 液
滤 液
混合液
上 层
下 层
碘单质
灼烧
滤 渣
水浸
过滤
酸化
CCl4
萃取
分液
反萃法
氧化
淀粉溶液
完善从海带中提取碘流程图,从海带中提取碘的实验方案。
小结
【小组活动2-2】小组汇报、展示实验设计方案。
从海带中提取碘实验操作。
利用小组事先准备好的海带灰,按照设计的流程图,分别进行溶解、过滤、氧化、萃取、分液、反萃法等一系列实验操作活动。
【教学环节3】
实践活动
【小组活动3-1 】
实验步骤及注意事项
(1)称取样品(预先准备)
①操作要点:用托盘天平称取5.0g干燥的海带,放入坩埚中。
②实验注意事项:托盘天平的正确使用。
(2)灼烧灰化(预先准备)
在通风处加热灼烧干海带,待海带完全灰化后,冷却,再将灰烬转移到小烧杯中。
②实验现象:
灼烧灰化的过程大约需要5-6分钟,干海带逐渐变的更干燥、卷曲,最后变成黑色粉末或细小颗粒。期间还会产生大量白烟,并伴有焦糊味。
①操作要点:
应在通风处加热灼烧,或使用通风设备去除白烟和难闻的气味。
应边加热边搅拌,用坩埚钳夹持坩埚,玻璃棒小心搅拌,使海带均匀受热,加快灰化的速度。
灼烧完毕,应将坩埚和玻璃棒放在石棉网上冷却,不可直接放在冷的实验台上,防止温度很高的坩埚骤冷而破裂。
③实验注意事项:
(3)溶解过滤
②实验现象:
煮沸时固体未见明显溶解,过滤后得到淡黄色的清亮溶液。
①操作要点:
向小烧杯中加入20mL蒸馏水,搅拌,煮沸2-3min,使可溶物溶解。过滤,收集滤液,弃去滤渣。
应隔着石棉网加热小烧杯中的混合物。
加热过程中应不断搅拌,加快溶解,同时防止液体受热不均而溅出。
过滤操作应注意“一贴、二低、三靠” 。
③实验注意事项:
(4)氧化及检验
①操作要点
②实验现象
③实验注意事项
在滤液中加入10滴2mol·L-1H2SO4溶液,再加入2mL、6%的H2O2溶液。取出少许混合液,用淀粉溶液检验碘单质。
加入氧化剂后溶液颜色变深,呈棕黄色。加淀粉,溶液变蓝色。
控制试剂的用量。
检验碘元素应取少量样品,不要向所有滤液中直接加淀粉溶液,否则后续实验将无法操作。
①操作要点:
将氧化检验后的余液转入分液漏斗中,加入2mLCCl4,充分振荡,将上口塞子打开,静置,待完全分层后,分液。
②实验现象:
加入CCl4振荡后,液体分层,且下层液体显紫红色,上层液体几乎无色。
(5)萃取分液(富集)
[萃取分液视频]
a.将几个小组同学得到碘的四氯化碳溶液合并于分液漏斗中,向其中逐滴加入40%的NaOH溶液,边滴边振荡,直到四氯化碳层不显红色为止。
b.分液,将水层转入烧杯中,向得到的水溶液中滴加45%的硫酸酸化,可重新生成碘单质。由于碘单质在水中的溶解度很小,可沉淀析出,分离后即可获取固态碘单质。
①操作要点
a.四氯化碳层红色褪去。
b.有沉淀析出。
②实验现象
反萃法
(6)反萃法(提纯)
1.灼烧的作用是什么?
2. 水浸时常常要将悬浊液煮沸
2~3min,目的是什么?
3.使用双氧水作氧化剂时,为
什么要进行酸化?
合作解疑
4.碘元素在整个实验过程中是如
何转化的?
1.灼烧的作用是什么?
2~3min,目的是什么?
加快碘化物在水中的溶解,以使灰烬中的I-尽可能多的进入溶液。
因海带灰的浸出液中含有碳酸钠(或碳酸钾)等使溶液显碱性的物质,酸化的目的是使溶液呈弱酸性,有利于氧化剂把I-氧化为I2。
海带中的碘元素是以化合态碘(无机碘和有机碘)存在,通过灼烧、浸泡加热、氧化后,转化为游离态碘(碘单质)。
将干海带高温灼烧,使有机物转化为CO2和H2O,呈气态逸散,同时将有机碘转化为无机碘( I- )。
2. 水浸时常常要将悬浊液煮沸
3.使用双氧水作氧化剂时,为
什么要进行酸化?
合作解疑
4.碘元素在整个实验过程中是如
何转化的?
【教学环节4】 社会现实 (课外作业延伸)
认识我国海带制碘工业的发展
【上网查询】
我国海带碘工业的发展历史。
【问题4-1 】
我国海带制碘工业如何从无到有,从中可以获得哪些启示?
【问题4-2 】
工业生产与实验设计流程之间的区别及原因。
【问题4-3 】
通过思考,深入分析工业生产技术与实验室制取物质的区别与联系。
中国海带之父——曾呈奎
世界著名的海洋生物学家、我国海藻学研究的奠基人。他的一系列原创性研究,使我国海带养殖从零一跃成为世界第一 。
先后发明人工海带夏苗低温培育、海带施肥增产、海带南移养殖等技术,使冷温带的海带在我国北方温带海域、南方暖温带和亚热带海域都能进行大规模人工养殖。
“海洋科技要走自主创新之路”
“我要给人们饭桌上添几道菜”
“我的海洋事业在中国”
【练习】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
海
藻
①灼烧
海
藻
灰
海藻灰
悬浊液
含碘离
子溶液
含碘
水溶液
含碘
苯溶液
②浸泡
③
④MnO2+ 稀H2SO4
⑤提取碘
⑥
单质碘
运用扩展
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 ( )
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
BDE
过滤
反萃法
2I-+MnO2+4H+=Mn2++I2+2H2O
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法: 。
苯与水互不相溶;碘在苯中的溶解度比在水中大
取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色。如果变蓝,说明还有单质碘;反之,说明没有单质碘。
你有哪些收获?
【教学环节5】总结
1.了解从植物中提取无机物的一般方法;
2.学习萃取的原理和操作;
3.利用氧化还原反应将待提取物转化为易提取的物质,体会转化的方法在物质分离中的应用。
谢谢!
