11.1生活中的盐--复分解反应的条件(共23张PPT)
文档属性
| 名称 | 11.1生活中的盐--复分解反应的条件(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-16 16:29:19 | ||
图片预览







文档简介
(共23张PPT)
现实验室有一瓶未贴标签的白色固体,可能是氯化钠和纯碱中的一种,请你设计实验加以鉴别。
取少量固体于试管中,滴加稀盐酸,振荡,观察
若产生气泡,则是纯碱;若无明显现象,则是NaCl
取少量固体于试管中,加足量的水溶解,加入澄清石灰水,振荡,观察
若产生白色沉淀,则是纯碱;若不产生沉淀,则是NaCl
取少量固体于试管中,加足量的水溶解,滴加无色酚酞溶液,振荡,观察
若溶液变红色,则是纯碱;若溶液不变红,则是NaCl
方法 现象、结论
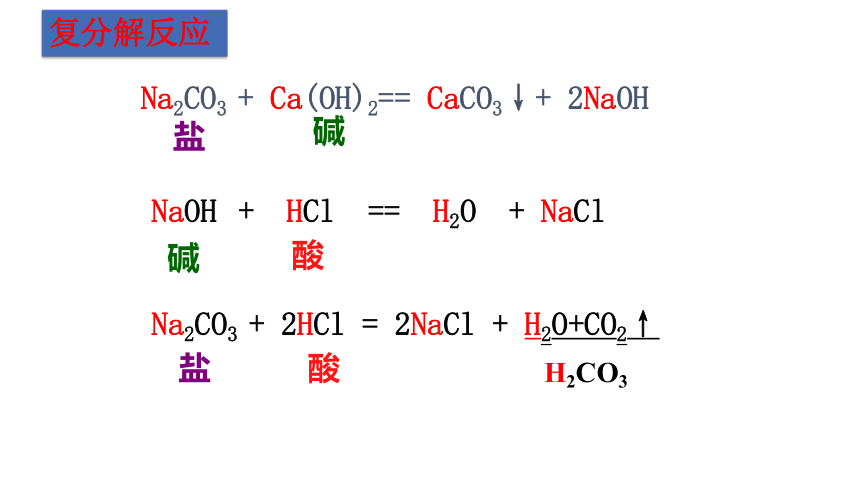
NaOH + HCl == H2O + NaCl
Na2CO3 + Ca(OH)2== CaCO3↓+ 2NaOH
盐
碱
碱
盐
酸
酸
H2CO3
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
A
+
C
=
B
A
B
D
C
D
+
由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应
化合反应
A + B + … … == AB
分解反应
AB == A + B + … …
置换反应
单质A + 化B == 单质C +化D
复分解反应
AB + CD == AD + CB
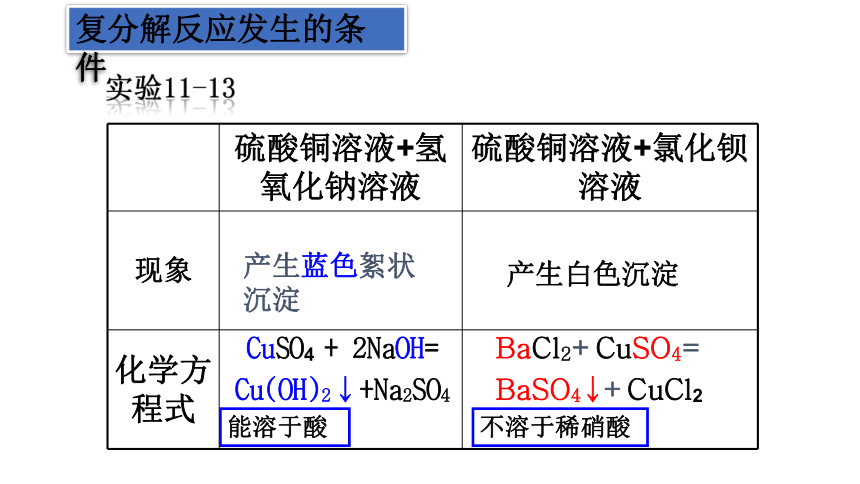
产生蓝色絮状沉淀
BaCl2+CuSO4=
BaSO4↓+CuCl2
CuSO4 + 2NaOH=
Cu(OH)2↓+Na2SO4
产生白色沉淀
不溶于稀硝酸
能溶于酸
硫酸铜溶液+氢氧化钠溶液 硫酸铜溶液+氯化钡溶液
现象
化学方程式
产生白色沉淀
NaCl + AgNO3 = AgCl↓+ NaNO3
补充实验:向盛有少量NaCl溶液的试管滴入硝酸银( AgNO3 )溶液,观察现象。
课本P75的讨论
不溶于稀硝酸
实验内容 NaCl溶液+硝酸银溶液
现象
化学方程式
值得注意的是:
并不是任意酸、碱、盐之间都能进行复分解反应。复分解反应的进行是有条件的!
下面我们从微观角度来研究下这些反应发生的条件
当两种化合物互相交换成分,生成物中有水或沉淀 ↓ 或气体 ↑生成时,反应才能发生。
Why?
我们已经知道:
酸、碱、盐溶液中存在的是它们的离子和
水分子,因此酸、碱、盐中的两种物质在溶
液中混合,实际上是它们的离子与水分子的
混合。
Na+
OH-
H+
Cl-
H2O
NaOH溶液和稀盐酸反应(碱和酸反应)
结论:
有水生成的复分解反应实质是 H+和OH-反应,即酸碱中和反应的实质
实质:
旁观者:
Cl-和Na+
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应(盐和酸反应)
结论:
有co2气体生成的复分解反应实质是CO32-和H+反应
CO2
实质:
旁观者:
Cl-和Na+
Na+
Na+
Cu 2+
碳酸钠和稀盐酸反应(盐和碱反应)
结论:
有Cu(OH)2沉淀生成的复分解反应实质是Cu 2+和OH-反应
实质:
旁观者:
SO42-和Na+
OH-
OH-
SO42-
Cu(OH)2
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应(盐和另一种盐反应)
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
由此看来,酸、碱、盐之间发生的复分解反应,实质上是离子间的互换反应,两种离子之间如果能结合成难溶性的碱或盐( ↓ )、或气体↑ 、或水,反应就能发生,反之,反应就不能发生。
复分解反应的发生:其实就是溶液中离子的减少的过程。
能结合成水
H+
+ == H2O
OH-
H+
CO32-
能结合成沉淀
Ba2+
+ == BaSO4↓
SO42-
能形成沉淀的离子有很多……
+ →H2O+CO2↑
H+
HCO3-
+ →H2O+CO2↑
能产生气体
Cu2+
OH-
+ →Cu(OH)2 ↓
H+
CO32-
OH-
反应物必须全部可溶
探究活动:课本P75的探究
1、判断反应能否发生,并说明理由。
2、设计实验证明。
能
能
能
不能
有水生成
没有生成水或气体或沉淀
有气体生成
有沉淀生成
NaOH NaCl K2CO3 Ba(NO3)2
稀硫酸
判断依据
BaCl2 + Na2SO4 ——
NaCl + AgNO3 ——
NaOH + K2SO4 ——
KCl + NaNO3 ——
CuCO3+H2SO4 ——
Mg(OH)2 + 2HCl ——
请判断下列反应能否发生:
结合课本114页附录1判断下列反应能否发生
能
不能
能
能
能
能
能
能
能
不能
不能
不能
H2SO4 Ba(NO3)2 NaOH K2CO3
H2SO4
Ba(NO3)2
NaOH
K2CO3
本课小结
复分解反应:
1、概念:由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应;
2、条件:两种化合物互相交换成分,生成物中有沉淀↓或气体↑或水生成;微观本质就是溶液中离子的减少。
特别提醒:碱和盐、盐和盐要发生反应,首先反应物必须都可溶。
3、特征:两种化合物互相交换成分,反应前后各元素的化合价不变;
4、判断:先让两种化合物互相交换成分,看交换后的物质是否有沉淀↓或气体↑或水。
1、下列各组物质的溶液混合后不能发生反应的是( )
A. NaCl和 H2SO4 B. NaOH 和HCl
C. Na2CO3 和H2SO4 D. AgNO3和NaCl
Na+、CO32-、H+ 、SO42-
Ag+、NO3-、Na+、 Cl-
Na+、Cl-、H+ 、SO42-
Na+、 OH- 、H+ 、 Cl-
A
2、下列各组物质中,在溶液中能大量共存的( )
A、NaOH NaCl CuCl2
B、Ca(OH)2 KCl HNO3
C、BaCl2 HCl Na2SO4
D、KCl Na2CO3 NaOH
3、下列各物质能在PH=1的溶液中大量存在,且能
得到无色溶液的是( )
A、NaNO3 ? HCI? Na2SO4????
B、NaNO3? NaCI? CuSO4 C、FeCI3 Na2SO4? Na2CO3?
D、NaOH?? BaCI2? Na2SO4
D
A
H+
OH-
CO32-
HCO3-
NH4+
Ba2+
Ca2+
SO42-
Mg2+
Cu2+
Al3+
Fe3+
Ag+
Cl-
在同一溶液中相互反应的离子有
现实验室有一瓶未贴标签的白色固体,可能是氯化钠和纯碱中的一种,请你设计实验加以鉴别。
取少量固体于试管中,滴加稀盐酸,振荡,观察
若产生气泡,则是纯碱;若无明显现象,则是NaCl
取少量固体于试管中,加足量的水溶解,加入澄清石灰水,振荡,观察
若产生白色沉淀,则是纯碱;若不产生沉淀,则是NaCl
取少量固体于试管中,加足量的水溶解,滴加无色酚酞溶液,振荡,观察
若溶液变红色,则是纯碱;若溶液不变红,则是NaCl
方法 现象、结论
NaOH + HCl == H2O + NaCl
Na2CO3 + Ca(OH)2== CaCO3↓+ 2NaOH
盐
碱
碱
盐
酸
酸
H2CO3
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
A
+
C
=
B
A
B
D
C
D
+
由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应
化合反应
A + B + … … == AB
分解反应
AB == A + B + … …
置换反应
单质A + 化B == 单质C +化D
复分解反应
AB + CD == AD + CB
产生蓝色絮状沉淀
BaCl2+CuSO4=
BaSO4↓+CuCl2
CuSO4 + 2NaOH=
Cu(OH)2↓+Na2SO4
产生白色沉淀
不溶于稀硝酸
能溶于酸
硫酸铜溶液+氢氧化钠溶液 硫酸铜溶液+氯化钡溶液
现象
化学方程式
产生白色沉淀
NaCl + AgNO3 = AgCl↓+ NaNO3
补充实验:向盛有少量NaCl溶液的试管滴入硝酸银( AgNO3 )溶液,观察现象。
课本P75的讨论
不溶于稀硝酸
实验内容 NaCl溶液+硝酸银溶液
现象
化学方程式
值得注意的是:
并不是任意酸、碱、盐之间都能进行复分解反应。复分解反应的进行是有条件的!
下面我们从微观角度来研究下这些反应发生的条件
当两种化合物互相交换成分,生成物中有水或沉淀 ↓ 或气体 ↑生成时,反应才能发生。
Why?
我们已经知道:
酸、碱、盐溶液中存在的是它们的离子和
水分子,因此酸、碱、盐中的两种物质在溶
液中混合,实际上是它们的离子与水分子的
混合。
Na+
OH-
H+
Cl-
H2O
NaOH溶液和稀盐酸反应(碱和酸反应)
结论:
有水生成的复分解反应实质是 H+和OH-反应,即酸碱中和反应的实质
实质:
旁观者:
Cl-和Na+
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应(盐和酸反应)
结论:
有co2气体生成的复分解反应实质是CO32-和H+反应
CO2
实质:
旁观者:
Cl-和Na+
Na+
Na+
Cu 2+
碳酸钠和稀盐酸反应(盐和碱反应)
结论:
有Cu(OH)2沉淀生成的复分解反应实质是Cu 2+和OH-反应
实质:
旁观者:
SO42-和Na+
OH-
OH-
SO42-
Cu(OH)2
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应(盐和另一种盐反应)
结论:
有BaSO4沉淀生成的复分解反应实质是
Ba2+和SO42-反应
实质:
旁观者:
Cl-和Na+
由此看来,酸、碱、盐之间发生的复分解反应,实质上是离子间的互换反应,两种离子之间如果能结合成难溶性的碱或盐( ↓ )、或气体↑ 、或水,反应就能发生,反之,反应就不能发生。
复分解反应的发生:其实就是溶液中离子的减少的过程。
能结合成水
H+
+ == H2O
OH-
H+
CO32-
能结合成沉淀
Ba2+
+ == BaSO4↓
SO42-
能形成沉淀的离子有很多……
+ →H2O+CO2↑
H+
HCO3-
+ →H2O+CO2↑
能产生气体
Cu2+
OH-
+ →Cu(OH)2 ↓
H+
CO32-
OH-
反应物必须全部可溶
探究活动:课本P75的探究
1、判断反应能否发生,并说明理由。
2、设计实验证明。
能
能
能
不能
有水生成
没有生成水或气体或沉淀
有气体生成
有沉淀生成
NaOH NaCl K2CO3 Ba(NO3)2
稀硫酸
判断依据
BaCl2 + Na2SO4 ——
NaCl + AgNO3 ——
NaOH + K2SO4 ——
KCl + NaNO3 ——
CuCO3+H2SO4 ——
Mg(OH)2 + 2HCl ——
请判断下列反应能否发生:
结合课本114页附录1判断下列反应能否发生
能
不能
能
能
能
能
能
能
能
不能
不能
不能
H2SO4 Ba(NO3)2 NaOH K2CO3
H2SO4
Ba(NO3)2
NaOH
K2CO3
本课小结
复分解反应:
1、概念:由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应;
2、条件:两种化合物互相交换成分,生成物中有沉淀↓或气体↑或水生成;微观本质就是溶液中离子的减少。
特别提醒:碱和盐、盐和盐要发生反应,首先反应物必须都可溶。
3、特征:两种化合物互相交换成分,反应前后各元素的化合价不变;
4、判断:先让两种化合物互相交换成分,看交换后的物质是否有沉淀↓或气体↑或水。
1、下列各组物质的溶液混合后不能发生反应的是( )
A. NaCl和 H2SO4 B. NaOH 和HCl
C. Na2CO3 和H2SO4 D. AgNO3和NaCl
Na+、CO32-、H+ 、SO42-
Ag+、NO3-、Na+、 Cl-
Na+、Cl-、H+ 、SO42-
Na+、 OH- 、H+ 、 Cl-
A
2、下列各组物质中,在溶液中能大量共存的( )
A、NaOH NaCl CuCl2
B、Ca(OH)2 KCl HNO3
C、BaCl2 HCl Na2SO4
D、KCl Na2CO3 NaOH
3、下列各物质能在PH=1的溶液中大量存在,且能
得到无色溶液的是( )
A、NaNO3 ? HCI? Na2SO4????
B、NaNO3? NaCI? CuSO4 C、FeCI3 Na2SO4? Na2CO3?
D、NaOH?? BaCI2? Na2SO4
D
A
H+
OH-
CO32-
HCO3-
NH4+
Ba2+
Ca2+
SO42-
Mg2+
Cu2+
Al3+
Fe3+
Ag+
Cl-
在同一溶液中相互反应的离子有
同课章节目录
