高中化学人教版选修四第三章第二节水的电离和溶液的酸碱性第2课时 溶液pH的计算(共19张PPT)
文档属性
| 名称 | 高中化学人教版选修四第三章第二节水的电离和溶液的酸碱性第2课时 溶液pH的计算(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 140.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-17 09:31:21 | ||
图片预览




文档简介
(共19张PPT)
第二课时 溶液的pH计算和酸碱性
1、强酸强碱 pH 的计算:
强酸:
c(酸)
电离
c (H+)
-lg
pH
强碱:
c(碱)
电离
c (OH-)
Kw
c (H+)
-lg
pH
-lg
pOH
14-pOH
pH
例:计算0.01mol/L的HCl溶液的pH值
解、∵ c (H+) =0.01×1=0.01
∴ pH = - lg 0.01 = 2
练习:试计算常温下的①0.05 mol/L H2SO4溶液;②0.0005 mol/L Ca(OH)2 溶液的pH值
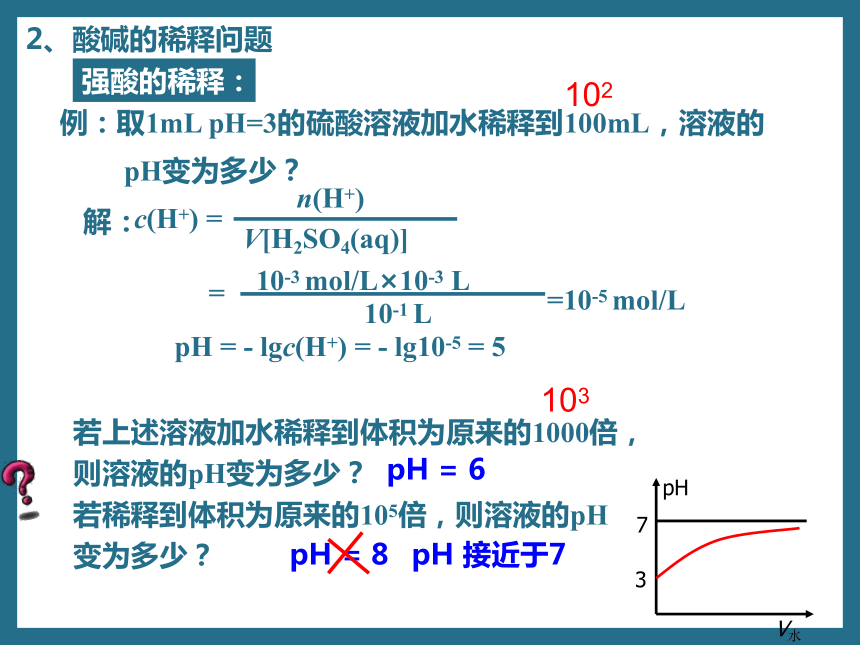
强酸的稀释:
例:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的
pH变为多少?
解:
c(H+) =
pH = - lgc(H+) = - lg10-5 = 5
10-3 mol/L×10-3 L
=10-5 mol/L
10-1 L
=
n(H+)
V[H2SO4(aq)]
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
102
103
pH = 6
pH = 8
pH 接近于7
7
3
pH
V水
2、酸碱的稀释问题
例:pH=1的盐酸稀释100倍后pH=?
pH=1的醋酸稀释100倍后pH=?
结论:稀释100倍pH变化<3
<3
3
盐酸
醋酸
V水
3
1
pH
100倍
稀释相同倍数时
pH:
盐酸>醋酸
稀释到相同pH时
稀释的倍数:
醋酸>盐酸
弱酸稀释
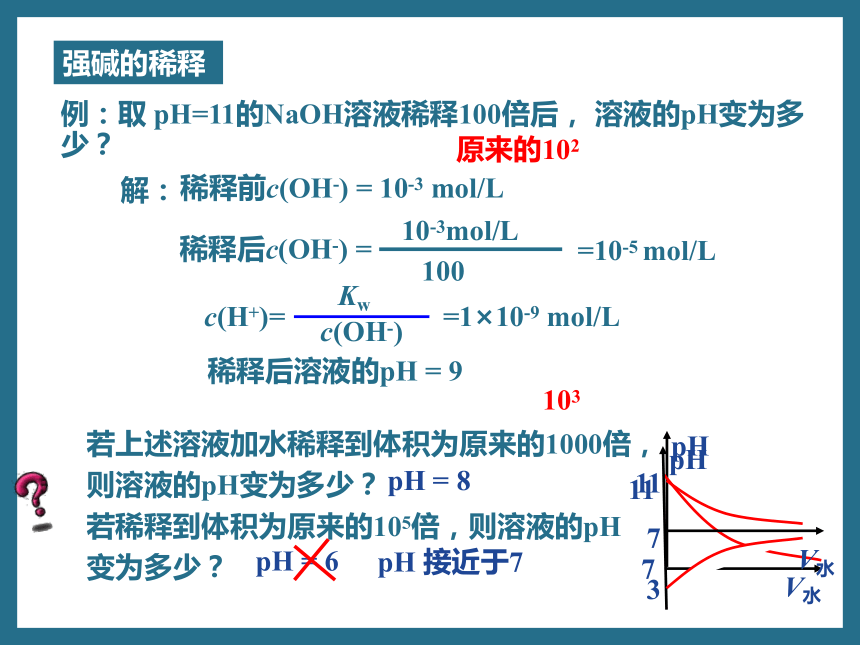
强碱的稀释
例:取 pH=11的NaOH溶液稀释100倍后, 溶液的pH变为多少?
解:
稀释前c(OH-) = 10-3 mol/L
10-3mol/L
=10-5 mol/L
100
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
103
pH = 8
pH = 6
pH 接近于7
原来的102
稀释后c(OH-) =
稀释后溶液的pH = 9
Kw
c(OH-)
c(H+)= =1×10-9 mol/L
11
7
pH
V水
11
7
pH
V水
3
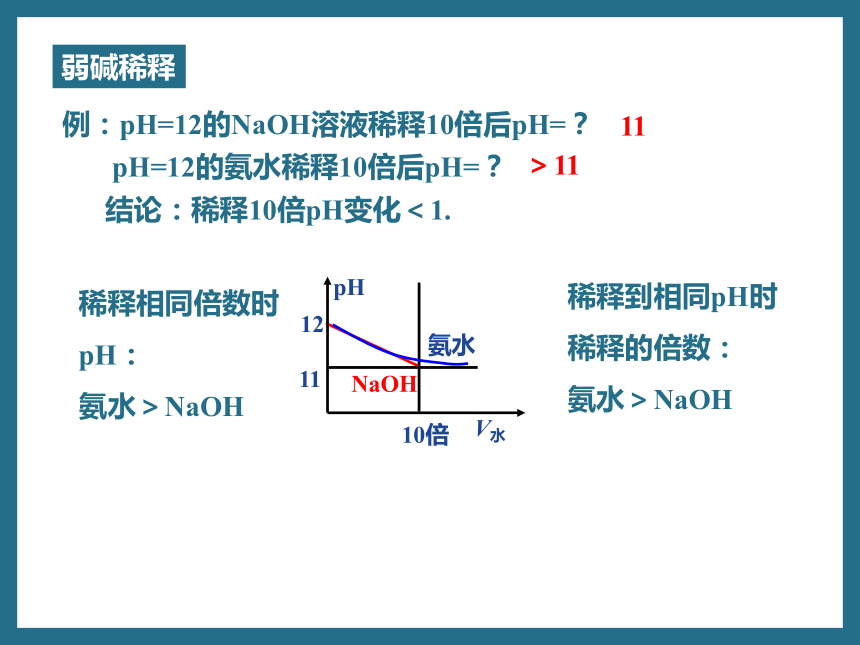
例:pH=12的NaOH溶液稀释10倍后pH=?
pH=12的氨水稀释10倍后pH=?
结论:稀释10倍pH变化<1.
>11
11
NaOH
氨水
V水
12
11
pH
10倍
稀释相同倍数时
pH:
氨水>NaOH
稀释到相同pH时
稀释的倍数:
氨水>NaOH
弱碱稀释
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH强碱pH=b,加水稀释10n倍,则pH=b-n;
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸
不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释
相同倍数,强酸的pH变化幅度大。
(强碱、弱碱相似)
小 结
3、强酸与强酸混合:
强酸Ⅰ:
cⅠ
电离
c (H+)Ⅰ
强酸Ⅱ:
cⅡ
电离
c (H+)Ⅱ
c (H+)混合
-lg
pH
计算10mL 0.1mol/L HCl和10mL 0.05 mol/L H2SO4混合溶液的pH
解: c (H+)Ⅰ=0.1×1=0.1 mol/L c (H+)Ⅱ= 0.05×2=0.1 mol/L
c (H+)混合=
pH = - lg 0.1 = 1
练习:pH=2的盐酸溶液和0.00005 mol/L的硫酸溶液等体积混合,试计算混合溶液的pH值
解:∵c (H+)Ⅰ=0.01 mol/L c (H+)Ⅱ=0.00005×2=0.0001 mol/L
c (H+)混合=
pH=- lg 0.005 = 2+lg2 = 2.3
两种强酸等体积混合,混合液pH = pH 小+ lg2 = pH小+0.3
思考:怎样计算强碱与强碱混合溶液的pH值?
4、强碱与强碱混合:
强碱Ⅰ:
CⅠ
电离
c (OH-)Ⅰ
强碱Ⅱ:
CⅡ
电离
c (OH-)Ⅱ
C (OH-)混合
-lg
pH
Kw
C (H+)混合
-lg
pOH
14-pOH
例、25 ℃时,10mL 0.1mol/L NaOH和10mL 0.05 mol/L Ba(OH)2混合,计算混合溶液的pH值
解:∵c(OH-)Ⅰ=0. 1 c (OH-)Ⅱ=0.05×2=0.1
c (OH-)混合=
c(H+)混合=
pH= - lg 10-13 = 13
练习:pH=12的氢氧化钠溶液和0.00005 mol/L的氢氧化钡溶液等体积混合,试计算混合溶液的pH值
或pOH= - lg 0.1 = 1
pH= 14 – 1=13
解:∵c (OH-)Ⅰ=0.01 c (OH-)Ⅱ=0.00005×2=0.0001
c (OH-)混合=
pOH=- lg 0.005 = 2+lg2 = 2.3
pH=14 -2.3= 11.7
两种强碱等体积混合,混合液pH = pH 大- lg2 = pH大- 0.3
计算:⑴、pH=13和pH=11的强碱 ⑵、pH=1和pH=3的强酸等体积混合的混合液的pH值
解:⑴、pH混= pH大-0.3=13-0.3=12.7
⑵、pH混= pH小+0.3=1+0.3=1.3
想一想:强酸强碱混合,混合溶液的pH值怎样计算?
结论:酸碱混合时,先计算过量的c (H+) 或c (OH-)再计算pH
5、强酸强碱混合:
⑴、强酸强碱恰好完全反应,溶液呈中性,混合溶液 pH = 7
⑵、强酸强碱混合酸过量,先求过量的酸的浓度,再求pH
pH=-lg c(H+)余
例:求30mL pH=3的盐酸溶液与20mL pH=11的氢氧化钠溶液反应后溶液的pH
解:∵ c(H+)=10-3 mol / L c(OH-)=10-3 mol / L
pH=-lg 2×10-4 =4-lg2
⑶、强酸强碱混合碱过量,先求过量的碱的浓度,再求pH
pOH=-lg c(OH-)余
pH=14- pOH
或由c(OH-)余
Kw
c(H+)
-lg
pH
练习:求30mL pH=2的硫酸溶液与70mLpH=12的氢氧化钠溶液反应后溶液的pH
判断酸碱等体积混合后溶液酸碱性的规律
1、酸碱的pH之和为14,等体积混合
(1)强酸与强碱混合,则混合后的溶液的pH ;
=7
(2)强酸与弱碱混合,则混合后的溶液的pH ;
>7
理解:
∵由题给pH之和为14,体积又相同,可理解为已电离的部分刚好中和,呈中性。
(3)弱酸与强碱混合,则混合后的溶液的pH ;
<7
弱碱可以继续电离,就呈碱性。
弱酸可以继续电离,就呈酸性。
(1)若pHa + pHb =14,则c(H+) c (OH-),
混合溶液pH ,呈 ;
=
=7
中性
(2)若pHa + pHb <14,则c (H+) C(OH-),
混合溶液pH ,呈 ;
>
<7
酸性
(3)若pHa + pHb >14,则c (H+) c (OH-),
混合溶液pH ,呈 。
<
>7
碱性
2、强酸(pHa、Va)与强碱(pHb、Vb)等体积混合
已知盐酸的体积V1,pH=a;NaOH溶液的体积V2,pH=b。则它们混合后溶液的酸碱性
(1)、当V1=V2时,a+b= ,则混后溶液呈中性,pH=7
(2)、当V1=10V2时(酸多),a+b= ,则混后溶液呈中性,pH=7
(3)、当V2=10V1时(碱多),a+b= ,则混后溶液呈中性,pH=7
3、强酸强碱非等体积混合后溶液的pH
15
14
13
例1:已知室温下等体积的酸和碱溶液混合。则混合后溶液的pH<7是
(A)pH=3的硝酸与pH=11的氢氧化钠溶液
(B)pH=3的盐酸与pH=11的氨水
(C)pH=3的硫酸与pH=11的氢氧化钠溶液
(D)pH=3的醋酸与pH=11的氢氧化钡溶液
D
例2:将XmLpH=a的NaOH溶液与YmLpH=b的盐酸溶液混合。下列关于反应后溶液的pH说法正确的是
(A)X=Y且a+b=14时,混合后pH>7
(B)10X=Y且a+b=13时,混合后pH=7
(C)aX=bY且a+b=13时,混合后pH=7
(D)X=10Y且a+b=14时,混合后pH>7
D
1.有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍
数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强
到弱的顺序是( )
A.HX 、 HY 、 HZ B.HZ 、 HY 、 HX
C.HX 、 HZ 、 HY D.HY 、 HZ 、 HX
B
课堂练习
2.pH=2的A、B两种酸溶液各1mL,分别加水稀释到
1000mL,其pH与溶液体积V的关系如图所示。下列说法
正确的是 ( )
A、B两酸溶液的物质的量浓度一定相等
稀释后,A溶液的酸性比B溶液强
a=5时,A是强酸,B是弱酸
若A、B都是弱酸,则5>a>2
a
7
2
1
pH
V/mL
1000
A
B
CD
3.25℃时,某强酸溶液pH=a,某强碱溶液pH=b,若等体积
混合后.
⑴溶液显中性,a+b满足的关系:___________
⑵溶液显酸性,a+b满足的关系:___________
⑶溶液显碱性,a+b满足的关系:___________
a+b=14
a+b<14
a+b>14
第二课时 溶液的pH计算和酸碱性
1、强酸强碱 pH 的计算:
强酸:
c(酸)
电离
c (H+)
-lg
pH
强碱:
c(碱)
电离
c (OH-)
Kw
c (H+)
-lg
pH
-lg
pOH
14-pOH
pH
例:计算0.01mol/L的HCl溶液的pH值
解、∵ c (H+) =0.01×1=0.01
∴ pH = - lg 0.01 = 2
练习:试计算常温下的①0.05 mol/L H2SO4溶液;②0.0005 mol/L Ca(OH)2 溶液的pH值
强酸的稀释:
例:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的
pH变为多少?
解:
c(H+) =
pH = - lgc(H+) = - lg10-5 = 5
10-3 mol/L×10-3 L
=10-5 mol/L
10-1 L
=
n(H+)
V[H2SO4(aq)]
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
102
103
pH = 6
pH = 8
pH 接近于7
7
3
pH
V水
2、酸碱的稀释问题
例:pH=1的盐酸稀释100倍后pH=?
pH=1的醋酸稀释100倍后pH=?
结论:稀释100倍pH变化<3
<3
3
盐酸
醋酸
V水
3
1
pH
100倍
稀释相同倍数时
pH:
盐酸>醋酸
稀释到相同pH时
稀释的倍数:
醋酸>盐酸
弱酸稀释
强碱的稀释
例:取 pH=11的NaOH溶液稀释100倍后, 溶液的pH变为多少?
解:
稀释前c(OH-) = 10-3 mol/L
10-3mol/L
=10-5 mol/L
100
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
103
pH = 8
pH = 6
pH 接近于7
原来的102
稀释后c(OH-) =
稀释后溶液的pH = 9
Kw
c(OH-)
c(H+)= =1×10-9 mol/L
11
7
pH
V水
11
7
pH
V水
3
例:pH=12的NaOH溶液稀释10倍后pH=?
pH=12的氨水稀释10倍后pH=?
结论:稀释10倍pH变化<1.
>11
11
NaOH
氨水
V水
12
11
pH
10倍
稀释相同倍数时
pH:
氨水>NaOH
稀释到相同pH时
稀释的倍数:
氨水>NaOH
弱碱稀释
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸
不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释
相同倍数,强酸的pH变化幅度大。
(强碱、弱碱相似)
小 结
3、强酸与强酸混合:
强酸Ⅰ:
cⅠ
电离
c (H+)Ⅰ
强酸Ⅱ:
cⅡ
电离
c (H+)Ⅱ
c (H+)混合
-lg
pH
计算10mL 0.1mol/L HCl和10mL 0.05 mol/L H2SO4混合溶液的pH
解: c (H+)Ⅰ=0.1×1=0.1 mol/L c (H+)Ⅱ= 0.05×2=0.1 mol/L
c (H+)混合=
pH = - lg 0.1 = 1
练习:pH=2的盐酸溶液和0.00005 mol/L的硫酸溶液等体积混合,试计算混合溶液的pH值
解:∵c (H+)Ⅰ=0.01 mol/L c (H+)Ⅱ=0.00005×2=0.0001 mol/L
c (H+)混合=
pH=- lg 0.005 = 2+lg2 = 2.3
两种强酸等体积混合,混合液pH = pH 小+ lg2 = pH小+0.3
思考:怎样计算强碱与强碱混合溶液的pH值?
4、强碱与强碱混合:
强碱Ⅰ:
CⅠ
电离
c (OH-)Ⅰ
强碱Ⅱ:
CⅡ
电离
c (OH-)Ⅱ
C (OH-)混合
-lg
pH
Kw
C (H+)混合
-lg
pOH
14-pOH
例、25 ℃时,10mL 0.1mol/L NaOH和10mL 0.05 mol/L Ba(OH)2混合,计算混合溶液的pH值
解:∵c(OH-)Ⅰ=0. 1 c (OH-)Ⅱ=0.05×2=0.1
c (OH-)混合=
c(H+)混合=
pH= - lg 10-13 = 13
练习:pH=12的氢氧化钠溶液和0.00005 mol/L的氢氧化钡溶液等体积混合,试计算混合溶液的pH值
或pOH= - lg 0.1 = 1
pH= 14 – 1=13
解:∵c (OH-)Ⅰ=0.01 c (OH-)Ⅱ=0.00005×2=0.0001
c (OH-)混合=
pOH=- lg 0.005 = 2+lg2 = 2.3
pH=14 -2.3= 11.7
两种强碱等体积混合,混合液pH = pH 大- lg2 = pH大- 0.3
计算:⑴、pH=13和pH=11的强碱 ⑵、pH=1和pH=3的强酸等体积混合的混合液的pH值
解:⑴、pH混= pH大-0.3=13-0.3=12.7
⑵、pH混= pH小+0.3=1+0.3=1.3
想一想:强酸强碱混合,混合溶液的pH值怎样计算?
结论:酸碱混合时,先计算过量的c (H+) 或c (OH-)再计算pH
5、强酸强碱混合:
⑴、强酸强碱恰好完全反应,溶液呈中性,混合溶液 pH = 7
⑵、强酸强碱混合酸过量,先求过量的酸的浓度,再求pH
pH=-lg c(H+)余
例:求30mL pH=3的盐酸溶液与20mL pH=11的氢氧化钠溶液反应后溶液的pH
解:∵ c(H+)=10-3 mol / L c(OH-)=10-3 mol / L
pH=-lg 2×10-4 =4-lg2
⑶、强酸强碱混合碱过量,先求过量的碱的浓度,再求pH
pOH=-lg c(OH-)余
pH=14- pOH
或由c(OH-)余
Kw
c(H+)
-lg
pH
练习:求30mL pH=2的硫酸溶液与70mLpH=12的氢氧化钠溶液反应后溶液的pH
判断酸碱等体积混合后溶液酸碱性的规律
1、酸碱的pH之和为14,等体积混合
(1)强酸与强碱混合,则混合后的溶液的pH ;
=7
(2)强酸与弱碱混合,则混合后的溶液的pH ;
>7
理解:
∵由题给pH之和为14,体积又相同,可理解为已电离的部分刚好中和,呈中性。
(3)弱酸与强碱混合,则混合后的溶液的pH ;
<7
弱碱可以继续电离,就呈碱性。
弱酸可以继续电离,就呈酸性。
(1)若pHa + pHb =14,则c(H+) c (OH-),
混合溶液pH ,呈 ;
=
=7
中性
(2)若pHa + pHb <14,则c (H+) C(OH-),
混合溶液pH ,呈 ;
>
<7
酸性
(3)若pHa + pHb >14,则c (H+) c (OH-),
混合溶液pH ,呈 。
<
>7
碱性
2、强酸(pHa、Va)与强碱(pHb、Vb)等体积混合
已知盐酸的体积V1,pH=a;NaOH溶液的体积V2,pH=b。则它们混合后溶液的酸碱性
(1)、当V1=V2时,a+b= ,则混后溶液呈中性,pH=7
(2)、当V1=10V2时(酸多),a+b= ,则混后溶液呈中性,pH=7
(3)、当V2=10V1时(碱多),a+b= ,则混后溶液呈中性,pH=7
3、强酸强碱非等体积混合后溶液的pH
15
14
13
例1:已知室温下等体积的酸和碱溶液混合。则混合后溶液的pH<7是
(A)pH=3的硝酸与pH=11的氢氧化钠溶液
(B)pH=3的盐酸与pH=11的氨水
(C)pH=3的硫酸与pH=11的氢氧化钠溶液
(D)pH=3的醋酸与pH=11的氢氧化钡溶液
D
例2:将XmLpH=a的NaOH溶液与YmLpH=b的盐酸溶液混合。下列关于反应后溶液的pH说法正确的是
(A)X=Y且a+b=14时,混合后pH>7
(B)10X=Y且a+b=13时,混合后pH=7
(C)aX=bY且a+b=13时,混合后pH=7
(D)X=10Y且a+b=14时,混合后pH>7
D
1.有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍
数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强
到弱的顺序是( )
A.HX 、 HY 、 HZ B.HZ 、 HY 、 HX
C.HX 、 HZ 、 HY D.HY 、 HZ 、 HX
B
课堂练习
2.pH=2的A、B两种酸溶液各1mL,分别加水稀释到
1000mL,其pH与溶液体积V的关系如图所示。下列说法
正确的是 ( )
A、B两酸溶液的物质的量浓度一定相等
稀释后,A溶液的酸性比B溶液强
a=5时,A是强酸,B是弱酸
若A、B都是弱酸,则5>a>2
a
7
2
1
pH
V/mL
1000
A
B
CD
3.25℃时,某强酸溶液pH=a,某强碱溶液pH=b,若等体积
混合后.
⑴溶液显中性,a+b满足的关系:___________
⑵溶液显酸性,a+b满足的关系:___________
⑶溶液显碱性,a+b满足的关系:___________
a+b=14
a+b<14
a+b>14
