人教版九年级下册 第十一单元 课题1 第3课时 复分解反应应用(课件)(共61张PPT)
文档属性
| 名称 | 人教版九年级下册 第十一单元 课题1 第3课时 复分解反应应用(课件)(共61张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-17 09:17:19 | ||
图片预览








文档简介
(共61张PPT)
复分解反应的条件
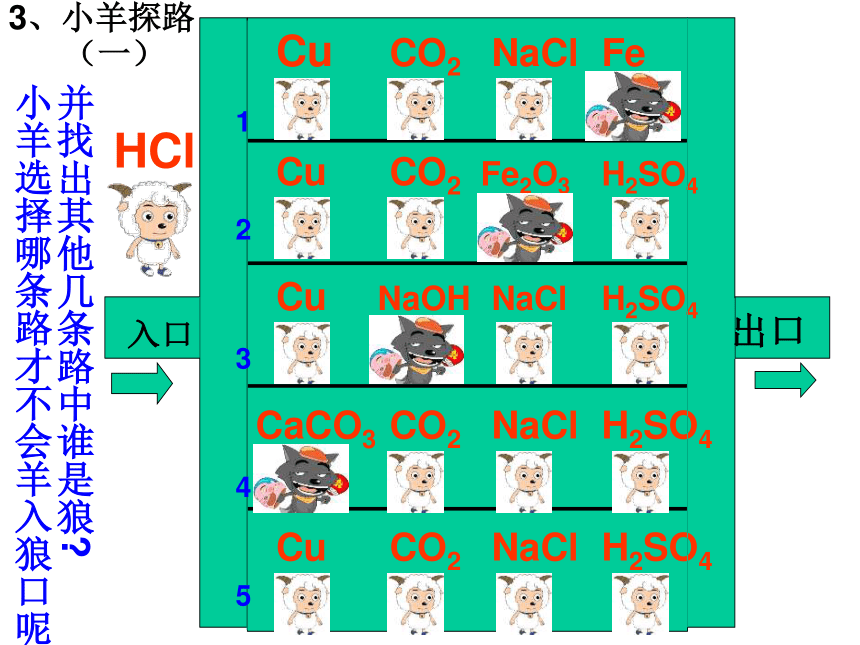
入口
出口
小羊选择哪条路才不会羊入狼口呢?
并找出其他几条路中谁是狼?
3、小羊探路
(一)
5
4
3
2
1
复分解反应
A
+
C
=
B
A
B
D
C
D
+
复分解反应要发生,且能够进行到底,
一般应考虑两方面的条件:
1、考虑反应发生的基本条件
(对反应物要求的条件)
2、对生成物的条件要求
两者缺一不可
问题的提出:
复分解反应包括:
那么酸碱盐之间一定能发生复分解反应吗?
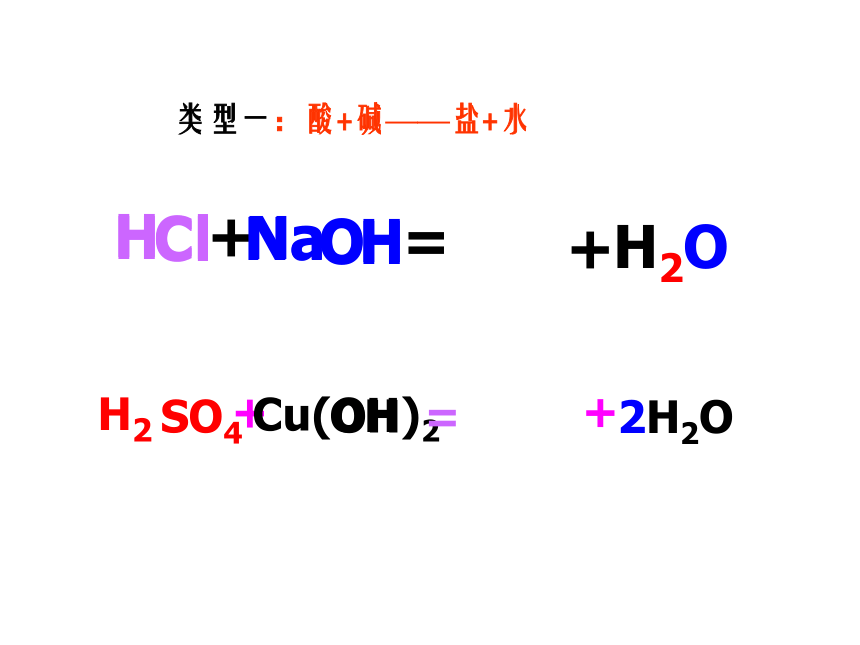
类型一:酸+碱——盐+水
H
Cl
Na
O
H
+
H
Cl
Na
=
+
H2O
+
Cu(OH)2
=
SO4
OH
H2
OH
+
2H2O
酸+碱——盐+水
条件:
(1)酸和碱至少有一种可溶;
(2)若酸是常见的三种强酸,无论碱 是否可溶,反应均可以进行。
三大强酸:盐酸、硫酸、硝酸
酸、碱的溶解规律
酸:初中范围内的酸全溶
碱:钾、钠、钡、铵,四碱
溶,Ca(OH)2微溶,
其余的全不溶。
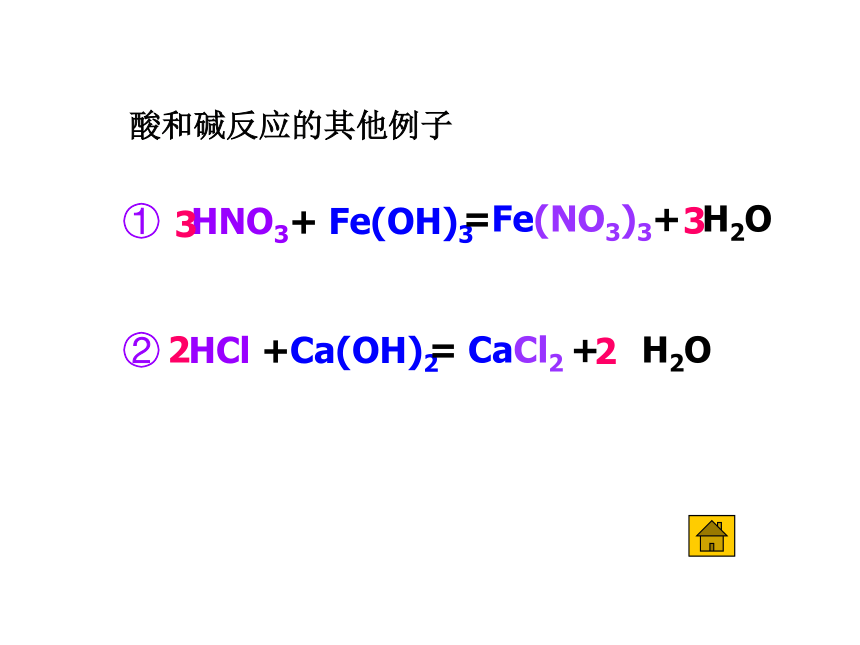
酸和碱反应的其他例子
① HNO3+ Fe(OH)3
② HCl +Ca(OH)2
=Fe(NO3)3+ H2O
3
3
= CaCl2 + H2O
2
2
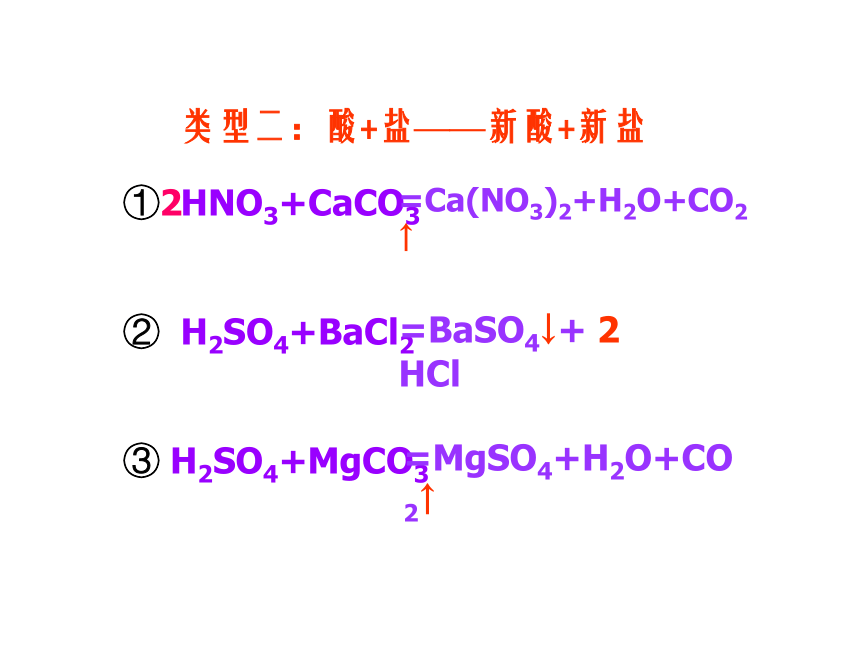
类型二:酸+盐——新酸+新盐
H
Cl
NO3
Ag
=
↓
+
类型二:酸+盐——新酸+新盐
① HNO3+CaCO3
② H2SO4+BaCl2
③ H2SO4+MgCO3
=Ca(NO3)2+H2O+CO2↑
2
=BaSO4↓+ 2 HCl
=MgSO4+H2O+CO2↑
酸+盐——新酸+新盐
条件:
(1)盐除了BaSO4和AgCl外,
其它的盐是否可溶均可以反应;
(2)生成物中有沉淀、气体或水生 成。
盐的溶解性规律
钾盐、钠盐、铵盐、硝酸盐全溶;
盐酸盐(Cl-):除氯化银不溶,其余全溶;
硫酸盐(SO42-):除硫酸钡不溶,硫酸钙、
硫酸银微溶,其余全溶;
碳酸盐(CO32-):除碳酸钾、碳酸钠、
碳酸铵溶,MgCO3微溶,其余不溶。
类型三:碱+盐——新碱+新盐
① NaOH+CaCO3
② Ca(OH)2+K2CO3
③ Al(OH)3+NaCl
④ KOH+CuSO4
=CaCO3 + KOH
=Cu(OH)2 + K2SO4
2
2
↓
↓
碱+盐——新碱+新盐
条件:
(1)反应物中的碱和盐都须能溶
于水;
(2)生成物中至少有一种是沉淀
或生成物中有气体放出。
类型四:盐+盐——新盐+新盐
① KNO3+CaCO3
② BaCl2+K2CO3
③ KCl+AgNO3
④ NaNO3+K2CO3
=BaCO3 + KCl
=AgCl + KNO3
2
↓
↓
盐+盐——新盐+新盐
条件:
(1)参加反应的两种盐都必须可溶;
(2)新生成的两种盐中至少有一种是
沉淀。还应该注意,若反应物中
有一种盐微溶,则生成物中必有
一种盐不溶。
CaSO4+Na2CO3=Na2SO4+CaCO3↓
类型五:酸+金属氧化物=盐+水
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
条件:
(1)酸常用HCl,H2SO4和HNO3;
(2)金属氧化物是否可溶都可以反应。
想一想:
反应物的溶解性如何?
生成物都有什么特点?
1
3
2
4
5
误区扫描
1.盐的组成一定含有金属元素( )
2.加入稀硫酸,有气泡产生,则原物质中一定含有碳酸盐( )
3.盐溶液都显中性( )
×
×
×
素养拓展
向澄清石灰水中通CO2,产生白色沉淀:Ca(OH)2+CO2====CaCO3↓+H2O;继续通CO2,白色沉淀会部分消失:CaCO3+CO2+H2O====Ca(HCO3)2,当溶液受热时,溶解在水里的碳酸氢钙就会分解,放出CO2气体,重新生成碳酸钙沉淀:Ca(HCO3)2====CaCO3↓+CO2↑+H2O?
△
归纳总结
1.酸?碱?盐的溶解性规律?
(1)酸:初中阶段接触到的酸都是溶于水的酸?
(2)碱:常见的碱类只溶“钾?钠?钡?钙?铵”,即KOH?NaOH?Ba(OH)2?Ca(OH)2?NH3·H2O都可溶于水?
(3)盐:钾盐?钠盐?铵盐与硝酸盐都可溶于水;碳酸盐中可溶的只有碳酸钾(K2CO3)?碳酸钠(Na2CO3)和碳酸铵[(NH4)2CO3];AgCl和BaSO4既不溶于水也不溶于酸?
2.常见的沉淀颜色:简记为“五白?一蓝?一红褐”?
(1)白色沉淀:CaCO3?BaCO3?BaSO4?AgCl?Mg(OH)2;
(2)蓝色沉淀:Cu(OH)2;
(3)红褐色沉淀:Fe(OH)3?
1.表达式:AB+CD→AD+CB
(1)特点:化合物两交换,化合价不变?
(2)实质, __________互相结合,生成水?气体或沉淀,使反应后溶液中的__________减少或消失了?
(3)条件:必须有__________或__________或__________生成?
1.物质共存的条件
(1)组内的物质必须均可溶?
(2)在同一溶液中,各物质(即所含的离子)之间不发生反应,即不生成沉淀或气体或水?
3.一定条件下不能共存的物质(或离子)
(1)酸碱性条件
①pH>7(或碱性条件),则溶液中一定含有OH-
②pH<7(或酸性条件),则溶液中一定含有H+,
(2)颜色条件
①蓝色溶液:含Cu2+的溶液,如CuSO4?CuCl2?Cu(NO3)2溶液?
②黄色溶液:含Fe3+的溶液,如Fe2(SO4)3?FeCl3?Fe(NO3)3溶液?
③浅绿色溶液:含Fe2+的溶液,如FeSO4?FeCl2?Fe(NO3)2溶液?
④★紫红色溶液:含MnO4-的溶液,如KMnO4溶液?中考常考“无色”溶液中离子共存情况,即该溶液中不存在Cu2+?Fe3+?Fe2+?MnO4-或含这些离子的物质?
规律总结
常见不能共存的离子
不共存的离子 原因 形成的物质
Ca2+?CO32- 生成
沉淀 CaCO3
Ba2+?CO32- BaCO3
Ba2+?SO42- BaSO4
Mg2+?OH- Mg(OH)2
Fe2+?OH- Fe(OH)2
Fe3+?OH- Fe(OH)3
Cu2+?OH- Cu(OH)2
Al3+?OH- Al(OH)3
Ag+?Cl- AgCl
不共存的离子 原因 形成的物质
H+?OH- 生成H2O H2O
H+?CO32- 生成H2O和CO2 H2O+CO2
H+?HCO3- H2O+CO2
NH4+?OH- 生成H2O和NH3 H2O+NH3
考法 聚焦重难点
典例1 下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A.Cu2+?H+?SO42-?Cl-
B.Ba2+?Na+?Cl-?NO3-
C.K+?Ca2+?OH-?CO32-
D.Na+?H+?HCO3-?NO3-
1.蒸馒头时,在发酵面团中加入某种物质,既能除去面团中的酸又能使馒头松软,该物质是( )
A.氢氧化钠
B.生石灰
C.碳酸氢钠
D.氯化钠
2.下列各组物质的溶液相互反应后不产生沉淀的是( )
A.BaCl2?H2SO4
B.NaCl?AgNO3
C.Na2CO3?HCl
D.Na2CO3?Ca(OH)2
3.可以与氢氧化钠共存于同一溶液的是( )
A.CuSO4?NaNO3
B.Na2CO3?KCl
C.NaCl?FeCl3
D.Na2SO4?HCl
复分解反应的应用
复习:不能共存的离子 复分解反应的定义、条件、实质
本节课学习内容:
1.判断反应是否能够发生
2.离子共存问题
3.解决一步完成题
4.解决除杂题
5. 解决鉴别题
6.. …… …… …… ……
下列物质能发生化学反应吗?为什么?
1、CuO+2NaOH= Cu(OH)2 ↓ +Na2O
2、SO2+HNO3=NO2 + H2SO3
3、2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓
4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl
5、Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑
6、 NaOH+CO=
7、NaOH+BaCl2= Ba(OH)2+NaCl
8、2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2
我要记住:
判断下列物质能否反应,能反应的写出化学方程式:
HCl 和 Fe
①
②
H2SO4和Cu
( )
( )
③
AgNO3和Cu
( )
④
AgCl和 Fe
( )
⑤
ZnSO4和 Fe
( )
⑥
NaOH和KCl
( )
⑦
H2SO4和NaOH
( )
⑧
Fe(OH)3和HCl
( )
判断下列各组离子能否共存:
①Cu2+ Na+ SO42- OH-
② Na+ SO42- Cl- Ba2+
③ H+ NO3- CO32- Na+
④ SO42- H+ Na+ OH-
⑤ Na+ Ba2+ NO3- CO32-
⑥Zn2+ SO42- Fe3+ Cl-
⑦Mg2+ NO3- Ba2+ OH-
⑧ k+ NO3- NO3- SO42-
( )
( )
( )
( )
( )
( )
( )
( )
下列物质在水溶液中能大量共存的是( )
A.HCl、Ca(OH)2、NaNO3 B.NaCl、K2CO3、H2SO4
C.HCl、BaCl2、CuSO4 D.KNO3、NaOH、Na2CO3
下列物质在水溶液中能大量共存的是( )
A.HCl、Ca(OH)2、NaNO3 B.NaCl、K2CO3、H2SO4
C.HCl、BaCl2、CuSO4 D.KNO3、NaOH、Na2CO3
(2012·佛山)在水溶液中能大量共存,且溶液为无色透明的一组物质是( )
A.CaCl2、Na2CO3、KNO3 B.NaNO3、FeCl3、HCl
C.NaCl、Ba(NO3)2、NaOH D.(NH) 2SO4、NaOH、Na2CO3
在水溶液中能大量共存,且溶液为无色透明的一组物质是( )
A.CaCl2、Na2CO3、KNO3 B.NaNO3、FeCl3、HCl
C.NaCl、Ba(NO3)2、NaOH D.(NH) 2SO4、NaOH、Na2CO3
下列溶液无色,在pH=1时能大量共存的是 ( )
A.CuSO4 NaCl KNO3
B.NaOH NaCl NaNO3
C.Na2SO4 NH4Cl ZnCl2
D.K2SO4 AgNO3 NaCl
(2011.河南省)能在pH为13的溶液中大量共存,且溶液为五色透明的一组物质是 ( )
A.FeCl3、CuSO4、NaCI
B.BaCI2、Na2SO4、HCI
C.CaCl2、Na2CO3、AgNO3
D.K2SO4、NaNO3、NaCl
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
( )
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
(
)
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
(
)
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
(
)
下列物质间的转化不能通过一步反应直接实现的是 ( )
A. NaNO3 →NaCl
B. CuSO4→FeSO4
C. Ca(OH)2 →NaOH D.CuO→Cu(OH)2
(2012.乐山市)下列物质间的每一转化不能都通过一步反应实现的是 ( )
A.CuO→Cu→CuO
B.NaOH→H2O→NaOH
C. Fe→FeCl2→Fe D.O2→Fe3O4→O2
(2011.南昌市)下列物质的转变,不能一步实现的是 ( )
A.KCl → KNO3
B. Fe(NO3)2 →AgNO3
C.SO3 → Na2SO4
D.H2→Cu
11宜宾除去下列物质中的杂质所选用试剂或操作方法
不正确的一组是 ( )
高温
用浓硫酸
思考:适量改为过量
物质 所含杂质 除去杂质的试剂或方法
A CaO CaCO3 HCl
B CuO Cu 灼烧
C NaOH
溶液 Na2CO3 适量Ca(OH)2溶液、过滤
D O2 H2O 干燥
为除去下表物质中的杂质,所选试剂(过量)及操作方法错误的是( )
选项 物质(杂质) 试剂 方法
A Cu(Fe) 稀硫酸 过滤
B CO(CO2 ) 点燃
C NaCl(Na2CO3) 盐酸 过滤
D FeSO4(CuSO4) 铁屑 过滤
食盐水与碳酸钠
烧碱溶液与石灰水
请鉴别下列物质
氯化钡或氢氧化钡或石蕊溶液 稀盐酸
碳酸钠或碳酸钾溶液或通入二氧化碳气体
解题关键:找出被鉴别的物质在组成或性质上的差异
NaCl Na2CO3
NaOH Ca(OH)2
下列鉴别物质的方法中,错误的是 ( )
A.用燃着的木条鉴别氧气和二氧化碳
B.用酚酞试液鉴别稀盐酸和稀硫酸
C.用水鉴别碳酸钙粉末和碳酸钠粉末
D.用灼烧的方法鉴别棉布和丝绸
3.不用另加试剂
(1)特征现象法
例5.(10·黄石)不用其它试剂,仅仅利用试管和胶头滴管就可以区别下列四种物质的溶液:①CuSO4;②MgCl2;③KOH;④NaNO3,则正确的鉴别顺序是( )
A.②③①④ B. ①②③④
C.①③②④ D. ②①③④
C
2.下列物质的溶液,不另加其他试剂能否 一一鉴别出来。
(1) CuSO4 、 HCl 、 NaOH 、 KNO3
①
②
③
④
(2)MgSO4、 NaOH、 HNO3、 BaCl2
例1、有4瓶失去标签的溶液,它们分别是:
① ②KCl ③Ba(OH)2 ④Na2SO4
不用其他试剂,利用它们之间相互反应,将其检验出来的顺序是( )
A、①③②④ B、①③④②
C、①②③④ D、①④③②
Fe2(SO4)3
Fe(OH)3 ↓ BaSO4 ↓
BaSO4↓
B
不添加试剂鉴别
突破口:先找有色溶液,再利用已鉴别的物质鉴别其它
(2012.乐山市)下列各组物质的溶液不用其它试剂就可鉴别的是 ( )
A.HCl CuSO4 KNO3 Na2SO4
B.FeCl3 HCl NaCl NaOH
C.CaCl2 K2CO3 HCl (NH4)2CO3
D.NaNO3 Na2SO4 HCI H2SO4
B
①
①
②
③
③
4、酸+碱→盐+水
3、酸+金属氧化物→盐+水
5、酸+(某些)盐→新酸+新盐
1、酸与指示剂作用:使紫色石蕊试液变红,使无色酚酞试液不变色
2、酸+活泼金属→盐+H2
⑴蓝 色 溶 液——
⑵黄 色 溶 液——
⑶蓝色不溶物——
⑷红褐色不溶物——
⑸白色不溶物——
⑹打开盛液体的瓶盖出现白雾的是——
⑺片状白色固体露置在空气中潮解的是——
⑻黑色粉末——
⑼红色粉末——
⑽红色光亮的金属——
⑾溶于水产生大量热——
BaSO4、AgCl、BaCO3、CaCO3、Mg(OH)2
NaOH
浓H2SO4、CaO等
CuSO4
FeCl3
Cu(OH)2
Fe(OH)3
浓盐酸
CuO、MnO2、C
Fe2O3
Cu
1物质的颜色
(10·镇江)下列各组溶液,不加其它试剂就能鉴别的是( )
A.NaOH、NaCl、MgCl2、FeCl3
B.Na2CO3、稀H2SO4、稀HCl、NaNO3
C.Na2SO4、BaCl2、KNO3、NaCl
D.K2SO4、Na2CO3、BaCl2、稀HNO3
A D
①
②
③
④
关键:选择具有不同的明显现象
复分解反应的条件
入口
出口
小羊选择哪条路才不会羊入狼口呢?
并找出其他几条路中谁是狼?
3、小羊探路
(一)
5
4
3
2
1
复分解反应
A
+
C
=
B
A
B
D
C
D
+
复分解反应要发生,且能够进行到底,
一般应考虑两方面的条件:
1、考虑反应发生的基本条件
(对反应物要求的条件)
2、对生成物的条件要求
两者缺一不可
问题的提出:
复分解反应包括:
那么酸碱盐之间一定能发生复分解反应吗?
类型一:酸+碱——盐+水
H
Cl
Na
O
H
+
H
Cl
Na
=
+
H2O
+
Cu(OH)2
=
SO4
OH
H2
OH
+
2H2O
酸+碱——盐+水
条件:
(1)酸和碱至少有一种可溶;
(2)若酸是常见的三种强酸,无论碱 是否可溶,反应均可以进行。
三大强酸:盐酸、硫酸、硝酸
酸、碱的溶解规律
酸:初中范围内的酸全溶
碱:钾、钠、钡、铵,四碱
溶,Ca(OH)2微溶,
其余的全不溶。
酸和碱反应的其他例子
① HNO3+ Fe(OH)3
② HCl +Ca(OH)2
=Fe(NO3)3+ H2O
3
3
= CaCl2 + H2O
2
2
类型二:酸+盐——新酸+新盐
H
Cl
NO3
Ag
=
↓
+
类型二:酸+盐——新酸+新盐
① HNO3+CaCO3
② H2SO4+BaCl2
③ H2SO4+MgCO3
=Ca(NO3)2+H2O+CO2↑
2
=BaSO4↓+ 2 HCl
=MgSO4+H2O+CO2↑
酸+盐——新酸+新盐
条件:
(1)盐除了BaSO4和AgCl外,
其它的盐是否可溶均可以反应;
(2)生成物中有沉淀、气体或水生 成。
盐的溶解性规律
钾盐、钠盐、铵盐、硝酸盐全溶;
盐酸盐(Cl-):除氯化银不溶,其余全溶;
硫酸盐(SO42-):除硫酸钡不溶,硫酸钙、
硫酸银微溶,其余全溶;
碳酸盐(CO32-):除碳酸钾、碳酸钠、
碳酸铵溶,MgCO3微溶,其余不溶。
类型三:碱+盐——新碱+新盐
① NaOH+CaCO3
② Ca(OH)2+K2CO3
③ Al(OH)3+NaCl
④ KOH+CuSO4
=CaCO3 + KOH
=Cu(OH)2 + K2SO4
2
2
↓
↓
碱+盐——新碱+新盐
条件:
(1)反应物中的碱和盐都须能溶
于水;
(2)生成物中至少有一种是沉淀
或生成物中有气体放出。
类型四:盐+盐——新盐+新盐
① KNO3+CaCO3
② BaCl2+K2CO3
③ KCl+AgNO3
④ NaNO3+K2CO3
=BaCO3 + KCl
=AgCl + KNO3
2
↓
↓
盐+盐——新盐+新盐
条件:
(1)参加反应的两种盐都必须可溶;
(2)新生成的两种盐中至少有一种是
沉淀。还应该注意,若反应物中
有一种盐微溶,则生成物中必有
一种盐不溶。
CaSO4+Na2CO3=Na2SO4+CaCO3↓
类型五:酸+金属氧化物=盐+水
Fe2O3+6HCl=2FeCl3+3H2O
CuO+H2SO4=CuSO4+H2O
条件:
(1)酸常用HCl,H2SO4和HNO3;
(2)金属氧化物是否可溶都可以反应。
想一想:
反应物的溶解性如何?
生成物都有什么特点?
1
3
2
4
5
误区扫描
1.盐的组成一定含有金属元素( )
2.加入稀硫酸,有气泡产生,则原物质中一定含有碳酸盐( )
3.盐溶液都显中性( )
×
×
×
素养拓展
向澄清石灰水中通CO2,产生白色沉淀:Ca(OH)2+CO2====CaCO3↓+H2O;继续通CO2,白色沉淀会部分消失:CaCO3+CO2+H2O====Ca(HCO3)2,当溶液受热时,溶解在水里的碳酸氢钙就会分解,放出CO2气体,重新生成碳酸钙沉淀:Ca(HCO3)2====CaCO3↓+CO2↑+H2O?
△
归纳总结
1.酸?碱?盐的溶解性规律?
(1)酸:初中阶段接触到的酸都是溶于水的酸?
(2)碱:常见的碱类只溶“钾?钠?钡?钙?铵”,即KOH?NaOH?Ba(OH)2?Ca(OH)2?NH3·H2O都可溶于水?
(3)盐:钾盐?钠盐?铵盐与硝酸盐都可溶于水;碳酸盐中可溶的只有碳酸钾(K2CO3)?碳酸钠(Na2CO3)和碳酸铵[(NH4)2CO3];AgCl和BaSO4既不溶于水也不溶于酸?
2.常见的沉淀颜色:简记为“五白?一蓝?一红褐”?
(1)白色沉淀:CaCO3?BaCO3?BaSO4?AgCl?Mg(OH)2;
(2)蓝色沉淀:Cu(OH)2;
(3)红褐色沉淀:Fe(OH)3?
1.表达式:AB+CD→AD+CB
(1)特点:化合物两交换,化合价不变?
(2)实质, __________互相结合,生成水?气体或沉淀,使反应后溶液中的__________减少或消失了?
(3)条件:必须有__________或__________或__________生成?
1.物质共存的条件
(1)组内的物质必须均可溶?
(2)在同一溶液中,各物质(即所含的离子)之间不发生反应,即不生成沉淀或气体或水?
3.一定条件下不能共存的物质(或离子)
(1)酸碱性条件
①pH>7(或碱性条件),则溶液中一定含有OH-
②pH<7(或酸性条件),则溶液中一定含有H+,
(2)颜色条件
①蓝色溶液:含Cu2+的溶液,如CuSO4?CuCl2?Cu(NO3)2溶液?
②黄色溶液:含Fe3+的溶液,如Fe2(SO4)3?FeCl3?Fe(NO3)3溶液?
③浅绿色溶液:含Fe2+的溶液,如FeSO4?FeCl2?Fe(NO3)2溶液?
④★紫红色溶液:含MnO4-的溶液,如KMnO4溶液?中考常考“无色”溶液中离子共存情况,即该溶液中不存在Cu2+?Fe3+?Fe2+?MnO4-或含这些离子的物质?
规律总结
常见不能共存的离子
不共存的离子 原因 形成的物质
Ca2+?CO32- 生成
沉淀 CaCO3
Ba2+?CO32- BaCO3
Ba2+?SO42- BaSO4
Mg2+?OH- Mg(OH)2
Fe2+?OH- Fe(OH)2
Fe3+?OH- Fe(OH)3
Cu2+?OH- Cu(OH)2
Al3+?OH- Al(OH)3
Ag+?Cl- AgCl
不共存的离子 原因 形成的物质
H+?OH- 生成H2O H2O
H+?CO32- 生成H2O和CO2 H2O+CO2
H+?HCO3- H2O+CO2
NH4+?OH- 生成H2O和NH3 H2O+NH3
考法 聚焦重难点
典例1 下列各组离子在水中一定能大量共存,并形成无色溶液的是( )
A.Cu2+?H+?SO42-?Cl-
B.Ba2+?Na+?Cl-?NO3-
C.K+?Ca2+?OH-?CO32-
D.Na+?H+?HCO3-?NO3-
1.蒸馒头时,在发酵面团中加入某种物质,既能除去面团中的酸又能使馒头松软,该物质是( )
A.氢氧化钠
B.生石灰
C.碳酸氢钠
D.氯化钠
2.下列各组物质的溶液相互反应后不产生沉淀的是( )
A.BaCl2?H2SO4
B.NaCl?AgNO3
C.Na2CO3?HCl
D.Na2CO3?Ca(OH)2
3.可以与氢氧化钠共存于同一溶液的是( )
A.CuSO4?NaNO3
B.Na2CO3?KCl
C.NaCl?FeCl3
D.Na2SO4?HCl
复分解反应的应用
复习:不能共存的离子 复分解反应的定义、条件、实质
本节课学习内容:
1.判断反应是否能够发生
2.离子共存问题
3.解决一步完成题
4.解决除杂题
5. 解决鉴别题
6.. …… …… …… ……
下列物质能发生化学反应吗?为什么?
1、CuO+2NaOH= Cu(OH)2 ↓ +Na2O
2、SO2+HNO3=NO2 + H2SO3
3、2Fe(OH)3+3MgCl2=2FeCl3+3Mg (OH)2 ↓
4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl
5、Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑
6、 NaOH+CO=
7、NaOH+BaCl2= Ba(OH)2+NaCl
8、2NaCl+Cu(NO 3) 2= 2Na NO3+CuCl2
我要记住:
判断下列物质能否反应,能反应的写出化学方程式:
HCl 和 Fe
①
②
H2SO4和Cu
( )
( )
③
AgNO3和Cu
( )
④
AgCl和 Fe
( )
⑤
ZnSO4和 Fe
( )
⑥
NaOH和KCl
( )
⑦
H2SO4和NaOH
( )
⑧
Fe(OH)3和HCl
( )
判断下列各组离子能否共存:
①Cu2+ Na+ SO42- OH-
② Na+ SO42- Cl- Ba2+
③ H+ NO3- CO32- Na+
④ SO42- H+ Na+ OH-
⑤ Na+ Ba2+ NO3- CO32-
⑥Zn2+ SO42- Fe3+ Cl-
⑦Mg2+ NO3- Ba2+ OH-
⑧ k+ NO3- NO3- SO42-
( )
( )
( )
( )
( )
( )
( )
( )
下列物质在水溶液中能大量共存的是( )
A.HCl、Ca(OH)2、NaNO3 B.NaCl、K2CO3、H2SO4
C.HCl、BaCl2、CuSO4 D.KNO3、NaOH、Na2CO3
下列物质在水溶液中能大量共存的是( )
A.HCl、Ca(OH)2、NaNO3 B.NaCl、K2CO3、H2SO4
C.HCl、BaCl2、CuSO4 D.KNO3、NaOH、Na2CO3
(2012·佛山)在水溶液中能大量共存,且溶液为无色透明的一组物质是( )
A.CaCl2、Na2CO3、KNO3 B.NaNO3、FeCl3、HCl
C.NaCl、Ba(NO3)2、NaOH D.(NH) 2SO4、NaOH、Na2CO3
在水溶液中能大量共存,且溶液为无色透明的一组物质是( )
A.CaCl2、Na2CO3、KNO3 B.NaNO3、FeCl3、HCl
C.NaCl、Ba(NO3)2、NaOH D.(NH) 2SO4、NaOH、Na2CO3
下列溶液无色,在pH=1时能大量共存的是 ( )
A.CuSO4 NaCl KNO3
B.NaOH NaCl NaNO3
C.Na2SO4 NH4Cl ZnCl2
D.K2SO4 AgNO3 NaCl
(2011.河南省)能在pH为13的溶液中大量共存,且溶液为五色透明的一组物质是 ( )
A.FeCl3、CuSO4、NaCI
B.BaCI2、Na2SO4、HCI
C.CaCl2、Na2CO3、AgNO3
D.K2SO4、NaNO3、NaCl
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
( )
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
(
)
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
(
)
下列物质间的转化,不能一步实现的是
A.Fe(OH)3 → FeCl3
B.CO2→ CaCO3
C.KNO3 → KCl
D.CaO → CaCl2
(
)
下列物质间的转化不能通过一步反应直接实现的是 ( )
A. NaNO3 →NaCl
B. CuSO4→FeSO4
C. Ca(OH)2 →NaOH D.CuO→Cu(OH)2
(2012.乐山市)下列物质间的每一转化不能都通过一步反应实现的是 ( )
A.CuO→Cu→CuO
B.NaOH→H2O→NaOH
C. Fe→FeCl2→Fe D.O2→Fe3O4→O2
(2011.南昌市)下列物质的转变,不能一步实现的是 ( )
A.KCl → KNO3
B. Fe(NO3)2 →AgNO3
C.SO3 → Na2SO4
D.H2→Cu
11宜宾除去下列物质中的杂质所选用试剂或操作方法
不正确的一组是 ( )
高温
用浓硫酸
思考:适量改为过量
物质 所含杂质 除去杂质的试剂或方法
A CaO CaCO3 HCl
B CuO Cu 灼烧
C NaOH
溶液 Na2CO3 适量Ca(OH)2溶液、过滤
D O2 H2O 干燥
为除去下表物质中的杂质,所选试剂(过量)及操作方法错误的是( )
选项 物质(杂质) 试剂 方法
A Cu(Fe) 稀硫酸 过滤
B CO(CO2 ) 点燃
C NaCl(Na2CO3) 盐酸 过滤
D FeSO4(CuSO4) 铁屑 过滤
食盐水与碳酸钠
烧碱溶液与石灰水
请鉴别下列物质
氯化钡或氢氧化钡或石蕊溶液 稀盐酸
碳酸钠或碳酸钾溶液或通入二氧化碳气体
解题关键:找出被鉴别的物质在组成或性质上的差异
NaCl Na2CO3
NaOH Ca(OH)2
下列鉴别物质的方法中,错误的是 ( )
A.用燃着的木条鉴别氧气和二氧化碳
B.用酚酞试液鉴别稀盐酸和稀硫酸
C.用水鉴别碳酸钙粉末和碳酸钠粉末
D.用灼烧的方法鉴别棉布和丝绸
3.不用另加试剂
(1)特征现象法
例5.(10·黄石)不用其它试剂,仅仅利用试管和胶头滴管就可以区别下列四种物质的溶液:①CuSO4;②MgCl2;③KOH;④NaNO3,则正确的鉴别顺序是( )
A.②③①④ B. ①②③④
C.①③②④ D. ②①③④
C
2.下列物质的溶液,不另加其他试剂能否 一一鉴别出来。
(1) CuSO4 、 HCl 、 NaOH 、 KNO3
①
②
③
④
(2)MgSO4、 NaOH、 HNO3、 BaCl2
例1、有4瓶失去标签的溶液,它们分别是:
① ②KCl ③Ba(OH)2 ④Na2SO4
不用其他试剂,利用它们之间相互反应,将其检验出来的顺序是( )
A、①③②④ B、①③④②
C、①②③④ D、①④③②
Fe2(SO4)3
Fe(OH)3 ↓ BaSO4 ↓
BaSO4↓
B
不添加试剂鉴别
突破口:先找有色溶液,再利用已鉴别的物质鉴别其它
(2012.乐山市)下列各组物质的溶液不用其它试剂就可鉴别的是 ( )
A.HCl CuSO4 KNO3 Na2SO4
B.FeCl3 HCl NaCl NaOH
C.CaCl2 K2CO3 HCl (NH4)2CO3
D.NaNO3 Na2SO4 HCI H2SO4
B
①
①
②
③
③
4、酸+碱→盐+水
3、酸+金属氧化物→盐+水
5、酸+(某些)盐→新酸+新盐
1、酸与指示剂作用:使紫色石蕊试液变红,使无色酚酞试液不变色
2、酸+活泼金属→盐+H2
⑴蓝 色 溶 液——
⑵黄 色 溶 液——
⑶蓝色不溶物——
⑷红褐色不溶物——
⑸白色不溶物——
⑹打开盛液体的瓶盖出现白雾的是——
⑺片状白色固体露置在空气中潮解的是——
⑻黑色粉末——
⑼红色粉末——
⑽红色光亮的金属——
⑾溶于水产生大量热——
BaSO4、AgCl、BaCO3、CaCO3、Mg(OH)2
NaOH
浓H2SO4、CaO等
CuSO4
FeCl3
Cu(OH)2
Fe(OH)3
浓盐酸
CuO、MnO2、C
Fe2O3
Cu
1物质的颜色
(10·镇江)下列各组溶液,不加其它试剂就能鉴别的是( )
A.NaOH、NaCl、MgCl2、FeCl3
B.Na2CO3、稀H2SO4、稀HCl、NaNO3
C.Na2SO4、BaCl2、KNO3、NaCl
D.K2SO4、Na2CO3、BaCl2、稀HNO3
A D
①
②
③
④
关键:选择具有不同的明显现象
同课章节目录
