人教版高一化学必修2课件:2.2《化学能与电能》(共28张PPT)
文档属性
| 名称 | 人教版高一化学必修2课件:2.2《化学能与电能》(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-17 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第二节 化学能与电能
教学重点:原电池的构成条件及工作原理
教学难点:原电池的工作原理
教学目标
1、知识与技能:
了解原电池的概念、工作原理、构成条件;初步养成学生利用实验进行科学探究的能力。
2、过程与方法:
通过模拟动画、实验探究原电池的形成及原理,充分运用观察法、实验法、归纳法、对比法等方法。
3、情感态度与价值观:
通过对火力发电和原电池的学习,感受化学给社会带来的进步和文明,激发学生学习兴趣。
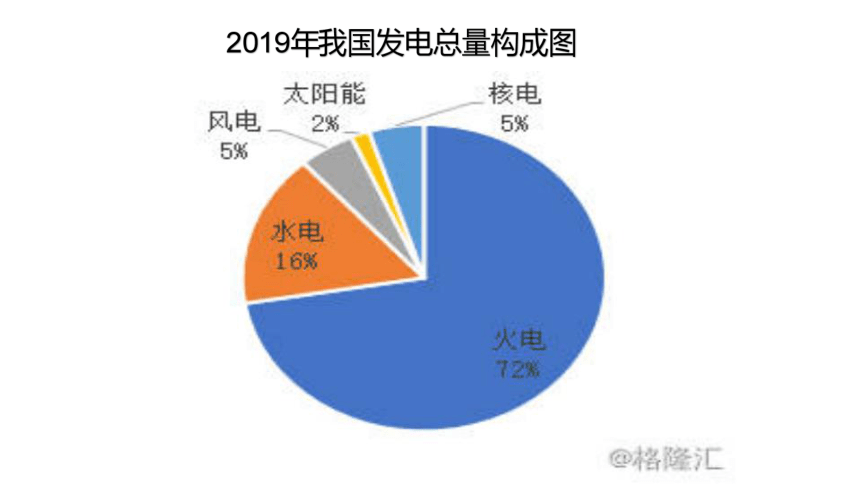
2019年我国发电总量构成图
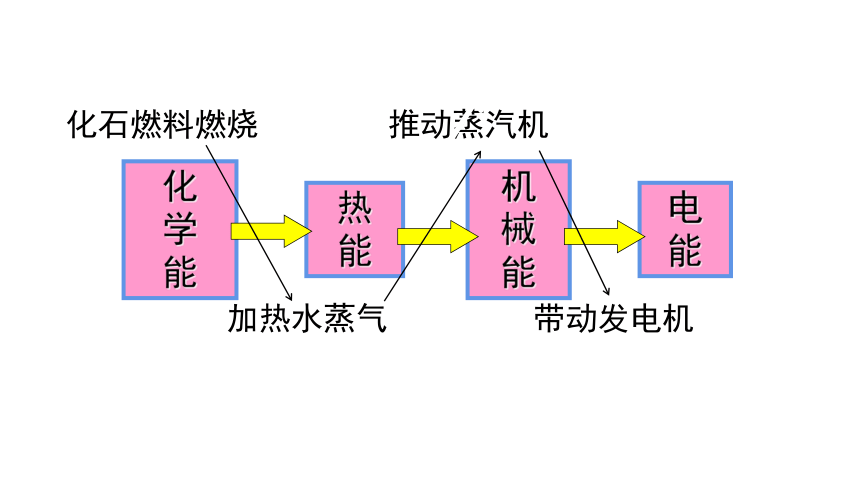
化石燃料燃烧 推动蒸汽机
加热水蒸气 带动发电机
化
学
能
热
能
机
械
能
电
能
目前大规模使用的火力发电有何优点,
有何缺点?
想一想
火力发电的优点:投资较少,建厂快,
技术成熟,安全性能较高,原料较充分。
火力发电的弊病:对环境污染较重,
所需原料是有限的不可再生的化石燃料,
能源利用率低。
化石燃料燃烧 推动蒸汽机
加热水蒸气 带动发电机
化
学
能
热
能
机
械
能
电
能
?
能否找到一种装置将化学能
直接转化为电能呢?
①、将Zn片和Cu片分别插入稀硫酸中
②、将Zn片和Cu片平行插入同一稀硫酸
中
实验探究一
③、将Zn片和Cu片用导线相连插入同一
稀硫酸中
④、将Zn片和Cu片用导线与电流表相连
插入同一稀硫酸中
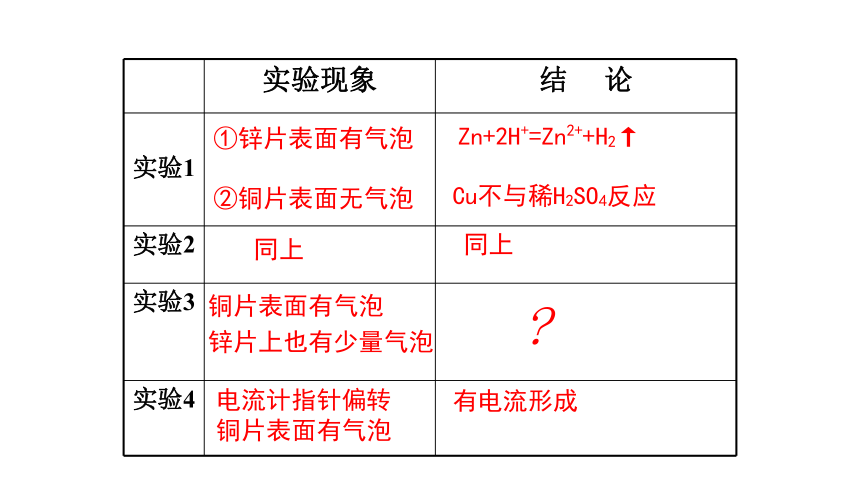
实验现象 结 论
实验1
实验2
实验3
实验4
①锌片表面有气泡
②铜片表面无气泡
同上
铜片表面有气泡
锌片上也有少量气泡
电流计指针偏转铜片表面有气泡
Zn+2H+=Zn2++H2↑
Cu不与稀H2SO4反应
同上
有电流形成
?
反应过程中,有没有能量转化?如何转化?
想一想
化学能 电能
装置
原电池
1.概念:
将化学能转变为电能的装置叫做原电池
一、原电池
A
Zn
Cu
SO42-
H+
H+
实验探究二:构成原电池,需要哪些条件?
第一组实验
构成条件一:必须形成闭合回路
构成条件二:电极需插进电解质溶液中
第二组实验
实验探究二:构成原电池的条件
实验探究二:构成原电池的条件
构成条件三:有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
第三组实验
2.构成原电池的条件
⑶ 有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
⑵ 两电极需插入电解质溶液
请判断下列各装置是否是原电池?为什么?
⑴ 形成闭合回路
Zn
A
Zn
SO42-
H+
H+
A
Zn
SO42-
H+
H+
C
A
Zn
Cu
煤油
SO42-
H+
H+
SO42—
Zn
H+
H+
Cu
A
(x)
(x)
(√)
(x)
A
Zn
SO42-
H+
H+
木条
(x)
科学探究三:思考与交流
讨论一:实验4中铜片上产生了气体(H2),那么H+得到的电子是铜失去的还是锌失去的?如何检验?请小组讨论设计实验方案。 (提示:铜失电子之后生成Cu2+ ,锌失电子之后生成Zn2+ )
方案1:称量实验前后铜片或锌片的质量。
方案2:观察溶液的颜色,看有无Cu2+生成
失电子,发生氧化反应
得电子,发生还原反应
氧化还原反应
原电池的实质:
3、原电池工作原理:
⑴、电极反应:
锌片(负极):
Zn - 2e- = Zn2+
铜片(正极):
2H+ + 2e- = H2 ↑
⑵、电池反应:
Zn + 2H+ = Zn2+ + H2↑
讨论二:我们知道电池有正、负极之分,根据物理学的知识,如何确定Cu、Zn、稀硫酸组成原电池的正、负极?
Cu-Zn原电池
正负极的判断和电荷移动
相对活泼金属作负极,不活泼金属或非金属材料作正极。
外电路:电子由负极→正极
内电路:阴离子移向负极;
阳离子移向正极。
小结
间接:
直接:
化学能
燃烧
热能
蒸汽
机械能
发动机
电能
装置
原电池
概
念
构成条件
工作原理
化学能与电能
练习:1.下列装置是不是原电池?若是,指出正负极。
(1)
(2)
2.请根据反应 Fe + Cu2+ = Fe2++ Cu
设计原电池,有哪些可行方案?
负极:
正极:
电解质溶液:
Fe
比Fe不活泼的金属或石墨
CuSO4、CuCl2等
纽扣电池
蓄电池
笔记本电池
发展中的化学电池
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。在你的生活和学习中,你了解哪些电池?哪些电器使用电池?
1号电池
5号锂电池
7号电池
太阳能电池
手机电池
干电池——锌锰电池
电极反应式:
负极:Zn-2e-=Zn2+
正极:2NH4+ + 2e- = 2NH3↑+H2 ↑
2MnO2 +H2 = Mn2O3 + H2O
Zn2+ + 4NH3 = [Zn(NH3)4]2+
特点:
1.一次性电池; 2.放电时,锌外壳逐渐变薄;
3.放置过久,也会失效; 4.内部反应是不可逆的。
充电电池——二次电池
负极:Pb – 2e- + SO42- = PbSO4
极正:PbO2 + 2e- + 4H+ + SO42- = PbSO4+2H2O
总反应式:Pb + PbO2+ 2H2SO4 = 2PbSO4 + 2H2O
充电电池的优点:
1.更经久耐用,更方便实惠;
2.节约资源,减少废电池的处理量。
化学能 电能
放电
充电
燃料电池
正极:O2 + 4e- + 2H2O = 4OH-
负极:2H2 – 4e- + 4OH- = 4H2O
总反应式:2H2 + O2 = 2H2O
谢谢
第二节 化学能与电能
教学重点:原电池的构成条件及工作原理
教学难点:原电池的工作原理
教学目标
1、知识与技能:
了解原电池的概念、工作原理、构成条件;初步养成学生利用实验进行科学探究的能力。
2、过程与方法:
通过模拟动画、实验探究原电池的形成及原理,充分运用观察法、实验法、归纳法、对比法等方法。
3、情感态度与价值观:
通过对火力发电和原电池的学习,感受化学给社会带来的进步和文明,激发学生学习兴趣。
2019年我国发电总量构成图
化石燃料燃烧 推动蒸汽机
加热水蒸气 带动发电机
化
学
能
热
能
机
械
能
电
能
目前大规模使用的火力发电有何优点,
有何缺点?
想一想
火力发电的优点:投资较少,建厂快,
技术成熟,安全性能较高,原料较充分。
火力发电的弊病:对环境污染较重,
所需原料是有限的不可再生的化石燃料,
能源利用率低。
化石燃料燃烧 推动蒸汽机
加热水蒸气 带动发电机
化
学
能
热
能
机
械
能
电
能
?
能否找到一种装置将化学能
直接转化为电能呢?
①、将Zn片和Cu片分别插入稀硫酸中
②、将Zn片和Cu片平行插入同一稀硫酸
中
实验探究一
③、将Zn片和Cu片用导线相连插入同一
稀硫酸中
④、将Zn片和Cu片用导线与电流表相连
插入同一稀硫酸中
实验现象 结 论
实验1
实验2
实验3
实验4
①锌片表面有气泡
②铜片表面无气泡
同上
铜片表面有气泡
锌片上也有少量气泡
电流计指针偏转铜片表面有气泡
Zn+2H+=Zn2++H2↑
Cu不与稀H2SO4反应
同上
有电流形成
?
反应过程中,有没有能量转化?如何转化?
想一想
化学能 电能
装置
原电池
1.概念:
将化学能转变为电能的装置叫做原电池
一、原电池
A
Zn
Cu
SO42-
H+
H+
实验探究二:构成原电池,需要哪些条件?
第一组实验
构成条件一:必须形成闭合回路
构成条件二:电极需插进电解质溶液中
第二组实验
实验探究二:构成原电池的条件
实验探究二:构成原电池的条件
构成条件三:有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
第三组实验
2.构成原电池的条件
⑶ 有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。
⑵ 两电极需插入电解质溶液
请判断下列各装置是否是原电池?为什么?
⑴ 形成闭合回路
Zn
A
Zn
SO42-
H+
H+
A
Zn
SO42-
H+
H+
C
A
Zn
Cu
煤油
SO42-
H+
H+
SO42—
Zn
H+
H+
Cu
A
(x)
(x)
(√)
(x)
A
Zn
SO42-
H+
H+
木条
(x)
科学探究三:思考与交流
讨论一:实验4中铜片上产生了气体(H2),那么H+得到的电子是铜失去的还是锌失去的?如何检验?请小组讨论设计实验方案。 (提示:铜失电子之后生成Cu2+ ,锌失电子之后生成Zn2+ )
方案1:称量实验前后铜片或锌片的质量。
方案2:观察溶液的颜色,看有无Cu2+生成
失电子,发生氧化反应
得电子,发生还原反应
氧化还原反应
原电池的实质:
3、原电池工作原理:
⑴、电极反应:
锌片(负极):
Zn - 2e- = Zn2+
铜片(正极):
2H+ + 2e- = H2 ↑
⑵、电池反应:
Zn + 2H+ = Zn2+ + H2↑
讨论二:我们知道电池有正、负极之分,根据物理学的知识,如何确定Cu、Zn、稀硫酸组成原电池的正、负极?
Cu-Zn原电池
正负极的判断和电荷移动
相对活泼金属作负极,不活泼金属或非金属材料作正极。
外电路:电子由负极→正极
内电路:阴离子移向负极;
阳离子移向正极。
小结
间接:
直接:
化学能
燃烧
热能
蒸汽
机械能
发动机
电能
装置
原电池
概
念
构成条件
工作原理
化学能与电能
练习:1.下列装置是不是原电池?若是,指出正负极。
(1)
(2)
2.请根据反应 Fe + Cu2+ = Fe2++ Cu
设计原电池,有哪些可行方案?
负极:
正极:
电解质溶液:
Fe
比Fe不活泼的金属或石墨
CuSO4、CuCl2等
纽扣电池
蓄电池
笔记本电池
发展中的化学电池
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。在你的生活和学习中,你了解哪些电池?哪些电器使用电池?
1号电池
5号锂电池
7号电池
太阳能电池
手机电池
干电池——锌锰电池
电极反应式:
负极:Zn-2e-=Zn2+
正极:2NH4+ + 2e- = 2NH3↑+H2 ↑
2MnO2 +H2 = Mn2O3 + H2O
Zn2+ + 4NH3 = [Zn(NH3)4]2+
特点:
1.一次性电池; 2.放电时,锌外壳逐渐变薄;
3.放置过久,也会失效; 4.内部反应是不可逆的。
充电电池——二次电池
负极:Pb – 2e- + SO42- = PbSO4
极正:PbO2 + 2e- + 4H+ + SO42- = PbSO4+2H2O
总反应式:Pb + PbO2+ 2H2SO4 = 2PbSO4 + 2H2O
充电电池的优点:
1.更经久耐用,更方便实惠;
2.节约资源,减少废电池的处理量。
化学能 电能
放电
充电
燃料电池
正极:O2 + 4e- + 2H2O = 4OH-
负极:2H2 – 4e- + 4OH- = 4H2O
总反应式:2H2 + O2 = 2H2O
谢谢
