人教版高中化学必修2第二章课件:2.1化学能与热能(共45张PPT)
文档属性
| 名称 | 人教版高中化学必修2第二章课件:2.1化学能与热能(共45张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 360.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-17 22:07:31 | ||
图片预览











文档简介
(共42张PPT)
第二章:化学反应与能量
第一节:化学能与热能
普通高中课程标准实验教科书(人教版)
化学(必修二)
提出问题:
1、为什么暖宝宝能发热?
暖宝宝发热原理:
暖宝宝”片状贴剂是由原料层、明胶层、无纺布袋
三部分组成的,原料层置于无纺布袋内,含有由铁、
活性炭、无机盐、水等合成的聚合物,可在空气中
氧气的作用下发生放热反应。在空气中氧气的作用
下12-20小时内持续不断地释放热量,这种反应过
程是从一打开真空包装的时候开始的
提出新问题:
1、哪些化学反应会放热,而哪些会吸热?
2、为什么有些化学反应会放热,而有些会吸 热?
合作探究:
问题一:常见吸热反应和放热反应
课题:1、请根据所给试剂分析哪些物质之间能反应, 写出相应方程式。
2、利用所给试剂和仪器设计实验验证反应属于
吸热反应还是放热反应?
所给试剂: 镁带、稀盐酸、稀硫酸、NaOH 溶液、
所给仪器:试管、胶头滴管、温度计、烧杯、砂纸、药匙
、镊子
1、金属镁本身为银白色并具有金属光泽,
为什么通常所用镁带无金属光泽?实验前
如何处理?
2、如何确定反应放热还是吸热?
3、反应中一般取用液体的量为多少?
实验前思考:
归纳总结:
放热反应
放热反应
吸热反应
反应类型 结论
酸碱中和反应
金属与酸的置换反应
Ba(OH)2·8H2O晶体、与NH4CI晶体的搅拌反应
问题:请根据所给资料总结、归纳其他属于放热和吸热的反应类型?
资料:
(1)每天利用燃烧煤及煤气产生的热量烧火做饭。
(2)如果没有乙醇或天然气或汽油,我们身边的汽车都得停开,利用
这些物质燃烧提供的热量起动汽车发动机作动力源.
(3)生石灰水可以煮鸡蛋;做红磷、铝箔、铁丝在氧气中燃烧的实
验时,通常在必须在集气瓶底装少量水或铺一层细沙防止实验
时溅落的高温熔化物炸裂瓶底。 (4)人体利用葡萄糖在体内的氧化产生热量给人体提供热量,这个热
量又为人体体内的酶的催化提供温度.
可燃物的燃烧、大多数化合反应和缓慢氧化还原反应
也属于放热反应。
结论:
自主学习
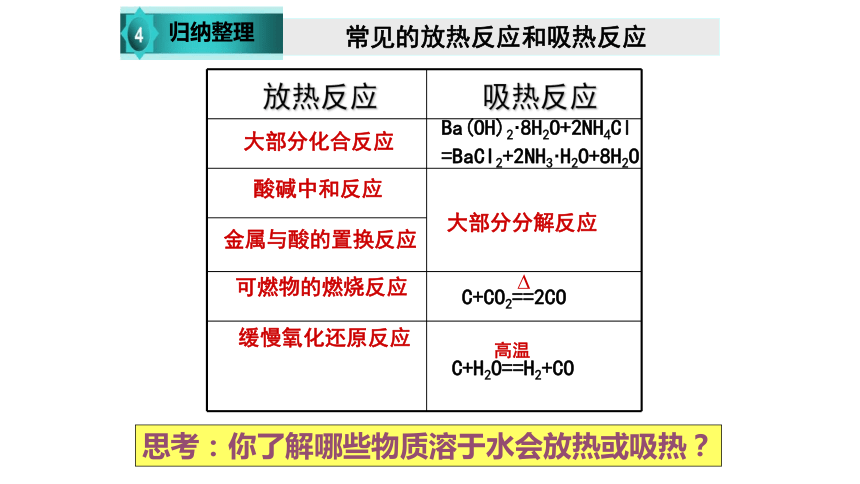
常见的放热反应和吸热反应
归纳整理
放热反应 吸热反应
大部分化合反应
酸碱中和反应
金属与酸的置换反应
可燃物的燃烧反应
Ba(OH)2·8H2O+2NH4Cl
=BaCI2+2NH3·H2O+8H2O
大部分分解反应
缓慢氧化还原反应
C+CO2==2CO
?
C+H2O==H2+CO
高温
思考:你了解哪些物质溶于水会放热或吸热?
问题二:为什么化学反应会放热或吸热?
问题:
1、自然界存在的两条基本定律是什么?
2、分析以下过程能量变化?
宏观分析:
水往下流会
能量,
本身势能
。
火箭升空需
要 能量,
本身能量
。
自行车运行中
需要 能量,
本身能量
。
放出
减小
吸收
升高
吸收
升高
吸收能量→物质本身能量 。
放出能量→物质本身能量 。
升高
降低
化学反应中能量变化的决定因素
(用E表示物质能量)
放出
吸收
思考:
1、伴有能量的变化都是化学变化吗?
2、如何判断一个反应吸收能量还是放出能量?
微观分析:
阅读教材32页内容,回答以下问题:
1.化学反应的实质
化学反应的实质是原子(或原子团)的__________,
即反应物中旧化学键的_____和生成物中新化学
键的_____。
2.化学反应中能量变化的原因(微观角度)
(1)物质中的原子之间是通过________结合的。
(2)断开反应物中的化学键要_____能量,形成生成
物中的化学键要_____能量。
(3) 物质在化学反应中发生能量变化的主要原因是
.
重新组合
断裂
形成
化学键
吸收
放出
化学键的断裂和形成。
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、原子之间通过什么结合在一起?
2、化学反应的实质是什么呢?
H ·
··
· Cl
··
:
+
→
Cl
··
··
H
··
··
H-H
Cl -Cl
H-Cl
断开
断开
形成
H2 + Cl2 = 2HCl
点燃
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
H ·
··
· Cl
··
:
+
→
Cl
··
··
H
··
··
H-H
Cl -Cl
H-Cl
断开
断开
形成
H2 + Cl2 = 2HCl
点燃
吸收能量
吸收能量
释放能量
化学键的“旧断新生”为何会引起反应体系的能量变化?
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上(从微观的角度)就是旧化学键断裂和新化学键形成的过程。
2、破坏旧键需要吸收能量
形成新键能够放出能量
【例1】你知道吗?断开1mol化学键所需吸收的能量称之为键能。不同化学键的键能是不相同的。已知断开1molH-H键吸收能量436kJ,断开1molCl-Cl键吸收能量243kJ,形成1molH-Cl键释放能量432kJ。判断反应H2+Cl2=2HCl中发生的变化:
(1)断开键时吸收的总能量是 。
(2)形成键时放出的总能量是 。
(3)反应过程中 (填“吸收”或“放出”)能量 。
679kJ
864kJ
放出
185kJ
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
2、破坏旧键需要吸收能量
形成新键能够放出能量
3、判断:断开化学键吸收的能量大于形成化学键放出的能量时,反应吸收能量;
断开化学键吸收的能量小于形成化学键放出的能量时,反应放出能量
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
2、破坏旧键需要吸收能量
形成新键能够放出能量
3、判断:
4、化学反应的特征:
(1) 新物质生成;
(2) 能量变化
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
瀑布
反应物总能量高
生成物总能量低
能量
反应进程
释放能量
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
1、反应物的总能量 生成物的总能量,反应放出能量。
大于
能量
反应进程
反应物总能量低
生成物总能量高
吸收能量
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
1、反应物总能量 生成物总能量,反应吸收能量。
小于
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
1、判断
2、能量守恒定律:
(1)能量形式可以相互转化
(2)总能量守恒
【例2】当氢气在氧气中燃烧生成水时,向外界放出能量。下列说法中正确的是( )
A、断开氢气与氧气中化学键时吸收的能量大于形成水中化学键所放出的能量
B、断开氢气与氧气中化学键时吸收的能量小于形成水中化学键所放出的能量
C、 D、
H2与O2的总能量
H2O的总能量
H2与O2的总能量
H2O的总能量
BD
思考
二、化学键与化学反应中的能量变化的关系
(一)化学反应中能量变化通常主要表现为热量变化——放热或吸热。
(二)常见的放热反应与吸热反应
放热反应:
吸热反应:
吸收热量的化学反应
有热量放出的化学反应
化
学
反
应
【例3】下列反应中,属于放热反应的是 ,属于吸热反应的 。
①燃烧木炭取暖
②炸药爆炸
③煅烧石灰石制生石灰
④HCl与NaOH的中和反应
⑤生石灰溶于水
⑥葡萄糖在人体缓慢氧化
⑦浓硫酸溶于水
⑧硝酸铵溶于水
⑨冰雪融化
①②④⑤⑥
③
思考:
二、化学键与化学反应中的能量变化的关系
(一)化学反应中能量变化通常主要表现为热量变化——放热或吸热。
(二)常见的放热反应与吸热反应
常见的放热反应和吸热反应(笔记)
放热反应
1、所有的燃料的燃烧
(包括缓慢氧化)
2、中和反应
3、金属与酸与水的反应
4、大部分化合反应
(如生石灰和水反应)
吸热反应
、
铵盐与强碱的反应、
持续高温加热的反应
大部分分解反应
C + CO2
C +H2O
H2 + CuO
Ba(OH)2·8H2O+NH4Cl
Fe+H2O(g)
5、原电池反应;
注意:放热反应和放热过程的比较
小结
化学能与热能的相互转化:
1、微观原因:
旧键断裂( 能量)
新键形成( 能量)
2、宏观原因:反应物总能量与生成物总能量的比较
E反应物 > E生成物 ? ____能量 ? ____反应
E反应物 < E生成物 ? ____能量 ? ____反应
3、具体反应
吸收
释放
释放
吸收
放热
吸热
判断:
(1)加热的反应一定是吸热反应
(2)不需要加热的反应一定是放热反应
(3)一个反应是吸热或放热与反应条件没有直接联系,与反应物与生成物的总能量的相对大小有关。
练一练
1、下列说法不正确的是( )
A.物质燃烧总是放热的。
B.需要加热才能发生的反应一定是吸热反应。
C.放热反应在反应发生时都不需要加热。
D.有些放热反应,在引发反应时必须加热
BC
3、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一 定能发生
C
4.指出下列说法的正误
A.生物体内进行的缓慢氧化反应是放热反应;
B.化学键断裂吸收的能量越多,化学键越牢固;
C.植物光合作用吸收太阳能,与化学能无关。
D.柴草的燃烧与化学能无关。
E.人类的文明程度与人均耗能无关。
对
对
不对
不对
不对
5、 氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。下列关系式中正确的是( )
2Q1 + Q2 > 4Q3
2Q1 + Q2 < 4Q3
Q1 + Q2 < Q3
Q1 + Q2 = Q3
B
3. 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”) 镁片和盐酸的总能量.
练一练
练一练
2.航天飞机用铝粉与高氯酸铵(NH4C104)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应。其方程式可表示为:
下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵起氧化剂作用
D
4、石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石,已知12g石墨完全转化为金刚石时,要吸收1.895 kJ的能量,下列说法正确的是( )
A、石墨不如金刚石稳定
B、金刚石不如石墨稳定
C、等质量的石墨与金刚石完全燃烧,金刚石放出的能量多
D、等质量的石墨与金刚石完全燃烧,石墨放出的能量多
BC
练一练
跳一跳
我们已经知道中和反应会放出热量,请你根据以下老师提供的仪器来组装一个实验装置来测定反应过程中放出的热量。
(大烧杯、小烧杯、泡沫塑料、纸盖、环形玻璃搅拌棒、温度计)
√
小组讨论:根据所学知识分析下列说法的正误:
Χ
√
Χ
√
√
Χ
Χ
巩固练习:
1、H2与O2的燃烧反应是吸热反应。( )
2、已知反应X+Y=M+N为放热反应,X 的能量一定高于M。( )
3、CaCO3受热分解是吸热反应( )
4、NH4Cl晶体溶于水吸热( )
5、放热的反应在常温下一定易进行( )
6、吸热反应在一定条件下也能进行( )
7、需加热才能发生的反应一定是吸热反应( )
8、Fe粉和稀H2SO4的反应是放热反应。( )
课堂小结
通过本节课的学习,谈谈你的收获。
作业布置
查阅资料,写一篇关于人类利用化学反应中产生的
能量的文章。
第二章:化学反应与能量
第一节:化学能与热能
普通高中课程标准实验教科书(人教版)
化学(必修二)
提出问题:
1、为什么暖宝宝能发热?
暖宝宝发热原理:
暖宝宝”片状贴剂是由原料层、明胶层、无纺布袋
三部分组成的,原料层置于无纺布袋内,含有由铁、
活性炭、无机盐、水等合成的聚合物,可在空气中
氧气的作用下发生放热反应。在空气中氧气的作用
下12-20小时内持续不断地释放热量,这种反应过
程是从一打开真空包装的时候开始的
提出新问题:
1、哪些化学反应会放热,而哪些会吸热?
2、为什么有些化学反应会放热,而有些会吸 热?
合作探究:
问题一:常见吸热反应和放热反应
课题:1、请根据所给试剂分析哪些物质之间能反应, 写出相应方程式。
2、利用所给试剂和仪器设计实验验证反应属于
吸热反应还是放热反应?
所给试剂: 镁带、稀盐酸、稀硫酸、NaOH 溶液、
所给仪器:试管、胶头滴管、温度计、烧杯、砂纸、药匙
、镊子
1、金属镁本身为银白色并具有金属光泽,
为什么通常所用镁带无金属光泽?实验前
如何处理?
2、如何确定反应放热还是吸热?
3、反应中一般取用液体的量为多少?
实验前思考:
归纳总结:
放热反应
放热反应
吸热反应
反应类型 结论
酸碱中和反应
金属与酸的置换反应
Ba(OH)2·8H2O晶体、与NH4CI晶体的搅拌反应
问题:请根据所给资料总结、归纳其他属于放热和吸热的反应类型?
资料:
(1)每天利用燃烧煤及煤气产生的热量烧火做饭。
(2)如果没有乙醇或天然气或汽油,我们身边的汽车都得停开,利用
这些物质燃烧提供的热量起动汽车发动机作动力源.
(3)生石灰水可以煮鸡蛋;做红磷、铝箔、铁丝在氧气中燃烧的实
验时,通常在必须在集气瓶底装少量水或铺一层细沙防止实验
时溅落的高温熔化物炸裂瓶底。 (4)人体利用葡萄糖在体内的氧化产生热量给人体提供热量,这个热
量又为人体体内的酶的催化提供温度.
可燃物的燃烧、大多数化合反应和缓慢氧化还原反应
也属于放热反应。
结论:
自主学习
常见的放热反应和吸热反应
归纳整理
放热反应 吸热反应
大部分化合反应
酸碱中和反应
金属与酸的置换反应
可燃物的燃烧反应
Ba(OH)2·8H2O+2NH4Cl
=BaCI2+2NH3·H2O+8H2O
大部分分解反应
缓慢氧化还原反应
C+CO2==2CO
?
C+H2O==H2+CO
高温
思考:你了解哪些物质溶于水会放热或吸热?
问题二:为什么化学反应会放热或吸热?
问题:
1、自然界存在的两条基本定律是什么?
2、分析以下过程能量变化?
宏观分析:
水往下流会
能量,
本身势能
。
火箭升空需
要 能量,
本身能量
。
自行车运行中
需要 能量,
本身能量
。
放出
减小
吸收
升高
吸收
升高
吸收能量→物质本身能量 。
放出能量→物质本身能量 。
升高
降低
化学反应中能量变化的决定因素
(用E表示物质能量)
放出
吸收
思考:
1、伴有能量的变化都是化学变化吗?
2、如何判断一个反应吸收能量还是放出能量?
微观分析:
阅读教材32页内容,回答以下问题:
1.化学反应的实质
化学反应的实质是原子(或原子团)的__________,
即反应物中旧化学键的_____和生成物中新化学
键的_____。
2.化学反应中能量变化的原因(微观角度)
(1)物质中的原子之间是通过________结合的。
(2)断开反应物中的化学键要_____能量,形成生成
物中的化学键要_____能量。
(3) 物质在化学反应中发生能量变化的主要原因是
.
重新组合
断裂
形成
化学键
吸收
放出
化学键的断裂和形成。
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、原子之间通过什么结合在一起?
2、化学反应的实质是什么呢?
H ·
··
· Cl
··
:
+
→
Cl
··
··
H
··
··
H-H
Cl -Cl
H-Cl
断开
断开
形成
H2 + Cl2 = 2HCl
点燃
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
H ·
··
· Cl
··
:
+
→
Cl
··
··
H
··
··
H-H
Cl -Cl
H-Cl
断开
断开
形成
H2 + Cl2 = 2HCl
点燃
吸收能量
吸收能量
释放能量
化学键的“旧断新生”为何会引起反应体系的能量变化?
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上(从微观的角度)就是旧化学键断裂和新化学键形成的过程。
2、破坏旧键需要吸收能量
形成新键能够放出能量
【例1】你知道吗?断开1mol化学键所需吸收的能量称之为键能。不同化学键的键能是不相同的。已知断开1molH-H键吸收能量436kJ,断开1molCl-Cl键吸收能量243kJ,形成1molH-Cl键释放能量432kJ。判断反应H2+Cl2=2HCl中发生的变化:
(1)断开键时吸收的总能量是 。
(2)形成键时放出的总能量是 。
(3)反应过程中 (填“吸收”或“放出”)能量 。
679kJ
864kJ
放出
185kJ
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
2、破坏旧键需要吸收能量
形成新键能够放出能量
3、判断:断开化学键吸收的能量大于形成化学键放出的能量时,反应吸收能量;
断开化学键吸收的能量小于形成化学键放出的能量时,反应放出能量
想一想
一、化学键与化学反应中的能量变化的关系
(一)能量变化的微观原因:
1、一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
2、破坏旧键需要吸收能量
形成新键能够放出能量
3、判断:
4、化学反应的特征:
(1) 新物质生成;
(2) 能量变化
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
瀑布
反应物总能量高
生成物总能量低
能量
反应进程
释放能量
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
1、反应物的总能量 生成物的总能量,反应放出能量。
大于
能量
反应进程
反应物总能量低
生成物总能量高
吸收能量
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
1、反应物总能量 生成物总能量,反应吸收能量。
小于
一、化学键与化学反应中的能量变化的关系
(二)能量变化的宏观原因:
1、判断
2、能量守恒定律:
(1)能量形式可以相互转化
(2)总能量守恒
【例2】当氢气在氧气中燃烧生成水时,向外界放出能量。下列说法中正确的是( )
A、断开氢气与氧气中化学键时吸收的能量大于形成水中化学键所放出的能量
B、断开氢气与氧气中化学键时吸收的能量小于形成水中化学键所放出的能量
C、 D、
H2与O2的总能量
H2O的总能量
H2与O2的总能量
H2O的总能量
BD
思考
二、化学键与化学反应中的能量变化的关系
(一)化学反应中能量变化通常主要表现为热量变化——放热或吸热。
(二)常见的放热反应与吸热反应
放热反应:
吸热反应:
吸收热量的化学反应
有热量放出的化学反应
化
学
反
应
【例3】下列反应中,属于放热反应的是 ,属于吸热反应的 。
①燃烧木炭取暖
②炸药爆炸
③煅烧石灰石制生石灰
④HCl与NaOH的中和反应
⑤生石灰溶于水
⑥葡萄糖在人体缓慢氧化
⑦浓硫酸溶于水
⑧硝酸铵溶于水
⑨冰雪融化
①②④⑤⑥
③
思考:
二、化学键与化学反应中的能量变化的关系
(一)化学反应中能量变化通常主要表现为热量变化——放热或吸热。
(二)常见的放热反应与吸热反应
常见的放热反应和吸热反应(笔记)
放热反应
1、所有的燃料的燃烧
(包括缓慢氧化)
2、中和反应
3、金属与酸与水的反应
4、大部分化合反应
(如生石灰和水反应)
吸热反应
、
铵盐与强碱的反应、
持续高温加热的反应
大部分分解反应
C + CO2
C +H2O
H2 + CuO
Ba(OH)2·8H2O+NH4Cl
Fe+H2O(g)
5、原电池反应;
注意:放热反应和放热过程的比较
小结
化学能与热能的相互转化:
1、微观原因:
旧键断裂( 能量)
新键形成( 能量)
2、宏观原因:反应物总能量与生成物总能量的比较
E反应物 > E生成物 ? ____能量 ? ____反应
E反应物 < E生成物 ? ____能量 ? ____反应
3、具体反应
吸收
释放
释放
吸收
放热
吸热
判断:
(1)加热的反应一定是吸热反应
(2)不需要加热的反应一定是放热反应
(3)一个反应是吸热或放热与反应条件没有直接联系,与反应物与生成物的总能量的相对大小有关。
练一练
1、下列说法不正确的是( )
A.物质燃烧总是放热的。
B.需要加热才能发生的反应一定是吸热反应。
C.放热反应在反应发生时都不需要加热。
D.有些放热反应,在引发反应时必须加热
BC
3、已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一 定能发生
C
4.指出下列说法的正误
A.生物体内进行的缓慢氧化反应是放热反应;
B.化学键断裂吸收的能量越多,化学键越牢固;
C.植物光合作用吸收太阳能,与化学能无关。
D.柴草的燃烧与化学能无关。
E.人类的文明程度与人均耗能无关。
对
对
不对
不对
不对
5、 氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ。下列关系式中正确的是( )
2Q1 + Q2 > 4Q3
2Q1 + Q2 < 4Q3
Q1 + Q2 < Q3
Q1 + Q2 = Q3
B
3. 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”) 镁片和盐酸的总能量.
练一练
练一练
2.航天飞机用铝粉与高氯酸铵(NH4C104)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应。其方程式可表示为:
下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵起氧化剂作用
D
4、石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石,已知12g石墨完全转化为金刚石时,要吸收1.895 kJ的能量,下列说法正确的是( )
A、石墨不如金刚石稳定
B、金刚石不如石墨稳定
C、等质量的石墨与金刚石完全燃烧,金刚石放出的能量多
D、等质量的石墨与金刚石完全燃烧,石墨放出的能量多
BC
练一练
跳一跳
我们已经知道中和反应会放出热量,请你根据以下老师提供的仪器来组装一个实验装置来测定反应过程中放出的热量。
(大烧杯、小烧杯、泡沫塑料、纸盖、环形玻璃搅拌棒、温度计)
√
小组讨论:根据所学知识分析下列说法的正误:
Χ
√
Χ
√
√
Χ
Χ
巩固练习:
1、H2与O2的燃烧反应是吸热反应。( )
2、已知反应X+Y=M+N为放热反应,X 的能量一定高于M。( )
3、CaCO3受热分解是吸热反应( )
4、NH4Cl晶体溶于水吸热( )
5、放热的反应在常温下一定易进行( )
6、吸热反应在一定条件下也能进行( )
7、需加热才能发生的反应一定是吸热反应( )
8、Fe粉和稀H2SO4的反应是放热反应。( )
课堂小结
通过本节课的学习,谈谈你的收获。
作业布置
查阅资料,写一篇关于人类利用化学反应中产生的
能量的文章。
