高中化学人教版选修四第一章第三节化学反应热的计算第2课时(共15张PPT)
文档属性
| 名称 | 高中化学人教版选修四第一章第三节化学反应热的计算第2课时(共15张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 245.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-17 22:19:17 | ||
图片预览






文档简介
(共15张PPT)
第三节 化学反应热的计算
1
2
下列数据表示H2的燃烧热吗?
H2(g)+1/2O2(g)==H2O (g)
ΔH1=-241.8kJ/mol
H2O(g)==H2O (l)
ΔH2=-44 kJ/mol
已知
H2(g)+1/2O2(g)==H2O (l)
ΔH=ΔH1+ ΔH2=-285.8kJ/mol
3
已知(1)Zn(s)+O2(g)==ZnO(s) ΔH=-348.3 kJ·mol-1
(2)2Ag(s)+O2(g)==Ag2O(s) ΔH=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s)==ZnO(s)+2Ag(s)的ΔH等于( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
A
4
第2课时 反应热的计算
二、反应热的计算
1.有关热化学方程式的计算
【例1】25℃、101kPa时,使1.0 g钠与足量的氯气反应,生成氯化钠晶体并放出17.87 kJ的热量,求生成
1 mol氯化钠的反应热。
解析: Na(s) + Cl2(g) ==NaCl(s)
17.87 kJ / g × 23 g / mol = 411 kJ / mol
答:生成1 mol NaCl时的反应热为-411 kJ/mol。
5
2.关于燃烧热的计算
【例2】乙醇的燃烧热△H=-1366.8 kJ/mol,在25℃、101kPa时,1 kg乙醇充分燃烧后放出多少热量?
解析: n(C2H5OH)=1000 g / 46g/mol
=21.74mol
1 kg C2H5OH燃烧后产生的热量:
1366.8 kJ/ mol× 21.74mol=2.971×104kJ
答:1 kg C2H5OH充分燃烧后放出2.971×104kJ的热量。
6
7
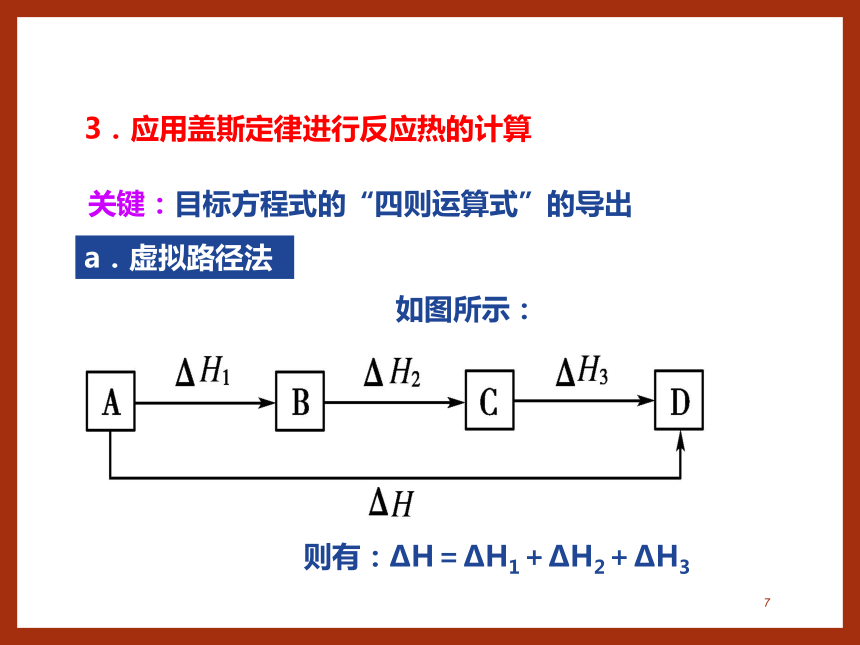
3.应用盖斯定律进行反应热的计算
关键:目标方程式的“四则运算式”的导出
a.虚拟路径法
如图所示:
则有:ΔH=ΔH1+ΔH2+ΔH3
8
b.加合法
即运用已知热化学方程式通过叠加的方法得到目标热化学方程式
步骤:
⑵ 反应热调整相应系数后作对应的加减
目标热化学方程式的反应物→已知热化学方程式的反应物中调整系数后相加
目标热化学方程式的反应物→已知热化学方程式的生成物中调整系数后相减
⑴
【例3】已知下列反应的反应热为
⑴ CH3COOH (l) + 2O2(g) == 2CO2(g) + 2H2O(l)
ΔH1= -870.3 kJ/mol
⑵ C(s) + O2 (g) == CO2(g)
ΔH2= -393.5 kJ/mol
⑶ H2(g) + O2(g) ==H2O(l)
ΔH3= -285.8 kJ/mol
试计算下述反应的反应热:
2C(s) + 2H2 (g) + O2 (g) ==CH3COOH (l)
9
解析 分析各方程式的关系,知
将方程式按2[⑵ + ⑶]-⑴组合得上述反应方程式
即:ΔH = 2[ΔH 2 + ΔH3] - ΔH1
ΔH =2[(-393.5kJ/mol) + (-285.8kJ/mol)]
-(-870.3kJ/mol)
= - 488.3kJ/mol
答:反应2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l)
的反应热为-488.3kJ/mol
10
11
1.盖斯定律
根据热化学方程式进行计算
根据盖斯定律进行有关反应热的计算
2.有关反应热的计算
1.已知⑴H2(g)+ O2(g)==H2O(g) ΔH1=a kJ·mol-1
⑵2H2(g)+O2(g)==2H2O(g) ΔH2=b kJ·mol-1
⑶H2(g)+ O2(g)==H2O(l) ΔH3=c kJ·mol-1
⑷2H2(g)+O2(g)==2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<b<0 B.b>d>0
C.2a=b<0 D.2c=d>0
12
C
13
2.人体内葡萄糖的消耗可用下述化学方程式表示:
C6H12O6(s)+6O2(g)==6CO2(g)+6H2O(l)
ΔH=-2800KJ/mol,
若某人每天消耗12540KJ热量,他每天至少要摄入葡萄糖
( )
A.806g B.1000g C.1250g D.1500g
A
14
3、已知:
Zn ( s ) +1/2O2 ( g ) = ZnO ( s ) ΔH1 = -351.1 kJ/mol
Hg ( l) +1/2O2 ( g ) = Hg O ( s ) ΔH2 = -90.7 kJ/mol
则可知:
Zn ( s ) + Hg O ( s ) = ZnO ( s ) + Hg ( l) ΔH 3= kJ/mol。
则ΔH 3为多少?
4、已知:
2C(s) + O2 ( g ) =2CO ( g) ΔH1 = -221 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ) ΔH2 = -483.6 kJ/mol
则C(s) + H2O ( g ) =CO ( g) + H2( g )的ΔH3为多少?
ΔH 3= -260.4kJ/mol
ΔH3 = +131.3kJ/mol
5、强酸与强碱的稀溶液发生中和反应的热效应为:
H+(aq)+OH-(aq)=H2O(l) △ H= -57.3 KJ/mol 分别向NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应分别为ΔH1 、ΔH2 、ΔH3则三者的大小关系为:
6、 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,其热化学方程式为:
已知H2O(l)=H2O (g) ΔH=+44kJ/mol,则11.2L(标况)乙硼烷完全燃烧生成气态水时放出的热量为多少?
15
ΔH2 <ΔH3 <ΔH1
B2H6(g)+3O2 (g) ==B2O3(s)+3H2O(l)
ΔH= -2165 KJ/mol
放热1016.5kJ
第三节 化学反应热的计算
1
2
下列数据表示H2的燃烧热吗?
H2(g)+1/2O2(g)==H2O (g)
ΔH1=-241.8kJ/mol
H2O(g)==H2O (l)
ΔH2=-44 kJ/mol
已知
H2(g)+1/2O2(g)==H2O (l)
ΔH=ΔH1+ ΔH2=-285.8kJ/mol
3
已知(1)Zn(s)+O2(g)==ZnO(s) ΔH=-348.3 kJ·mol-1
(2)2Ag(s)+O2(g)==Ag2O(s) ΔH=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s)==ZnO(s)+2Ag(s)的ΔH等于( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
A
4
第2课时 反应热的计算
二、反应热的计算
1.有关热化学方程式的计算
【例1】25℃、101kPa时,使1.0 g钠与足量的氯气反应,生成氯化钠晶体并放出17.87 kJ的热量,求生成
1 mol氯化钠的反应热。
解析: Na(s) + Cl2(g) ==NaCl(s)
17.87 kJ / g × 23 g / mol = 411 kJ / mol
答:生成1 mol NaCl时的反应热为-411 kJ/mol。
5
2.关于燃烧热的计算
【例2】乙醇的燃烧热△H=-1366.8 kJ/mol,在25℃、101kPa时,1 kg乙醇充分燃烧后放出多少热量?
解析: n(C2H5OH)=1000 g / 46g/mol
=21.74mol
1 kg C2H5OH燃烧后产生的热量:
1366.8 kJ/ mol× 21.74mol=2.971×104kJ
答:1 kg C2H5OH充分燃烧后放出2.971×104kJ的热量。
6
7
3.应用盖斯定律进行反应热的计算
关键:目标方程式的“四则运算式”的导出
a.虚拟路径法
如图所示:
则有:ΔH=ΔH1+ΔH2+ΔH3
8
b.加合法
即运用已知热化学方程式通过叠加的方法得到目标热化学方程式
步骤:
⑵ 反应热调整相应系数后作对应的加减
目标热化学方程式的反应物→已知热化学方程式的反应物中调整系数后相加
目标热化学方程式的反应物→已知热化学方程式的生成物中调整系数后相减
⑴
【例3】已知下列反应的反应热为
⑴ CH3COOH (l) + 2O2(g) == 2CO2(g) + 2H2O(l)
ΔH1= -870.3 kJ/mol
⑵ C(s) + O2 (g) == CO2(g)
ΔH2= -393.5 kJ/mol
⑶ H2(g) + O2(g) ==H2O(l)
ΔH3= -285.8 kJ/mol
试计算下述反应的反应热:
2C(s) + 2H2 (g) + O2 (g) ==CH3COOH (l)
9
解析 分析各方程式的关系,知
将方程式按2[⑵ + ⑶]-⑴组合得上述反应方程式
即:ΔH = 2[ΔH 2 + ΔH3] - ΔH1
ΔH =2[(-393.5kJ/mol) + (-285.8kJ/mol)]
-(-870.3kJ/mol)
= - 488.3kJ/mol
答:反应2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l)
的反应热为-488.3kJ/mol
10
11
1.盖斯定律
根据热化学方程式进行计算
根据盖斯定律进行有关反应热的计算
2.有关反应热的计算
1.已知⑴H2(g)+ O2(g)==H2O(g) ΔH1=a kJ·mol-1
⑵2H2(g)+O2(g)==2H2O(g) ΔH2=b kJ·mol-1
⑶H2(g)+ O2(g)==H2O(l) ΔH3=c kJ·mol-1
⑷2H2(g)+O2(g)==2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.a<b<0 B.b>d>0
C.2a=b<0 D.2c=d>0
12
C
13
2.人体内葡萄糖的消耗可用下述化学方程式表示:
C6H12O6(s)+6O2(g)==6CO2(g)+6H2O(l)
ΔH=-2800KJ/mol,
若某人每天消耗12540KJ热量,他每天至少要摄入葡萄糖
( )
A.806g B.1000g C.1250g D.1500g
A
14
3、已知:
Zn ( s ) +1/2O2 ( g ) = ZnO ( s ) ΔH1 = -351.1 kJ/mol
Hg ( l) +1/2O2 ( g ) = Hg O ( s ) ΔH2 = -90.7 kJ/mol
则可知:
Zn ( s ) + Hg O ( s ) = ZnO ( s ) + Hg ( l) ΔH 3= kJ/mol。
则ΔH 3为多少?
4、已知:
2C(s) + O2 ( g ) =2CO ( g) ΔH1 = -221 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ) ΔH2 = -483.6 kJ/mol
则C(s) + H2O ( g ) =CO ( g) + H2( g )的ΔH3为多少?
ΔH 3= -260.4kJ/mol
ΔH3 = +131.3kJ/mol
5、强酸与强碱的稀溶液发生中和反应的热效应为:
H+(aq)+OH-(aq)=H2O(l) △ H= -57.3 KJ/mol 分别向NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应分别为ΔH1 、ΔH2 、ΔH3则三者的大小关系为:
6、 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,其热化学方程式为:
已知H2O(l)=H2O (g) ΔH=+44kJ/mol,则11.2L(标况)乙硼烷完全燃烧生成气态水时放出的热量为多少?
15
ΔH2 <ΔH3 <ΔH1
B2H6(g)+3O2 (g) ==B2O3(s)+3H2O(l)
ΔH= -2165 KJ/mol
放热1016.5kJ
