11.1生活中的盐--除杂(提纯)(共13张PPT)
文档属性
| 名称 | 11.1生活中的盐--除杂(提纯)(共13张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 489.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-18 15:26:47 | ||
图片预览




文档简介
(共13张PPT)
课题1 生活中常见的盐
提纯、除杂
利用复分解反应的条件判断下列反应能否发生?若能反应,则写出反应的化学方程式。
1、 碳酸钡和盐酸
2、 氢氧化镁和硝酸钾
3、 硝酸银和氯化钠
4、 硫酸和氢氧化钾
5、 氯化钡和硫酸铜
6、碳酸钾和硝酸钡
1、盐和金属反应:
盐+金属→新盐+新金属
A:盐必须可溶
B:单质金属比盐中金属活泼
C:单质中K、Ca、Na除外
D:铁参加的置换反应生成的都是亚铁盐
Fe + CuSO4 == FeSO4 + Cu
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
2、盐与酸反应:
CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
Na2CO3 + 2HCl == 2NaCl + CO2↑ + H2O
NaHCO3 + HCl == NaCl + CO2↑ + H2O
盐+酸→新盐+新酸
3、盐与碱反应:
Na2CO3 + Ca(OH)2 == CaCO3↓ + 2NaOH
盐(可溶)+碱(可溶)→新盐+新碱
4、盐与盐反应:
盐(可溶)+盐(可溶)→新盐+新盐
NaCl + AgNO3 == AgCl↓ + NaNO3
CuCl2 + 2NaOH == Cu(OH)2↓ + 2NaCl
BaCl2 + Na2SO4 == BaSO4↓ + 2NaCl
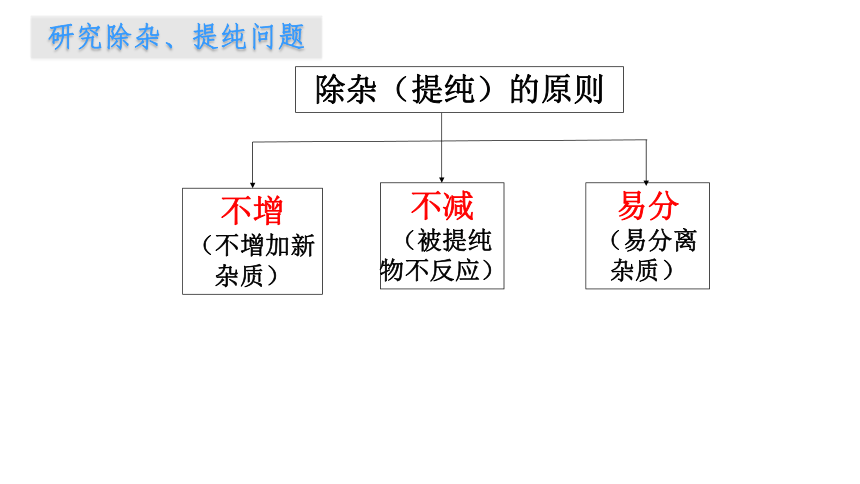
除杂(提纯)的原则
不增
(不增加新杂质)
不减
(被提纯物不反应)
易分
(易分离杂质)
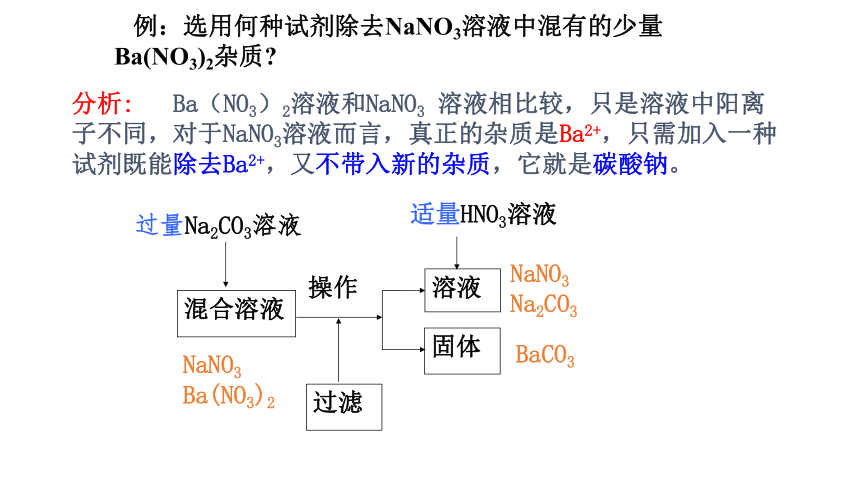
例:选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质?
分析: Ba(NO3)2溶液和NaNO3 溶液相比较,只是溶液中阳离子不同,对于NaNO3溶液而言,真正的杂质是Ba2+,只需加入一种试剂既能除去Ba2+,又不带入新的杂质,它就是碳酸钠。
溶液
混合溶液
过量Na2CO3溶液
固体
适量HNO3溶液
操作
NaNO3
Ba(NO3)2
NaNO3
Na2CO3
BaCO3
过滤
1、(11年广东)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:
Na2CO3+ Ca(OH)2 = CaCO3↓+2NaOH
将Na2CO3全部转化为NaOH
NaOH Ca(OH) 2
降温结晶
(Ⅰ)步骤②反应的化学方程式为
;
加入过量Ca(OH)2的目的是 。
(Ⅱ)滤液B中的溶质是 、 (写化学式);
步骤③所包含的具体操作是加热浓缩、 、过滤。
NaOH
Na2CO3
NaOH
Na2CO3
CaCO3
NaOH
Ca(OH)2
NaOH
Ca(OH)2
2、(09年佛山)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是 。
粗盐中含有Na2SO4、MgCl2、CaCl2的杂质,需经过以下步骤才可获得精盐:
除去SO42-
引入Ba2+
除去Mg2+
除去Ca2+
除去Ba2+
BaSO4
Mg(OH)2
CaCO3
BaCO3
引入CO32-
引入OH-
Na2CO3
NaOH
Na+
Cl-CO32- OH-
Na+
Cl-Mg2+
Ba2+ Ca2+
Na+Cl-
Ba2+
OH- Ca2+
Na+、Cl-、
H+
Na+
Cl-
Ca2+
Mg2+
SO42-
(09年佛山)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是 。
搅拌,加快粗盐溶解
Na2SO4
CaCO3、BaCO3
会引入新杂质KCl
NaOH、Na2CO3
本课小结
一、 盐的化学性质
二 、除杂、提纯问题
1、盐 + 金属 → 新盐 + 新金属
2、盐 + 酸 → 新盐 + 新酸
3、盐(可溶)+碱(可溶)→新盐+新碱
4、盐(可溶)+盐(可溶)→新盐+新盐
粗盐中含有Na2SO4、MgCl2、CaCl2的杂质,需经过以下步骤才可获得精盐
除去SO42-
引入Ba2+
除去Mg2+
除去Ca2+
除去Ba2+
BaSO4
Mg(OH)2
CaCO3
BaCO3
引入CO32-
Na2CO3
NaOH
如果先加Na2CO3再加BaCl2会怎样?
引入OH-
Na+、Cl-、Ca2+、Mg2+、SO42-
Na+、Cl-、Mg2+、SO42-
CO32-
Na+、Cl-、Mg2+、
Ba2+
Na+、Cl-、
Ba2+
OH-
Na+、Cl-、
Ba2+
→
→
→
→
Na2CO3 BaCl2 NaOH
如果先加Na2CO3再加BaCl2会怎样?
这时Ba2+会无法除去!
课题1 生活中常见的盐
提纯、除杂
利用复分解反应的条件判断下列反应能否发生?若能反应,则写出反应的化学方程式。
1、 碳酸钡和盐酸
2、 氢氧化镁和硝酸钾
3、 硝酸银和氯化钠
4、 硫酸和氢氧化钾
5、 氯化钡和硫酸铜
6、碳酸钾和硝酸钡
1、盐和金属反应:
盐+金属→新盐+新金属
A:盐必须可溶
B:单质金属比盐中金属活泼
C:单质中K、Ca、Na除外
D:铁参加的置换反应生成的都是亚铁盐
Fe + CuSO4 == FeSO4 + Cu
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
2、盐与酸反应:
CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
Na2CO3 + 2HCl == 2NaCl + CO2↑ + H2O
NaHCO3 + HCl == NaCl + CO2↑ + H2O
盐+酸→新盐+新酸
3、盐与碱反应:
Na2CO3 + Ca(OH)2 == CaCO3↓ + 2NaOH
盐(可溶)+碱(可溶)→新盐+新碱
4、盐与盐反应:
盐(可溶)+盐(可溶)→新盐+新盐
NaCl + AgNO3 == AgCl↓ + NaNO3
CuCl2 + 2NaOH == Cu(OH)2↓ + 2NaCl
BaCl2 + Na2SO4 == BaSO4↓ + 2NaCl
除杂(提纯)的原则
不增
(不增加新杂质)
不减
(被提纯物不反应)
易分
(易分离杂质)
例:选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质?
分析: Ba(NO3)2溶液和NaNO3 溶液相比较,只是溶液中阳离子不同,对于NaNO3溶液而言,真正的杂质是Ba2+,只需加入一种试剂既能除去Ba2+,又不带入新的杂质,它就是碳酸钠。
溶液
混合溶液
过量Na2CO3溶液
固体
适量HNO3溶液
操作
NaNO3
Ba(NO3)2
NaNO3
Na2CO3
BaCO3
过滤
1、(11年广东)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:
Na2CO3+ Ca(OH)2 = CaCO3↓+2NaOH
将Na2CO3全部转化为NaOH
NaOH Ca(OH) 2
降温结晶
(Ⅰ)步骤②反应的化学方程式为
;
加入过量Ca(OH)2的目的是 。
(Ⅱ)滤液B中的溶质是 、 (写化学式);
步骤③所包含的具体操作是加热浓缩、 、过滤。
NaOH
Na2CO3
NaOH
Na2CO3
CaCO3
NaOH
Ca(OH)2
NaOH
Ca(OH)2
2、(09年佛山)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是 。
粗盐中含有Na2SO4、MgCl2、CaCl2的杂质,需经过以下步骤才可获得精盐:
除去SO42-
引入Ba2+
除去Mg2+
除去Ca2+
除去Ba2+
BaSO4
Mg(OH)2
CaCO3
BaCO3
引入CO32-
引入OH-
Na2CO3
NaOH
Na+
Cl-CO32- OH-
Na+
Cl-Mg2+
Ba2+ Ca2+
Na+Cl-
Ba2+
OH- Ca2+
Na+、Cl-、
H+
Na+
Cl-
Ca2+
Mg2+
SO42-
(09年佛山)通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 (填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是 。
搅拌,加快粗盐溶解
Na2SO4
CaCO3、BaCO3
会引入新杂质KCl
NaOH、Na2CO3
本课小结
一、 盐的化学性质
二 、除杂、提纯问题
1、盐 + 金属 → 新盐 + 新金属
2、盐 + 酸 → 新盐 + 新酸
3、盐(可溶)+碱(可溶)→新盐+新碱
4、盐(可溶)+盐(可溶)→新盐+新盐
粗盐中含有Na2SO4、MgCl2、CaCl2的杂质,需经过以下步骤才可获得精盐
除去SO42-
引入Ba2+
除去Mg2+
除去Ca2+
除去Ba2+
BaSO4
Mg(OH)2
CaCO3
BaCO3
引入CO32-
Na2CO3
NaOH
如果先加Na2CO3再加BaCl2会怎样?
引入OH-
Na+、Cl-、Ca2+、Mg2+、SO42-
Na+、Cl-、Mg2+、SO42-
CO32-
Na+、Cl-、Mg2+、
Ba2+
Na+、Cl-、
Ba2+
OH-
Na+、Cl-、
Ba2+
→
→
→
→
Na2CO3 BaCl2 NaOH
如果先加Na2CO3再加BaCl2会怎样?
这时Ba2+会无法除去!
同课章节目录
