人教版初中化学九年级下单元检测题:第九单元 溶液(解析版)
文档属性
| 名称 | 人教版初中化学九年级下单元检测题:第九单元 溶液(解析版) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-18 00:00:00 | ||
图片预览




文档简介
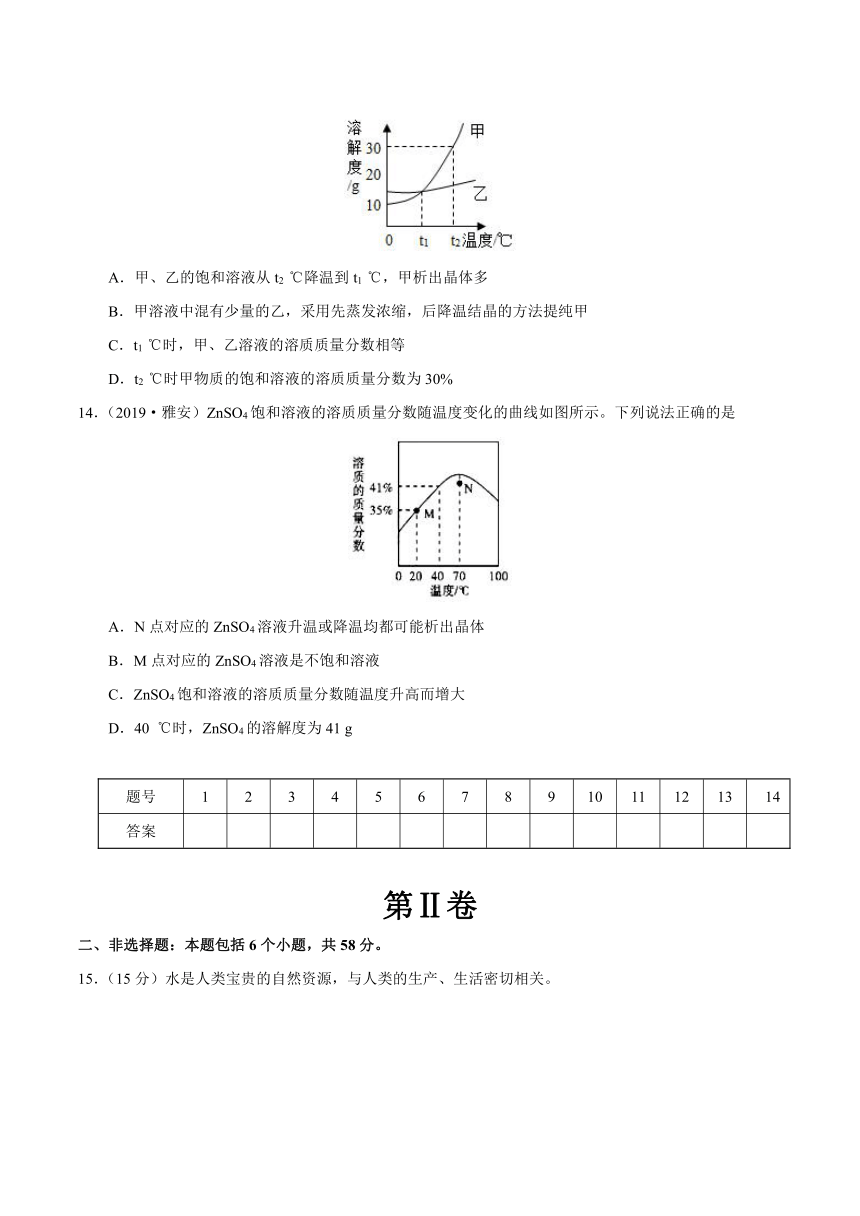
第九单元 溶液
单元检测
(满分:100分,时间:60分钟,考试方式:闭卷)
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
2.回答第I卷时,选出每小题答案后,将答案答在第II卷前的答题表中。
3.回答第II卷时,将答案直接写在本试卷上。
第Ⅰ卷
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2019·海南)下列厨房用品在水中能形成溶液的是
A.芝麻油 B.面粉 C.蔗糖 D.黄豆酱
2.在试管中加入少量碘粒,再加入适量的汽油,振荡,静置,观察到的现象为
A. B. C. D.
3.下列选项符合图示从属关系的是
4.清洗餐具上的油污,使用的物质和原理(括号内为原理)均正确的是
A.洗洁精(乳化) B.水(溶解)
C.汽油(溶解) D.酒精(反应)
5.(2019·福建)某同学模拟闽籍化学家侯德榜的“侯氏制碱法”制纯碱,需用50.0 g水配制20 ℃的NaCl饱和溶液(20 ℃时NaCl的溶解度为36.0 g),应称取NaCl的质量为
A.18.0 g B.16.0 g C.13.2 g D.11.5 g
6.现有100g20%氯化钠溶液,想把质量分数稀释到5%,则需加水的质量为
A.100 g B.200 g
C.250 g D.300 g
7.下表是NaCl、KNO3在不同温度时的溶解度:
据此数据,下列说法正确的是
A.20 ℃时,将20 g NaCl加入50 g水中,得到70 g溶液
B.50 ℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C.降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量
D.NaCl和KNO3的溶解度曲线在20 ℃~30 ℃之间相交
8.下列关于溶液的说法,正确的是
A.把少量花生油加入水中,搅拌可形成悬浊液
B.可用水鉴别硝酸铵、氢氧化钠两种固体
C.洗涤剂去油污的原理是洗涤剂溶解了油污
D.溶液中的溶质以分子或离子的形式均匀分散在溶剂中,并保持静止不动,因此,溶液具有均一性和稳定性
9.(2019·舟山)硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.操作Ⅰ一定是降温
B.①与②的溶液质量一定相等
C.①与③的溶质质量一定相等
D.②与③的溶质质量分数一定相等
10.(2019·衡阳)实验室配制100 g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为100 mL的量筒
11.实验室提纯含少量氯化钠杂质的硝酸钾的过程如下图所示。下列分析正确的是
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
12.(2019·广州)根据溶解度曲线判断,下列说法正确的是
A.30 ℃时,100 g水中最多溶解KNO3固体45.8 g
B.NaNO3溶液降温一定有晶体析出
C.KCl的溶解度比NaCl的大
D.NaCl的溶解度受温度影响比KCl大
13.下图是甲、乙两种固体物质的溶解度曲线图。下列说法中正确的是
A.甲、乙的饱和溶液从t2 ℃降温到t1 ℃,甲析出晶体多
B.甲溶液中混有少量的乙,采用先蒸发浓缩,后降温结晶的方法提纯甲
C.t1 ℃时,甲、乙溶液的溶质质量分数相等
D.t2 ℃时甲物质的饱和溶液的溶质质量分数为30%
14.(2019·雅安)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是
A.N点对应的ZnSO4溶液升温或降温均都可能析出晶体
B.M点对应的ZnSO4溶液是不饱和溶液
C.ZnSO4饱和溶液的溶质质量分数随温度升高而增大
D.40 ℃时,ZnSO4的溶解度为41 g
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
第Ⅱ卷
二、非选择题:本题包括6个小题,共58分。
15.(15分)水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)生活中常用_____________的方法将硬水进行软化。
(2)如图为甲、乙两种物质的溶解情况及溶解度曲线。
①将等质量的甲、乙固体分别加入到盛有100 g水的A、B、C、D烧杯中,充分搅拌后,其现象如图1所示,图2中表示甲物质的溶解度曲线的为___________(填“M”或“N”); 四个烧杯中的溶液一定是不饱和溶液的是_____________(填字母编号);C和D烧杯中两溶液中溶质质量分数_____________(填“相等”或“不相等”)。
②在30 ℃时,乙物质的溶解度为_____________g;此温度下,将100 g乙物质的饱和溶液,恒温蒸发10 g水后,可析出乙物质的质量为_____________g。
(3)在50 ℃时,50 g甲物质充分溶解在50 g水中,此时形成的溶液中溶质与溶剂的质量比为_____________(填最简整数比)。
16.(11分)溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母)。
A.高锰酸钾
B.汽油
C.面粉
(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度升高。这种物质是______(填字母)。
A.烧碱
B.硝酸铵
C.氯化钠
(3)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃
0
20
40
60
80
100
溶解度/g
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾
13.3
31.6
63.9
110
169
246
氢氧化钙
0.19
0.17
0.14
0.12
0.09
0.08
①60 ℃时,氯化钠的溶解度_______硝酸钾的溶解度(填“>”“=”或“<”)。
②表中某物质的饱和溶液随温度升高析出固体,该物质是_____________(填化学式)。
③20 ℃时,氯化钠饱和溶液中溶质的质量分数为________(结果保留至0.1%)。
④向20 ℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20 ℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量__________(填“增大”“不变”或“减小”)。
⑤混有少量氯化钠的硝酸钾固体,加水配成80 ℃的硝酸钾饱和溶液,再冷却至20 ℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离
17.(6分)控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________(填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)下表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃)
20
40
50
溶解度/g
NaCl
36.0
36.6
37.0
KNO3
31.6
63.9
85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________。
②20 ℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50 ℃时如图2所示。试判断:50 ℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
18.(8分)如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是____________。
(2)t2 ℃时,物质a的溶解度与物质____________的相等。
(3)t3 ℃时,把80 g物质a加入到200 g水中充分搅拌、静置,形成的是____________溶液(填“饱和”或“不饱和”)。
(4)t3 ℃时,将等质量a和b的饱和溶液降到t1 ℃时,析出晶体的质量关系正确的是________(填字母序号)。
A.a>b B.a=b
C.a19.(10分)从海水中提取食盐的方法主要为盐田法,这是一种古老而至今仍广泛沿用的方法。海水晒盐的流程如下:
(1)海水晒盐后得到的母液是当时温度下氯化钠的________________溶液(填“饱和”或“不饱和”)。
(2)如图是A、B两种物质的溶解度曲线,回答下列问题:
①t2 ℃时,A的饱和溶液中溶质的质量分数为________________。t2 ℃时,若将50 g A配成饱和溶液,应加水________________g。
②若A物质中含有少量B物质,可用____________的方法提纯A(选填“降温结晶”、“蒸发结晶”之一)。
③将t2 ℃时B的饱和溶液降低温度,溶液中溶质的质量分数________(填“变大”、“变小”或“不变”)。
20.(8分)下图是配制100 g 10% NaCl溶液的操作过程示意图。试回答:
(1)B操作中应称量NaCl的质量为______________g。
(2)D操作应选用______________规格的量筒(从50 mL、100 mL中选择)。
(3)配制溶液过程中,导致NaCl溶液浓度小于10%的原因可能是______________(填序号)。
①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘称取氯化钠时,游码不在零刻度位置就调节天平平衡,后将游码移动得到读数;④盛装溶液的试剂瓶用蒸馏水润洗;⑤NaCl晶体不纯。
A.①②③④⑤ B.只有①②④⑤
C.只有②③④⑤ D.只有①②③
(4)现将配好的100 g 10% NaCl溶液稀释为5%NaCl溶液,需加水______________g。
第九单元 溶液
单元检测参考答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
B
A
A
A
D
D
B
D
A
C
A
B
A
1.【答案】C
2.【答案】B
【解析】碘粒能溶解于汽油,形成溶液,溶液具有均一性和稳定性。振荡,静置,观察到的现象为B。
3.【答案】A
【解析】A、单质包括稀有气体单质、金属单质、非金属单质,正确;B、溶液与乳浊液是并列关系,无从属关系,错误;C、纯净物中包括化合物,错误;D、化石燃料包括石油、煤、天然气,错误。故选A。
4.【答案】A
5.【答案】A
【解析】20 ℃时NaCl的溶解度为36.0 g,即100 g水中最多溶解36.0 g氯化钠固体。那么50 g水中最多溶解18.0 g氯化钠固体。故选A。
6.【答案】D
【解析】,将100 g 20%氯化钠溶液稀释到5%,溶液的稀释过程中溶质的质量不变,所以设稀释后溶液的质量为x,100 g×20%=5%×x,解得:x=400 g,加水的质量为:400 g-100 g=300 g。故选D。
7.【答案】D
【解析】A、20 ℃时,NaCl的溶解度是36.0 g,因此50 g水中最多溶解18.0 g NaCl,得到68 g溶液。故错误;B、50 ℃时,KNO3与NaCl溶液是否饱和不清楚,无法判定,故错误;C、KNO3与NaCl溶液是否饱和不清楚,无法判定,故错误;D、分析图表,KNO3和NaCl的溶解度在20 ℃~30 ℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,正确。故选D。
8.【答案】B
【解析】A、植物油不溶于水,分散质是液体,不属于悬浊液,属于乳浊液,错误;B、硝酸铵、氢氧化钠两种固体溶于水分别吸热、放热,温度分别降低、升高,可以鉴别,正确;C、洗涤剂去除油污,是利用了洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,是利用了乳化作用,错误;D、溶液中的溶质以分子或离子的形式均匀分散在溶剂中,但是仍保持不停的运动,错误。故选B。
9.【答案】D
【解析】A、操作Ⅰ是将不饱和溶液转化为饱和溶液,不一定是降温,也可能是增加溶质、蒸发溶剂,错误;B、操作Ⅰ是将不饱和溶液转化为饱和溶液,②是饱和溶液,若采用的是增加溶质的方法,溶液的质量不相等,错误;C、①是一定温度下的不饱和溶液,②转化为③的过程中,有硝酸钾析出,①与③的溶质质量不一定相等,错误;D、②与③均为相同温度下的饱和溶液,溶质质量分数一定相等,正确。故选D。
10.【答案】A
11.【答案】C
【解析】提纯混有NaCl的KNO3,应将它们都溶于水,因为KNO3的溶解度随温度的升高而升高,NaCl的溶解度随温度的升高而基本无明显变变化,则提纯操作为:在烧杯中加水溶解,蒸发浓缩,得到较高温度下的KNO3饱和溶液,冷却结晶,利用溶解度差异使KNO3结晶析出,过滤,洗涤,干燥可得KNO3晶体。
A、操作Ⅰ是溶解,将固体溶于水,故A错误;B、操作Ⅱ为蒸发浓缩、冷却结晶,与NaCl分离,故B错误;C、操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来,故C正确;D、操作Ⅰ~Ⅲ总共只需一次过滤操作,只有Ⅲ为过滤,故D错误。故选C。
12.【答案】A
【解析】A、在溶解度曲线图上,横坐标是温度,纵坐标是溶解度;溶解度是一定温度下,100 g溶剂里达到饱和时,所溶解的溶质的质量,30 ℃时,硝酸钾的溶解度为45.8 g,则30 ℃时,100 g水中最多溶解KNO3固体45.8 g,正确;B、NaNO3的溶解度随温度的降低而减小,硝酸钠的饱和溶液降温一定有晶体析出,但是未注明溶液的状态,无法判断是否有晶体析出,错误;C、溶解度受温度影响,温度不同,溶解度不同,不指明温度,不能比较溶解度的大小,错误;D、由图可知NaCl的溶解度受温度影响比KCl小,错误。故选A。
13.【答案】B
【解析】由于不知道甲、乙饱和溶液的质量关系,无法确定从t2 ℃降温到t1 ℃时,析出晶体的多少,A项错误;甲溶液中混有少量乙,由于物质甲的溶解度受温度变化的影响比较大,而物质乙的溶解度受温度变化的影响比较小,故可采用先蒸发浓缩使甲溶液达到饱和,再降温结晶将甲析出,而乙物质在溶液中未析出被除去,B项正确;t1 ℃时,甲、乙的溶解度相同,则甲、乙的饱和溶液溶质质量分数相等,但未指明溶液的状态,C项错误;t2 ℃时甲物质的饱和溶液,可设溶质为30 g,则溶剂为100 g,溶质质量分数低于30%, D项错误。
14.【答案】A
15.【答案】(15分)
(1)煮沸(2分)
(2)①M(3分) D(2分) 相等(2分)
②40(2分) 4(2分)
(3)3∶5(2分)
【解析】(1)生活中常用煮沸的方法将硬水进行软化。(2)①将等质量的甲、乙固体分别加入到盛有100 g水的A、B、C、D烧杯中,充分搅拌后,其现象如图1所示,甲烧杯有固体剩余,乙烧杯没有,20 ℃时,乙的溶解度大于甲的溶解度,所以图2中表示甲物质的溶解度曲线的为M,M、N物质的溶解度随温度的升高而增大,D烧杯中的溶液相当于B烧杯中的溶液升温形成的,B烧杯中的溶液即使是饱和溶液,升温后也会变成不饱和,故四个烧杯中的溶液一定是不饱和溶液的是D;C和D烧杯中溶质相等,溶剂相等,所以两溶液中溶质质量分数相等。②在30 ℃时,乙物质的溶解度为40 g,此温度下,将100 g乙物质的饱和溶液,恒温蒸发10 g水后,可析出乙物质的质量为4 g。(3)在50 ℃时,甲物质的溶解度是60 g,所以50 g甲物质充分溶解在50 g水中,此时形成的溶液中溶质的质量为30 g,故溶质与溶剂的质量比为30 g∶50 g=3∶5。
16.【答案】(11分)
(1)A(2分)
(2)A(1分)
(3)①<(1分)
②Ca(OH)2(1分)
③26.5%(2分)
④减小(2分)
⑤B(2分)
17.【答案】(6分)
(1)③(2分)
(2)①硝酸钾(或KNO3)(2分)
②不饱和溶液(2分)
【解析】(1)测定“某物质在不同温度下的溶解度”,研究的是溶质最多被溶解的质量受温度的影响,这就需要控制其他因素保持不变。(2)①从表中数据可知,氯化钠和硝酸钾两种物质中,溶解度受温度影响较大的是硝酸钾。②20 ℃时,NaCl的溶解度大于KNO3的溶解度,故烧杯甲中是硝酸钾,因为乙烧杯中的物质全部溶解,则加入的物质最多是36 g,而50 ℃时,硝酸钾的溶解度是85.5 g,故50 ℃时甲烧杯中的溶液一定是不饱和溶液。
18.【答案】(1)c(2分)
(2)b(2分)
(3)不饱和(2分)
(4)A(2分)
【解析】(1)三种物质的溶解度随着温度升高而减小的是c。(2)t2 ℃时,物质a的溶解度与物质b的相等。(3)t3 ℃时,a物质溶解度是50 g,即100 g水中能溶解50 g物质a,则80 g物质a加入到200 g水中充分搅拌、静置,形成的是不饱和溶液。(4)t3 ℃时,将等质量a和b的饱和溶液降到t1 ℃时,析出晶体的质量关系正确的是a>b。
19.【答案】(10分)
(1)饱和(2分)
(2)①20%(2分) 200(2分)
②降温结晶(2分)
③不变(2分)
20.【答案】(8分)
(1)10(2分)
(2)100 mL(2分)
(3)C(2分)
(4)100(2分)
【解析】(1)配制100 g 10% NaCl溶液,需要10 g的NaCl。(2)由于溶剂需要90 mL,所以应选100 mL的量筒。(3)用量筒量取水时,俯视读数,读数比实际量取的液体偏大,则导致配制的溶液浓度偏高。配制溶液过程中,烧杯用少量蒸馏水润洗,会导致溶剂的量增多;称量时游码不在零刻度位置就调节天平平衡,后将游码移动得到读数,称量的质量会偏小;盛装溶液的试剂瓶用蒸馏水润洗,溶剂的量增多;NaCl晶体不纯,导致溶质的质量偏小;②③④⑤都会造成NaCl溶液浓度小于10%。故选C。(4)根据溶液稀释的原理,可以算出100 g ×10% =x×5%,x=200 g,需加水的质量=200 g—100 g=100 g。
单元检测
(满分:100分,时间:60分钟,考试方式:闭卷)
注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
2.回答第I卷时,选出每小题答案后,将答案答在第II卷前的答题表中。
3.回答第II卷时,将答案直接写在本试卷上。
第Ⅰ卷
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2019·海南)下列厨房用品在水中能形成溶液的是
A.芝麻油 B.面粉 C.蔗糖 D.黄豆酱
2.在试管中加入少量碘粒,再加入适量的汽油,振荡,静置,观察到的现象为
A. B. C. D.
3.下列选项符合图示从属关系的是
4.清洗餐具上的油污,使用的物质和原理(括号内为原理)均正确的是
A.洗洁精(乳化) B.水(溶解)
C.汽油(溶解) D.酒精(反应)
5.(2019·福建)某同学模拟闽籍化学家侯德榜的“侯氏制碱法”制纯碱,需用50.0 g水配制20 ℃的NaCl饱和溶液(20 ℃时NaCl的溶解度为36.0 g),应称取NaCl的质量为
A.18.0 g B.16.0 g C.13.2 g D.11.5 g
6.现有100g20%氯化钠溶液,想把质量分数稀释到5%,则需加水的质量为
A.100 g B.200 g
C.250 g D.300 g
7.下表是NaCl、KNO3在不同温度时的溶解度:
据此数据,下列说法正确的是
A.20 ℃时,将20 g NaCl加入50 g水中,得到70 g溶液
B.50 ℃时,KNO3溶液的溶质质量分数大于NaCl溶液的溶质质量分数
C.降温时,KNO3溶液析出的固体质量大于NaCl溶液析出的固体质量
D.NaCl和KNO3的溶解度曲线在20 ℃~30 ℃之间相交
8.下列关于溶液的说法,正确的是
A.把少量花生油加入水中,搅拌可形成悬浊液
B.可用水鉴别硝酸铵、氢氧化钠两种固体
C.洗涤剂去油污的原理是洗涤剂溶解了油污
D.溶液中的溶质以分子或离子的形式均匀分散在溶剂中,并保持静止不动,因此,溶液具有均一性和稳定性
9.(2019·舟山)硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是
A.操作Ⅰ一定是降温
B.①与②的溶液质量一定相等
C.①与③的溶质质量一定相等
D.②与③的溶质质量分数一定相等
10.(2019·衡阳)实验室配制100 g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为100 mL的量筒
11.实验室提纯含少量氯化钠杂质的硝酸钾的过程如下图所示。下列分析正确的是
A.操作Ⅰ是过滤,将固体分离除去
B.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
D.操作Ⅰ~Ⅲ总共需两次过滤
12.(2019·广州)根据溶解度曲线判断,下列说法正确的是
A.30 ℃时,100 g水中最多溶解KNO3固体45.8 g
B.NaNO3溶液降温一定有晶体析出
C.KCl的溶解度比NaCl的大
D.NaCl的溶解度受温度影响比KCl大
13.下图是甲、乙两种固体物质的溶解度曲线图。下列说法中正确的是
A.甲、乙的饱和溶液从t2 ℃降温到t1 ℃,甲析出晶体多
B.甲溶液中混有少量的乙,采用先蒸发浓缩,后降温结晶的方法提纯甲
C.t1 ℃时,甲、乙溶液的溶质质量分数相等
D.t2 ℃时甲物质的饱和溶液的溶质质量分数为30%
14.(2019·雅安)ZnSO4饱和溶液的溶质质量分数随温度变化的曲线如图所示。下列说法正确的是
A.N点对应的ZnSO4溶液升温或降温均都可能析出晶体
B.M点对应的ZnSO4溶液是不饱和溶液
C.ZnSO4饱和溶液的溶质质量分数随温度升高而增大
D.40 ℃时,ZnSO4的溶解度为41 g
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
第Ⅱ卷
二、非选择题:本题包括6个小题,共58分。
15.(15分)水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)生活中常用_____________的方法将硬水进行软化。
(2)如图为甲、乙两种物质的溶解情况及溶解度曲线。
①将等质量的甲、乙固体分别加入到盛有100 g水的A、B、C、D烧杯中,充分搅拌后,其现象如图1所示,图2中表示甲物质的溶解度曲线的为___________(填“M”或“N”); 四个烧杯中的溶液一定是不饱和溶液的是_____________(填字母编号);C和D烧杯中两溶液中溶质质量分数_____________(填“相等”或“不相等”)。
②在30 ℃时,乙物质的溶解度为_____________g;此温度下,将100 g乙物质的饱和溶液,恒温蒸发10 g水后,可析出乙物质的质量为_____________g。
(3)在50 ℃时,50 g甲物质充分溶解在50 g水中,此时形成的溶液中溶质与溶剂的质量比为_____________(填最简整数比)。
16.(11分)溶液与人们的生活息息相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填字母)。
A.高锰酸钾
B.汽油
C.面粉
(2)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度升高。这种物质是______(填字母)。
A.烧碱
B.硝酸铵
C.氯化钠
(3)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃
0
20
40
60
80
100
溶解度/g
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾
13.3
31.6
63.9
110
169
246
氢氧化钙
0.19
0.17
0.14
0.12
0.09
0.08
①60 ℃时,氯化钠的溶解度_______硝酸钾的溶解度(填“>”“=”或“<”)。
②表中某物质的饱和溶液随温度升高析出固体,该物质是_____________(填化学式)。
③20 ℃时,氯化钠饱和溶液中溶质的质量分数为________(结果保留至0.1%)。
④向20 ℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20 ℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量__________(填“增大”“不变”或“减小”)。
⑤混有少量氯化钠的硝酸钾固体,加水配成80 ℃的硝酸钾饱和溶液,再冷却至20 ℃,析出晶体并得到溶液。下列有关说法中正确的是_______(填字母)。
A.析出的晶体中不一定含有硝酸钾
B.所得溶液一定是硝酸钾饱和溶液
C.上述方法可以将两种物质完全分离
17.(6分)控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________(填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)下表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃)
20
40
50
溶解度/g
NaCl
36.0
36.6
37.0
KNO3
31.6
63.9
85.5
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________。
②20 ℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50 ℃时如图2所示。试判断:50 ℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
18.(8分)如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是____________。
(2)t2 ℃时,物质a的溶解度与物质____________的相等。
(3)t3 ℃时,把80 g物质a加入到200 g水中充分搅拌、静置,形成的是____________溶液(填“饱和”或“不饱和”)。
(4)t3 ℃时,将等质量a和b的饱和溶液降到t1 ℃时,析出晶体的质量关系正确的是________(填字母序号)。
A.a>b B.a=b
C.a19.(10分)从海水中提取食盐的方法主要为盐田法,这是一种古老而至今仍广泛沿用的方法。海水晒盐的流程如下:
(1)海水晒盐后得到的母液是当时温度下氯化钠的________________溶液(填“饱和”或“不饱和”)。
(2)如图是A、B两种物质的溶解度曲线,回答下列问题:
①t2 ℃时,A的饱和溶液中溶质的质量分数为________________。t2 ℃时,若将50 g A配成饱和溶液,应加水________________g。
②若A物质中含有少量B物质,可用____________的方法提纯A(选填“降温结晶”、“蒸发结晶”之一)。
③将t2 ℃时B的饱和溶液降低温度,溶液中溶质的质量分数________(填“变大”、“变小”或“不变”)。
20.(8分)下图是配制100 g 10% NaCl溶液的操作过程示意图。试回答:
(1)B操作中应称量NaCl的质量为______________g。
(2)D操作应选用______________规格的量筒(从50 mL、100 mL中选择)。
(3)配制溶液过程中,导致NaCl溶液浓度小于10%的原因可能是______________(填序号)。
①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘称取氯化钠时,游码不在零刻度位置就调节天平平衡,后将游码移动得到读数;④盛装溶液的试剂瓶用蒸馏水润洗;⑤NaCl晶体不纯。
A.①②③④⑤ B.只有①②④⑤
C.只有②③④⑤ D.只有①②③
(4)现将配好的100 g 10% NaCl溶液稀释为5%NaCl溶液,需加水______________g。
第九单元 溶液
单元检测参考答案
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
C
B
A
A
A
D
D
B
D
A
C
A
B
A
1.【答案】C
2.【答案】B
【解析】碘粒能溶解于汽油,形成溶液,溶液具有均一性和稳定性。振荡,静置,观察到的现象为B。
3.【答案】A
【解析】A、单质包括稀有气体单质、金属单质、非金属单质,正确;B、溶液与乳浊液是并列关系,无从属关系,错误;C、纯净物中包括化合物,错误;D、化石燃料包括石油、煤、天然气,错误。故选A。
4.【答案】A
5.【答案】A
【解析】20 ℃时NaCl的溶解度为36.0 g,即100 g水中最多溶解36.0 g氯化钠固体。那么50 g水中最多溶解18.0 g氯化钠固体。故选A。
6.【答案】D
【解析】,将100 g 20%氯化钠溶液稀释到5%,溶液的稀释过程中溶质的质量不变,所以设稀释后溶液的质量为x,100 g×20%=5%×x,解得:x=400 g,加水的质量为:400 g-100 g=300 g。故选D。
7.【答案】D
【解析】A、20 ℃时,NaCl的溶解度是36.0 g,因此50 g水中最多溶解18.0 g NaCl,得到68 g溶液。故错误;B、50 ℃时,KNO3与NaCl溶液是否饱和不清楚,无法判定,故错误;C、KNO3与NaCl溶液是否饱和不清楚,无法判定,故错误;D、分析图表,KNO3和NaCl的溶解度在20 ℃~30 ℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,正确。故选D。
8.【答案】B
【解析】A、植物油不溶于水,分散质是液体,不属于悬浊液,属于乳浊液,错误;B、硝酸铵、氢氧化钠两种固体溶于水分别吸热、放热,温度分别降低、升高,可以鉴别,正确;C、洗涤剂去除油污,是利用了洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,是利用了乳化作用,错误;D、溶液中的溶质以分子或离子的形式均匀分散在溶剂中,但是仍保持不停的运动,错误。故选B。
9.【答案】D
【解析】A、操作Ⅰ是将不饱和溶液转化为饱和溶液,不一定是降温,也可能是增加溶质、蒸发溶剂,错误;B、操作Ⅰ是将不饱和溶液转化为饱和溶液,②是饱和溶液,若采用的是增加溶质的方法,溶液的质量不相等,错误;C、①是一定温度下的不饱和溶液,②转化为③的过程中,有硝酸钾析出,①与③的溶质质量不一定相等,错误;D、②与③均为相同温度下的饱和溶液,溶质质量分数一定相等,正确。故选D。
10.【答案】A
11.【答案】C
【解析】提纯混有NaCl的KNO3,应将它们都溶于水,因为KNO3的溶解度随温度的升高而升高,NaCl的溶解度随温度的升高而基本无明显变变化,则提纯操作为:在烧杯中加水溶解,蒸发浓缩,得到较高温度下的KNO3饱和溶液,冷却结晶,利用溶解度差异使KNO3结晶析出,过滤,洗涤,干燥可得KNO3晶体。
A、操作Ⅰ是溶解,将固体溶于水,故A错误;B、操作Ⅱ为蒸发浓缩、冷却结晶,与NaCl分离,故B错误;C、操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来,故C正确;D、操作Ⅰ~Ⅲ总共只需一次过滤操作,只有Ⅲ为过滤,故D错误。故选C。
12.【答案】A
【解析】A、在溶解度曲线图上,横坐标是温度,纵坐标是溶解度;溶解度是一定温度下,100 g溶剂里达到饱和时,所溶解的溶质的质量,30 ℃时,硝酸钾的溶解度为45.8 g,则30 ℃时,100 g水中最多溶解KNO3固体45.8 g,正确;B、NaNO3的溶解度随温度的降低而减小,硝酸钠的饱和溶液降温一定有晶体析出,但是未注明溶液的状态,无法判断是否有晶体析出,错误;C、溶解度受温度影响,温度不同,溶解度不同,不指明温度,不能比较溶解度的大小,错误;D、由图可知NaCl的溶解度受温度影响比KCl小,错误。故选A。
13.【答案】B
【解析】由于不知道甲、乙饱和溶液的质量关系,无法确定从t2 ℃降温到t1 ℃时,析出晶体的多少,A项错误;甲溶液中混有少量乙,由于物质甲的溶解度受温度变化的影响比较大,而物质乙的溶解度受温度变化的影响比较小,故可采用先蒸发浓缩使甲溶液达到饱和,再降温结晶将甲析出,而乙物质在溶液中未析出被除去,B项正确;t1 ℃时,甲、乙的溶解度相同,则甲、乙的饱和溶液溶质质量分数相等,但未指明溶液的状态,C项错误;t2 ℃时甲物质的饱和溶液,可设溶质为30 g,则溶剂为100 g,溶质质量分数低于30%, D项错误。
14.【答案】A
15.【答案】(15分)
(1)煮沸(2分)
(2)①M(3分) D(2分) 相等(2分)
②40(2分) 4(2分)
(3)3∶5(2分)
【解析】(1)生活中常用煮沸的方法将硬水进行软化。(2)①将等质量的甲、乙固体分别加入到盛有100 g水的A、B、C、D烧杯中,充分搅拌后,其现象如图1所示,甲烧杯有固体剩余,乙烧杯没有,20 ℃时,乙的溶解度大于甲的溶解度,所以图2中表示甲物质的溶解度曲线的为M,M、N物质的溶解度随温度的升高而增大,D烧杯中的溶液相当于B烧杯中的溶液升温形成的,B烧杯中的溶液即使是饱和溶液,升温后也会变成不饱和,故四个烧杯中的溶液一定是不饱和溶液的是D;C和D烧杯中溶质相等,溶剂相等,所以两溶液中溶质质量分数相等。②在30 ℃时,乙物质的溶解度为40 g,此温度下,将100 g乙物质的饱和溶液,恒温蒸发10 g水后,可析出乙物质的质量为4 g。(3)在50 ℃时,甲物质的溶解度是60 g,所以50 g甲物质充分溶解在50 g水中,此时形成的溶液中溶质的质量为30 g,故溶质与溶剂的质量比为30 g∶50 g=3∶5。
16.【答案】(11分)
(1)A(2分)
(2)A(1分)
(3)①<(1分)
②Ca(OH)2(1分)
③26.5%(2分)
④减小(2分)
⑤B(2分)
17.【答案】(6分)
(1)③(2分)
(2)①硝酸钾(或KNO3)(2分)
②不饱和溶液(2分)
【解析】(1)测定“某物质在不同温度下的溶解度”,研究的是溶质最多被溶解的质量受温度的影响,这就需要控制其他因素保持不变。(2)①从表中数据可知,氯化钠和硝酸钾两种物质中,溶解度受温度影响较大的是硝酸钾。②20 ℃时,NaCl的溶解度大于KNO3的溶解度,故烧杯甲中是硝酸钾,因为乙烧杯中的物质全部溶解,则加入的物质最多是36 g,而50 ℃时,硝酸钾的溶解度是85.5 g,故50 ℃时甲烧杯中的溶液一定是不饱和溶液。
18.【答案】(1)c(2分)
(2)b(2分)
(3)不饱和(2分)
(4)A(2分)
【解析】(1)三种物质的溶解度随着温度升高而减小的是c。(2)t2 ℃时,物质a的溶解度与物质b的相等。(3)t3 ℃时,a物质溶解度是50 g,即100 g水中能溶解50 g物质a,则80 g物质a加入到200 g水中充分搅拌、静置,形成的是不饱和溶液。(4)t3 ℃时,将等质量a和b的饱和溶液降到t1 ℃时,析出晶体的质量关系正确的是a>b。
19.【答案】(10分)
(1)饱和(2分)
(2)①20%(2分) 200(2分)
②降温结晶(2分)
③不变(2分)
20.【答案】(8分)
(1)10(2分)
(2)100 mL(2分)
(3)C(2分)
(4)100(2分)
【解析】(1)配制100 g 10% NaCl溶液,需要10 g的NaCl。(2)由于溶剂需要90 mL,所以应选100 mL的量筒。(3)用量筒量取水时,俯视读数,读数比实际量取的液体偏大,则导致配制的溶液浓度偏高。配制溶液过程中,烧杯用少量蒸馏水润洗,会导致溶剂的量增多;称量时游码不在零刻度位置就调节天平平衡,后将游码移动得到读数,称量的质量会偏小;盛装溶液的试剂瓶用蒸馏水润洗,溶剂的量增多;NaCl晶体不纯,导致溶质的质量偏小;②③④⑤都会造成NaCl溶液浓度小于10%。故选C。(4)根据溶液稀释的原理,可以算出100 g ×10% =x×5%,x=200 g,需加水的质量=200 g—100 g=100 g。
同课章节目录
