课题2 原子的构成课件(18张PPT)
文档属性
| 名称 | 课题2 原子的构成课件(18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-20 23:38:31 | ||
图片预览




文档简介
(共18张PPT)
课题2 原子的结构
2012版《义务教育教科书化学9年级上册》
第一课时 原子的构成
1964年10月16日我国成功爆炸第一颗原子弹。原子弹爆炸的威力非常惊人。
为什么原子弹爆炸会产生如此巨大的能量呢?我们这节课一起来学习原子构成的奥秘。
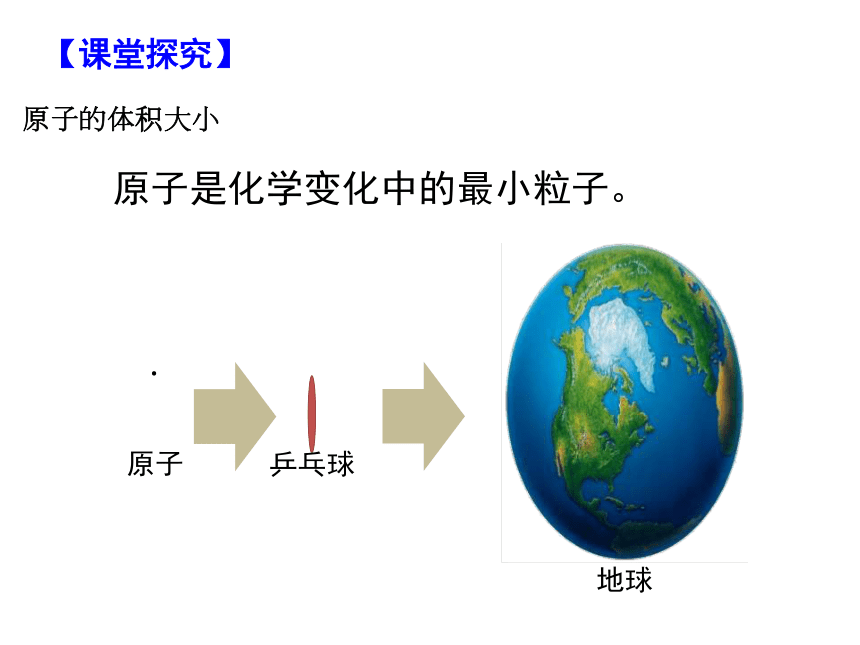
【课堂探究】
原子的体积大小
原子是化学变化中的最小粒子。
.
原子
乒乓球
地球
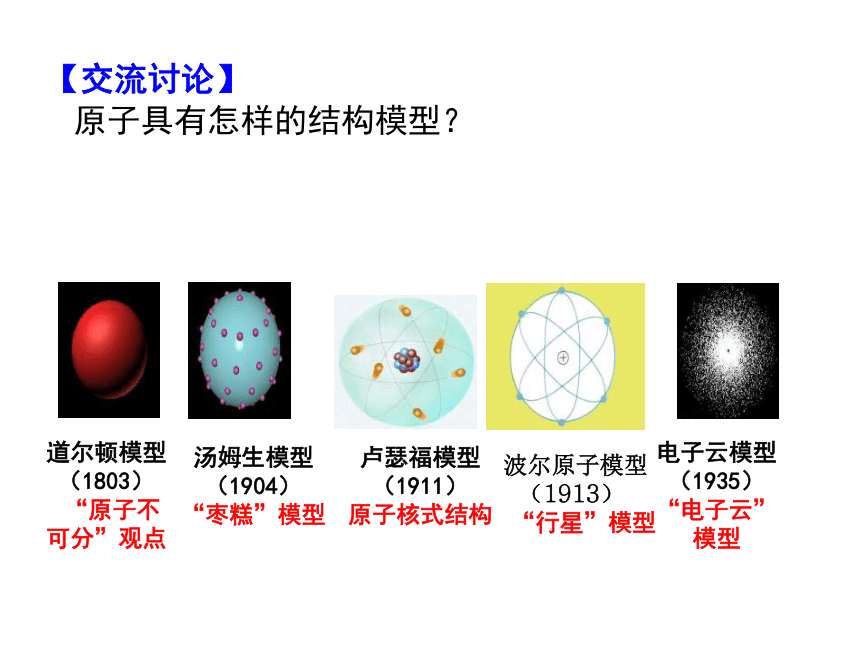
【交流讨论】
原子具有怎样的结构模型?
道尔顿模型
(1803)
“原子不可分”观点
汤姆生模型
(1904)
“枣糕”模型
卢瑟福模型
(1911)
原子核式结构
电子云模型
(1935)
“电子云”模型
波尔原子模型
(1913)
“行星”模型
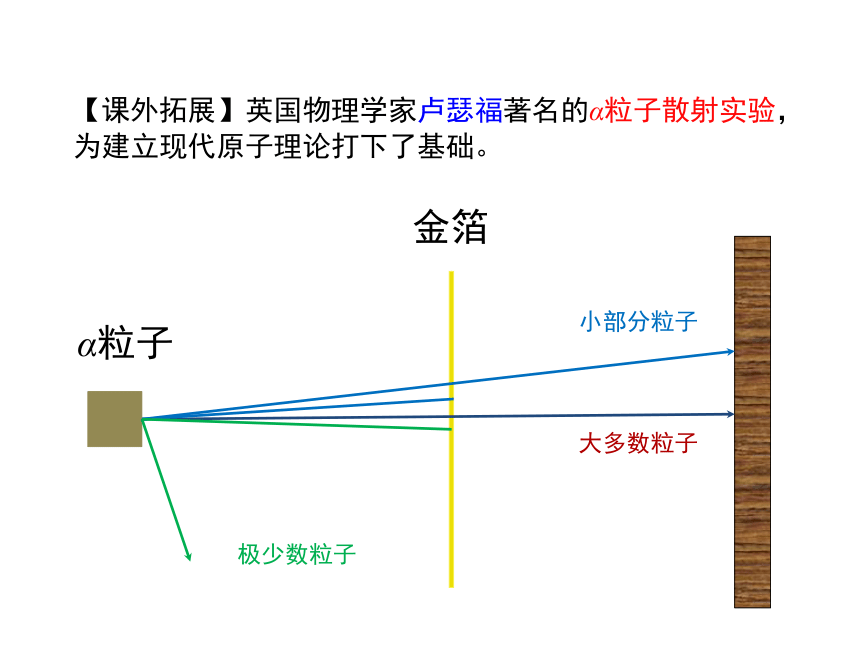
【课外拓展】英国物理学家卢瑟福著名的α粒子散射实验,为建立现代原子理论打下了基础。
金箔
α粒子
大多数粒子
小部分粒子
极少数粒子
一
原子是怎样构成的?
【智慧阅读】阅读书P53并讨论:
1. 原子是由哪几个部分构成的?
2. 原子核由哪几种粒子构成?
3. 原子中各种粒子带电情况如何?
4. 什么叫核电荷数?它与质子数有什么关系?
5.整个原子显电性吗?为什么?
+
+
+
原子是由居于中心的原子核和核外电子构成的。
原子核是由质子和中子构成的。
每个电子带1单位负电荷
每个质子带
1单位正电荷
不带电
原子不显电性。
核电荷数:原子核所带的正电荷数(核电荷数=质子数)。
【特别提醒】整个原子不显电性并不说明原子中没有带电粒子,而是质子所带电荷与电子所带电荷数量相等,电性相反。
(2).下列粒子不显电性的是( )
A.质子 B.电子 C.原子核 D.分子
(1)原子核( )。
A.由电子和质子构成 B.由质子和中子构成
C.由电子和中子构成 D.由质子、中子和电子构成
【随堂练习】
B
D
观察表3-1中不同原子中各微粒的数目,你能找出哪些规律?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
【分组讨论】
原子中:1.质子数==核外电子数
2.质子数不一定等于中子数。
3.不是所有的原子都有中子(氢原子没有中子)
4.不同原子,质子数不同。
【典例解析】
例 下列关于原子结构的叙述正确的是( )
A.一切原子的原子核都由质子和中子构成
B.在原子中,核电荷数一定等于质子数或核外电子数
C.原子核内质子数一定等于中子数
D.原子是不能再分的粒子
B
×
√
×
×
【课堂反馈】
1.填空题
填写表格中的空格
原子
种类 核电
荷数 质子数 中子数 核外
电子数
氧 8 8
硫 16 16
镁 12 12
8
8
16
16
12
12
2.选择题
(1)下列说法中正确的是( )。
A.原子核内的质子数与其核电荷数相等
B.原子核中的质子数与中子数一定相等
C.原子核一定由质子和中子构成
D.原子核位于原子中央、体积较大
(2)在原子里质子数等于( )。
A.中子数 B.电子数
C.中子数和电子数之和 D.中子数和电子数之差
A
B
3.以氧原子为例回答问题:构成原子的粒子有哪几种?它们是怎样构成原子的?为什么整个原子不显电性?
答:构成原子的粒子有质子、中子和电子。在氧原子中由8个质子和8个中子构成原子核,有8个电子在核外一定空间内高速运动。质子带1个单位正电荷,中子不显电性,电子带1个单位的负电荷。原子中,核电荷数=质子数=核外电子数,由于整个原子中正负电荷数相等,所以整个原子不显电性。
这节课你学到了哪些知识?
【课堂总结】
1.原子不是实心球体。
2.原子是由居于原子中心带正电的原子核和核外带负电的电子构成的。
3.质子带一个单位的正电荷、电子带一个单位的负电荷、中子不带电。
4.核电荷数:原子核所带的正电荷数(核电荷数=质子数)。
5.由于原子核带的正电荷(即核电荷数)等于核外电子数,正电荷总数等于负电荷总数,所以整个原子不显电性。
【教学板书】
课题2 原子的结构
第1课时 原子的构成
1.原子的构成
【课后作业】
以“行走在原子的内部”为题,写一篇重点介绍原子的构成知识风景的游记。要求至少200字。
谢谢!
课题2 原子的结构
2012版《义务教育教科书化学9年级上册》
第一课时 原子的构成
1964年10月16日我国成功爆炸第一颗原子弹。原子弹爆炸的威力非常惊人。
为什么原子弹爆炸会产生如此巨大的能量呢?我们这节课一起来学习原子构成的奥秘。
【课堂探究】
原子的体积大小
原子是化学变化中的最小粒子。
.
原子
乒乓球
地球
【交流讨论】
原子具有怎样的结构模型?
道尔顿模型
(1803)
“原子不可分”观点
汤姆生模型
(1904)
“枣糕”模型
卢瑟福模型
(1911)
原子核式结构
电子云模型
(1935)
“电子云”模型
波尔原子模型
(1913)
“行星”模型
【课外拓展】英国物理学家卢瑟福著名的α粒子散射实验,为建立现代原子理论打下了基础。
金箔
α粒子
大多数粒子
小部分粒子
极少数粒子
一
原子是怎样构成的?
【智慧阅读】阅读书P53并讨论:
1. 原子是由哪几个部分构成的?
2. 原子核由哪几种粒子构成?
3. 原子中各种粒子带电情况如何?
4. 什么叫核电荷数?它与质子数有什么关系?
5.整个原子显电性吗?为什么?
+
+
+
原子是由居于中心的原子核和核外电子构成的。
原子核是由质子和中子构成的。
每个电子带1单位负电荷
每个质子带
1单位正电荷
不带电
原子不显电性。
核电荷数:原子核所带的正电荷数(核电荷数=质子数)。
【特别提醒】整个原子不显电性并不说明原子中没有带电粒子,而是质子所带电荷与电子所带电荷数量相等,电性相反。
(2).下列粒子不显电性的是( )
A.质子 B.电子 C.原子核 D.分子
(1)原子核( )。
A.由电子和质子构成 B.由质子和中子构成
C.由电子和中子构成 D.由质子、中子和电子构成
【随堂练习】
B
D
观察表3-1中不同原子中各微粒的数目,你能找出哪些规律?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
【分组讨论】
原子中:1.质子数==核外电子数
2.质子数不一定等于中子数。
3.不是所有的原子都有中子(氢原子没有中子)
4.不同原子,质子数不同。
【典例解析】
例 下列关于原子结构的叙述正确的是( )
A.一切原子的原子核都由质子和中子构成
B.在原子中,核电荷数一定等于质子数或核外电子数
C.原子核内质子数一定等于中子数
D.原子是不能再分的粒子
B
×
√
×
×
【课堂反馈】
1.填空题
填写表格中的空格
原子
种类 核电
荷数 质子数 中子数 核外
电子数
氧 8 8
硫 16 16
镁 12 12
8
8
16
16
12
12
2.选择题
(1)下列说法中正确的是( )。
A.原子核内的质子数与其核电荷数相等
B.原子核中的质子数与中子数一定相等
C.原子核一定由质子和中子构成
D.原子核位于原子中央、体积较大
(2)在原子里质子数等于( )。
A.中子数 B.电子数
C.中子数和电子数之和 D.中子数和电子数之差
A
B
3.以氧原子为例回答问题:构成原子的粒子有哪几种?它们是怎样构成原子的?为什么整个原子不显电性?
答:构成原子的粒子有质子、中子和电子。在氧原子中由8个质子和8个中子构成原子核,有8个电子在核外一定空间内高速运动。质子带1个单位正电荷,中子不显电性,电子带1个单位的负电荷。原子中,核电荷数=质子数=核外电子数,由于整个原子中正负电荷数相等,所以整个原子不显电性。
这节课你学到了哪些知识?
【课堂总结】
1.原子不是实心球体。
2.原子是由居于原子中心带正电的原子核和核外带负电的电子构成的。
3.质子带一个单位的正电荷、电子带一个单位的负电荷、中子不带电。
4.核电荷数:原子核所带的正电荷数(核电荷数=质子数)。
5.由于原子核带的正电荷(即核电荷数)等于核外电子数,正电荷总数等于负电荷总数,所以整个原子不显电性。
【教学板书】
课题2 原子的结构
第1课时 原子的构成
1.原子的构成
【课后作业】
以“行走在原子的内部”为题,写一篇重点介绍原子的构成知识风景的游记。要求至少200字。
谢谢!
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
