人教版初中化学九年级下专题训练,同步练习,复习补习资料:专题9.3.3 溶解度曲线的综合应用(第3课时)
文档属性
| 名称 | 人教版初中化学九年级下专题训练,同步练习,复习补习资料:专题9.3.3 溶解度曲线的综合应用(第3课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 388.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-20 00:00:00 | ||
图片预览



文档简介
第九单元 溶液
课题3 溶液的浓度
知识
一、溶解度
1.定义
在一定温度下,某固态物质在________g溶剂里达到_________________时所溶解的质量,叫做这种固态物质在这种溶剂里的溶解度。如果不说明溶剂,通常所说的溶解度是指物质在_________里的溶解度。
2.饱和溶液中溶质、溶剂和溶液间的质量关系
(1)溶质质量∶溶剂质量∶饱和溶液质量=____________∶____________∶____________。
(2)。
(3)。
二、溶解度曲线
1.概念
在平面直角坐标系中用横坐标表示___________,纵坐标表示___________,通过实验测出某物质在不同温度下的___________,用坐标点来表示,并将这些坐标点连接成一条平滑的曲线,这条曲线就称为溶解度曲线。
2.溶解度曲线的意义
(1)溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度变化的情况。
(2)溶解度曲线上的每一个点表示溶质在某温度下的溶解度,此时的溶液必然是________溶液。
(3)两条曲线的交叉点表示两种溶质在___________下具有相同的___________。
(4)在溶解度曲线下方的点,则表示溶液是___________溶液。
(5)在溶解度曲线上方靠近曲线的点表示过饱和溶液(在较高温度下制成饱和溶液,慢慢地降到室温,溶液中溶解的溶质质量超过室温时的溶解度,但尚未析出晶体,这时该溶液叫做过饱和溶液)。
3.溶解度曲线的变化规律
(1)陡升型
大多数固体物质的溶解度随温度的升高而明显增大,如硝酸钾。从溶液中析出该物质时,可采取___________的方法,使该物质的不饱和溶液变为饱和溶液。
(2)缓升型
少数固体物质的溶解度受温度的影响不大,如氯化钠。从溶液中析出该物质时,可采取___________的方法;并可采取___________的方法,使该物质的不饱和溶液变为饱和溶液。
(3)下降型
极少数固体物质的溶解度随温度的升高而减少,如氢氧化钙。从溶液中析出该物质时,可采用___________的方法;并可通过___________的方法,使该物质的不饱和溶液变为饱和溶液。
【答案】一、1.100 饱和状态 水
2.(1)溶解度 100 g (100 g +溶解度)
二、1.温度 溶解度 溶解度
2.(2)饱和
(3)某一温度 溶解度
(4)不饱和
3.(1)降温结晶
(2)蒸发结晶 蒸发溶剂
(3)升温结晶 升温
重点
1.查出某物质在不同温度时的溶解度。
2.比较某一温度下两种物质的溶解度的大小。
3.可以确定温度对溶解度的影响状况。
4.根据溶解度曲线可以确定怎样制得某温度下的某物质的饱和溶液。
5.确定某种物质从溶液中结晶的方法。
(1)蒸发溶剂结晶:一般适用于溶解度随温度变化不大的物质。如从氯化钠溶液中得到氯化钠晶体。
(2)冷却热饱和溶液结晶:一般适用于溶解度随温度变化较大的物质。如从硝酸钾饱和溶液中得到硝酸钾晶体。
6.根据溶解度曲线,计算一定温度下,某物质的饱和溶液的溶质质量分数,溶质质量分数=。
7.相同质量的两种饱和溶液,若从相同温度下降温到相同温度时,溶解度变化大的析出晶体多。
8.根据溶解度曲线随温度的变化,确定溶液溶质质量分数的变化。
(1)若改变温度,溶解度增大,则该溶液的溶质质量分数保持不变,若为饱和溶液,改变条件后溶液的浓度仍为原饱和溶液的浓度,可以根据原温度下的溶解度进行计算,溶质质量分数= ×100%。
(2)若改变温度,溶解度减小,则饱和溶液有溶质析出,溶质质量分数减小,但仍为饱和溶液,此时溶质质量分数用该温度下的溶解度进行计算,溶质质量分数=×100%。
(3)若改变温度,溶解度减小,则m g饱和溶液析出溶质的质量=m g×。
9.根据一定温度下溶解度的大小,判断相同质量的不同溶质完全溶解需要水的质量,溶解度越大说明溶解能力越大,溶解时需要的水越少。若溶质的质量为m g,完全溶解时(恰好饱和)需要水的量= m g×,形成的饱和溶液的质量== m g×。
10.根据溶解度比较饱和溶液溶质质量分数分数大小。不同条件下的饱和溶液,溶质的质量分数只与溶解度大小有关,溶解度越大,溶质的质量分数越大。
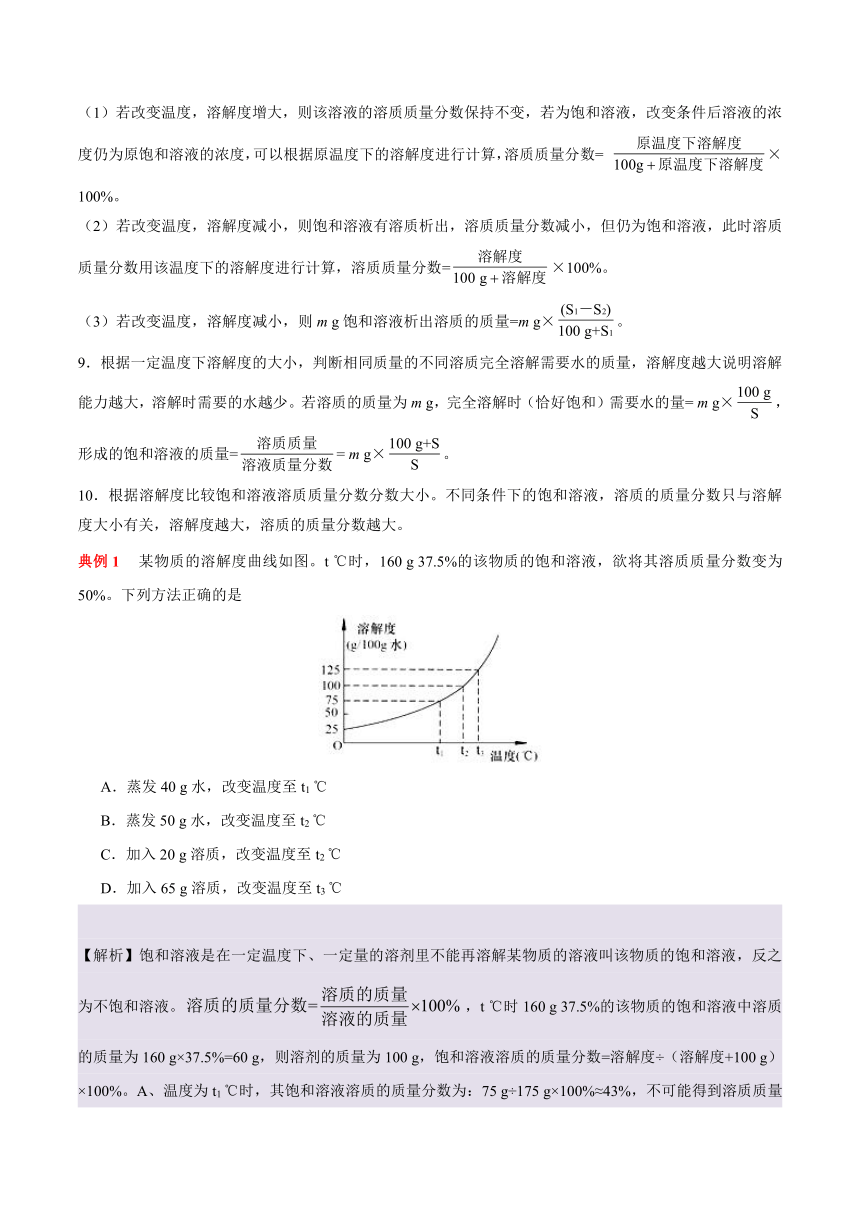
典例1 某物质的溶解度曲线如图。t ℃时,160 g 37.5%的该物质的饱和溶液,欲将其溶质质量分数变为50%。下列方法正确的是
A.蒸发40 g水,改变温度至t1 ℃
B.蒸发50 g水,改变温度至t2 ℃
C.加入20 g溶质,改变温度至t2 ℃
D.加入65 g溶质,改变温度至t3 ℃
【解析】饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。,t ℃时160 g 37.5%的该物质的饱和溶液中溶质的质量为160 g×37.5%=60 g,则溶剂的质量为100 g,饱和溶液溶质的质量分数=溶解度÷(溶解度+100 g)×100%。A、温度为t1 ℃时,其饱和溶液溶质的质量分数为:75 g÷175 g×100%≈43%,不可能得到溶质质量分数为50%的溶液,错误;B、t2 ℃该物质饱和溶液溶质的质量分数=100 g÷200 g×100%=50%,将160 g 37.5%的溶液蒸发50 g水后,溶液溶质的质量分数为 60 g÷110 g×100%≈54.5%,即有溶质析出得t2 ℃时的饱和溶液,质量分数为50%,正确;C、t2 ℃,该物质的溶解度为100 g,所以加入20 g溶质后能完全溶解,溶液溶质的质量分数为80 g÷180 g×100%≈44.4%,错误;D、加入65 g溶质,改变温度至t3 ℃所得溶液为t3 ℃时的饱和溶液,质量分数大于50%,错误。故选B。
【答案】B
典例2 如图是a、b、c三种固体物质的溶解度曲线。据图回答下列问题。
(1)P点表示的含义是_____________________________________________。
(2)将相同质量t2 ℃时的a、b、c饱和溶液的温度降低到t1 ℃时,析出晶体最多的是______。
(3)将t1 ℃时的a、b、c饱和溶液的温度升高到t2 ℃时,溶质质量分数由小到大的顺序是_________。
(4)t2 ℃时,将40 g a物质放入盛有50 g水的烧杯中,所得溶液溶质质量分数为___________。
(5)当a中混有少量b时,可采用______________的方法提纯a。
【解析】(1)P点表示的含义是:在t1 ℃时,a、c溶解度相等为20 g。(2)c的溶解度随温度降低而增大,降温时,变为不饱和溶液,无晶体析出,a、c的溶解度随温度降低而减小,其中a的溶解度受温度影响较大,降温时析出的晶体多。故将相同质量t2 ℃时的a、b、c饱和溶液的温度降低到t1 ℃时,析出晶体最多的是a。(3)温度升高到t2 ℃时,a、b的溶解度增大,溶质质量分数不变,c的溶解度减小,溶质质量分数减小。根据饱和溶液的溶质质量分数=×100%,可知t1 ℃时,a、c的饱和溶液溶质质量分数相等,b的饱和溶液溶质质量分数大于a、c的饱和溶液,故温度升高到t2 ℃时,溶质质量分数由小到大的顺序是c<a<b。(4)t2 ℃时,a的溶解度是50 g,即该温度时,100 g水中最多能溶解50 g a,则50 g水最多能溶解25 g a,所得溶液溶质质量分数为=33.3%。(5)a的溶解度受温度影响较大,对于受温度影响较大的物质用降温结晶的方法提纯。
【答案】(1)t1 ℃时,a、c溶解度相等为20 g
(2)a
(3)c<a<b
(4)33.3%
(5)降温结晶
、
基础训练
1.如图所示是甲物质的溶解度曲线。把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是
A.溶剂的质量一定变小
B.溶液的质量可能不变
C.溶质的质量分数一定变大
D.溶质的质量一定不变
2.如图是a、b、c三种固体物质的溶解度曲线图,下列说法错误的是
A.b物质为易溶物质
B.a、c两物质的溶解度相同
C.温度升高,c物质溶解度减小
D.50 ℃时,a物质的溶解度为50 g
3.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.35 ℃时,甲的饱和溶液的溶质质量分数为60%
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10 ℃时甲、乙两种溶液的溶质质量分数一定相等
4.如图是M、N 两种固体物质的溶解度曲线,下列说法不正确的是
A.M的溶解度受温度影响较大
B.20 ℃时,M、N的溶解度相同
C.40 ℃时,将35 g M加入50 g水中所得溶液的质量为85 g
D.40 ℃时,M、N饱和溶液溶质质量分数大小关系是M>N
5.将质量均为30 g的甲、乙两种固体分别加入到50 g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是
A.甲的溶解度随温度升高而增大
B.t1 ℃时,甲、乙的溶解度均为20 g
C.温度由t2 ℃降低到t1 ℃时,甲溶液析出5 g固体
D.a、b、c三点中溶质的质量分数由大到小的顺序是:c>a>b
6.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t1 ℃时,甲、乙两种溶液的溶质质量分数相同
B.t1 ℃时,取少量甲的饱和溶液,加入少量乙,不能再溶解
C.t1 ℃时,取少量甲的饱和溶液升温到t2 ℃,变成不饱和溶液
D.t2 ℃时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量甲>乙
7.如图是甲、乙两种固体的溶解度曲线。将t3 ℃时相同质量的甲、乙两种物质的饱和溶液降温到t1 ℃,只有甲的溶液中有固体析出。则乙的溶解度曲线为________(填“X”或“Y”);甲和乙的溶解度相等时的温度为______________;t3 ℃时,将30 g 甲的饱和溶液稀释为质量分数为10%的溶液,需加水的质量为________g。
能力提升
8.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.30 ℃时,甲的饱和溶液溶质质量分数为40%
B.20 ℃时,甲、乙的饱和溶液中所含溶质的质量一定相等
C.将等质量的甲、乙固体,分别配成30 ℃的饱和溶液,所需水的质量:甲>乙
D.将20 ℃时甲、乙的饱和溶液升温到30 ℃,所得甲、乙溶液的溶质质量分数相等
9.t ℃时,某固体物质(不含结晶水)的饱和溶液中,溶质质量随溶剂质量的变化如图中斜线所示。下列说法正确是
A.由图可知,温度升高,该物质的溶解度增大
B.由图可知,t ℃时,该物质的溶解度为40
C.N点表示的溶液中,溶质的质量分数为20%
D.P点、Q点表示的溶液中,溶质的质量分数相同
10.如图是A、B、C三种固体物质的溶解度曲线图,请回答:
(1)A、B、C三种物质的溶解度受温度影响最大的是_______。
(2)t1 ℃时,三种物质溶解度由大到小的顺序是____________。
(3)将接近饱和的A溶液变成饱和溶液的方法是_____________。
(4)在t2 ℃时,将15 g C物质加入到50 g水中,充分搅拌后,所得溶液中溶质的质量分数为_______。
真题练习
11.[2019·聊城]如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1 ℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等
B.由t2 ℃降温到t1 ℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C.t2 ℃时,将40 g甲物质加入50 g水中,充分溶解后溶液的质量为90 g
D.t2 ℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多
12.[2019·苏州]氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40 ℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%
D.将20 ℃的硝酸钾饱和溶液升温至60 ℃,溶液的溶质质量分数增大(忽略水分蒸发)
13.[2019·广东] 下图为两物质的溶解度曲线。请回答:
(1)50 ℃时,Na2Cr2O7的溶解度为______g;60 ℃时溶解度:Na2Cr2O7_______Na2SO4(填“<”、“=”、“>”)。
(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃时,析出Na2Cr2O7______g?(假设不含结晶水)。
参考答案
基础训练
1.【答案】B
2.【答案】B
【解析】A、20 ℃时,b的溶解度大于10 g,故b物质为易溶物质,正确;B、在一定的温度下比较物质的溶解度,在20 ℃时a、c两物质的溶解度相同,错误;C、据图可以看出,温度升高,c物质溶解度减小,正确;D、据图可以看出,50 ℃时,a物质的溶解度为50 g,正确。故选B。
3.【答案】C
【解析】A、溶解度的大小与温度有关,错误;B、35 ℃时,甲的溶解度是60 g,故溶质的质量分数为×100%=37.5%,错误;C、甲物质的溶解度随温度的升高而升高,故降低温度可使接近饱和的甲溶液变成饱和溶液,正确;D、10 ℃时甲、乙两种饱和溶液的溶质质量分数一定相等,不饱和的两种溶液中溶质的质量分数不一定相等,错误。故选C。
4.【答案】C
5.【答案】D
【解析】A、纵坐标是剩余固体质量,温度越高,剩余固体越多,表明溶解度是随温度升高而减小的,错误;B、t1 ℃时,剩余固体都是10 g,说明溶解了20 g,甲、乙的溶解度均为40 g,错误;C、温度由t2 ℃降低到t1 ℃时,固体减少5g,应该是溶解了5 g,错误;D、c中剩余固体最少,a中次之,b中剩余固体最多,所以a、b、c三点中溶质的质量分数由大到小的顺序是c>a>b,正确。故选D。
6.【答案】C
【解析】A、t1 ℃时,甲、乙两种物质的溶解度相等,但未指明溶液的状态,故无法比较溶质质量分数的大小,故错误;B、根据饱和溶液的概念可知,t1 ℃时,取少量甲的饱和溶液,加入少量乙,能溶解乙,但不能溶解甲,故错误;C、由图可知,甲的溶解度随温度的升高而增大且变化较大,故t1 ℃时,取少量甲的饱和溶液升温到t2 ℃,变成不饱和溶液,正确;D、由于t2 ℃时甲、乙两种物质的溶解度大小关系是甲>乙,即等质量的水能溶解的溶质质量为甲>乙,所以用等质量的甲、乙配成t2 ℃时饱和溶液所需水的质量是乙>甲,故错误。故选C。
7.【答案】Y t2 ℃ 70
【解析】t3 ℃时相同质量的甲、乙两种物质的饱和溶液降温到t1 ℃,只有甲的溶液中有固体析出,说明甲物质的溶解度随温度的降低而减小,所以乙的溶解度曲线为Y。通过分析溶解度曲线可知,甲和乙的溶解度相等时的温度为t2 ℃。t3 ℃时,甲物质的溶解度是50 g,将30 g甲的饱和溶液稀释为质量分数为10%的溶液,设需加水的质量为x,根据稀释前后溶质质量相等列等式:30 g××100%=(30 g+x)×10%,x =70 g。
能力提升
8.【答案】D
9.【答案】D
【解析】A、该图是饱和溶液中溶质质量与溶剂质量的关系曲线,故无法判断温度升高,该物质的溶解度增大,故A错误;B、由图可知,t ℃时,该物质的溶解度为40 g,故B错误;C、N点表示的溶液中,溶质的质量分数为×100%<20%,故C错误;D、P点、Q点均表示该物质在t ℃时的饱和溶液,溶质的质量分数相同,故D正确。故选D。
10.【答案】(1)A
(2)C>B>A
(3)加溶质(或蒸发溶剂;或降温)
(4)20%
【解析】(1)由物质的溶解度曲线可知,A、B、C三种物质的溶解度受温度影响最大的是A。(2)由物质的溶解度曲线可知,t1 ℃时,三种物质的溶解度由大到小的顺序是C>B>A。(3)将接近饱和的A溶液变成饱和溶液的方法是加溶质或蒸发溶剂等。(4)在t2 ℃时,C的溶解度是25 g,将15 g C物质加入到50 g水中,充分搅拌后,只能够溶解12.5 g,所得溶液是饱和溶液,溶质的质量分数为× 100%=20%。
真题练习
11.【答案】A
【解析】A、一定温度下,饱和溶液溶质的质量分数=×100%,t1 ℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2 ℃时,甲的溶解度为50 g,即100 g水中最多溶解50 g的甲,40 g甲加入50 g水中,充分溶解后只能溶解25 g,所得的溶液质量为75 g,错误;D、t2 ℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。故选A。
12.【答案】C
13.【答案】(1)110 >
(2)50
【解析】(1)由溶解度曲线可知,50 ℃时,Na2Cr2O7的溶解度为110 g;由溶解度曲线可知,60 ℃时,Na2Cr2O7的溶解度曲线位于Na2SO4的上方,故溶解度:Na2Cr2O7>Na2SO4。(2)根据溶解度曲线可知,50 ℃时,Na2Cr2O7的溶解度为110 g;10 ℃时,Na2Cr2O7的溶解度为60 g。结合改变温度,溶解度减小,则m g饱和溶液析出溶质的质量=m g×,在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃时,析出Na2Cr2O7的质量=210 g×=50 g。
课题3 溶液的浓度
知识
一、溶解度
1.定义
在一定温度下,某固态物质在________g溶剂里达到_________________时所溶解的质量,叫做这种固态物质在这种溶剂里的溶解度。如果不说明溶剂,通常所说的溶解度是指物质在_________里的溶解度。
2.饱和溶液中溶质、溶剂和溶液间的质量关系
(1)溶质质量∶溶剂质量∶饱和溶液质量=____________∶____________∶____________。
(2)。
(3)。
二、溶解度曲线
1.概念
在平面直角坐标系中用横坐标表示___________,纵坐标表示___________,通过实验测出某物质在不同温度下的___________,用坐标点来表示,并将这些坐标点连接成一条平滑的曲线,这条曲线就称为溶解度曲线。
2.溶解度曲线的意义
(1)溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度变化的情况。
(2)溶解度曲线上的每一个点表示溶质在某温度下的溶解度,此时的溶液必然是________溶液。
(3)两条曲线的交叉点表示两种溶质在___________下具有相同的___________。
(4)在溶解度曲线下方的点,则表示溶液是___________溶液。
(5)在溶解度曲线上方靠近曲线的点表示过饱和溶液(在较高温度下制成饱和溶液,慢慢地降到室温,溶液中溶解的溶质质量超过室温时的溶解度,但尚未析出晶体,这时该溶液叫做过饱和溶液)。
3.溶解度曲线的变化规律
(1)陡升型
大多数固体物质的溶解度随温度的升高而明显增大,如硝酸钾。从溶液中析出该物质时,可采取___________的方法,使该物质的不饱和溶液变为饱和溶液。
(2)缓升型
少数固体物质的溶解度受温度的影响不大,如氯化钠。从溶液中析出该物质时,可采取___________的方法;并可采取___________的方法,使该物质的不饱和溶液变为饱和溶液。
(3)下降型
极少数固体物质的溶解度随温度的升高而减少,如氢氧化钙。从溶液中析出该物质时,可采用___________的方法;并可通过___________的方法,使该物质的不饱和溶液变为饱和溶液。
【答案】一、1.100 饱和状态 水
2.(1)溶解度 100 g (100 g +溶解度)
二、1.温度 溶解度 溶解度
2.(2)饱和
(3)某一温度 溶解度
(4)不饱和
3.(1)降温结晶
(2)蒸发结晶 蒸发溶剂
(3)升温结晶 升温
重点
1.查出某物质在不同温度时的溶解度。
2.比较某一温度下两种物质的溶解度的大小。
3.可以确定温度对溶解度的影响状况。
4.根据溶解度曲线可以确定怎样制得某温度下的某物质的饱和溶液。
5.确定某种物质从溶液中结晶的方法。
(1)蒸发溶剂结晶:一般适用于溶解度随温度变化不大的物质。如从氯化钠溶液中得到氯化钠晶体。
(2)冷却热饱和溶液结晶:一般适用于溶解度随温度变化较大的物质。如从硝酸钾饱和溶液中得到硝酸钾晶体。
6.根据溶解度曲线,计算一定温度下,某物质的饱和溶液的溶质质量分数,溶质质量分数=。
7.相同质量的两种饱和溶液,若从相同温度下降温到相同温度时,溶解度变化大的析出晶体多。
8.根据溶解度曲线随温度的变化,确定溶液溶质质量分数的变化。
(1)若改变温度,溶解度增大,则该溶液的溶质质量分数保持不变,若为饱和溶液,改变条件后溶液的浓度仍为原饱和溶液的浓度,可以根据原温度下的溶解度进行计算,溶质质量分数= ×100%。
(2)若改变温度,溶解度减小,则饱和溶液有溶质析出,溶质质量分数减小,但仍为饱和溶液,此时溶质质量分数用该温度下的溶解度进行计算,溶质质量分数=×100%。
(3)若改变温度,溶解度减小,则m g饱和溶液析出溶质的质量=m g×。
9.根据一定温度下溶解度的大小,判断相同质量的不同溶质完全溶解需要水的质量,溶解度越大说明溶解能力越大,溶解时需要的水越少。若溶质的质量为m g,完全溶解时(恰好饱和)需要水的量= m g×,形成的饱和溶液的质量== m g×。
10.根据溶解度比较饱和溶液溶质质量分数分数大小。不同条件下的饱和溶液,溶质的质量分数只与溶解度大小有关,溶解度越大,溶质的质量分数越大。
典例1 某物质的溶解度曲线如图。t ℃时,160 g 37.5%的该物质的饱和溶液,欲将其溶质质量分数变为50%。下列方法正确的是
A.蒸发40 g水,改变温度至t1 ℃
B.蒸发50 g水,改变温度至t2 ℃
C.加入20 g溶质,改变温度至t2 ℃
D.加入65 g溶质,改变温度至t3 ℃
【解析】饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。,t ℃时160 g 37.5%的该物质的饱和溶液中溶质的质量为160 g×37.5%=60 g,则溶剂的质量为100 g,饱和溶液溶质的质量分数=溶解度÷(溶解度+100 g)×100%。A、温度为t1 ℃时,其饱和溶液溶质的质量分数为:75 g÷175 g×100%≈43%,不可能得到溶质质量分数为50%的溶液,错误;B、t2 ℃该物质饱和溶液溶质的质量分数=100 g÷200 g×100%=50%,将160 g 37.5%的溶液蒸发50 g水后,溶液溶质的质量分数为 60 g÷110 g×100%≈54.5%,即有溶质析出得t2 ℃时的饱和溶液,质量分数为50%,正确;C、t2 ℃,该物质的溶解度为100 g,所以加入20 g溶质后能完全溶解,溶液溶质的质量分数为80 g÷180 g×100%≈44.4%,错误;D、加入65 g溶质,改变温度至t3 ℃所得溶液为t3 ℃时的饱和溶液,质量分数大于50%,错误。故选B。
【答案】B
典例2 如图是a、b、c三种固体物质的溶解度曲线。据图回答下列问题。
(1)P点表示的含义是_____________________________________________。
(2)将相同质量t2 ℃时的a、b、c饱和溶液的温度降低到t1 ℃时,析出晶体最多的是______。
(3)将t1 ℃时的a、b、c饱和溶液的温度升高到t2 ℃时,溶质质量分数由小到大的顺序是_________。
(4)t2 ℃时,将40 g a物质放入盛有50 g水的烧杯中,所得溶液溶质质量分数为___________。
(5)当a中混有少量b时,可采用______________的方法提纯a。
【解析】(1)P点表示的含义是:在t1 ℃时,a、c溶解度相等为20 g。(2)c的溶解度随温度降低而增大,降温时,变为不饱和溶液,无晶体析出,a、c的溶解度随温度降低而减小,其中a的溶解度受温度影响较大,降温时析出的晶体多。故将相同质量t2 ℃时的a、b、c饱和溶液的温度降低到t1 ℃时,析出晶体最多的是a。(3)温度升高到t2 ℃时,a、b的溶解度增大,溶质质量分数不变,c的溶解度减小,溶质质量分数减小。根据饱和溶液的溶质质量分数=×100%,可知t1 ℃时,a、c的饱和溶液溶质质量分数相等,b的饱和溶液溶质质量分数大于a、c的饱和溶液,故温度升高到t2 ℃时,溶质质量分数由小到大的顺序是c<a<b。(4)t2 ℃时,a的溶解度是50 g,即该温度时,100 g水中最多能溶解50 g a,则50 g水最多能溶解25 g a,所得溶液溶质质量分数为=33.3%。(5)a的溶解度受温度影响较大,对于受温度影响较大的物质用降温结晶的方法提纯。
【答案】(1)t1 ℃时,a、c溶解度相等为20 g
(2)a
(3)c<a<b
(4)33.3%
(5)降温结晶
、
基础训练
1.如图所示是甲物质的溶解度曲线。把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是
A.溶剂的质量一定变小
B.溶液的质量可能不变
C.溶质的质量分数一定变大
D.溶质的质量一定不变
2.如图是a、b、c三种固体物质的溶解度曲线图,下列说法错误的是
A.b物质为易溶物质
B.a、c两物质的溶解度相同
C.温度升高,c物质溶解度减小
D.50 ℃时,a物质的溶解度为50 g
3.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.35 ℃时,甲的饱和溶液的溶质质量分数为60%
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10 ℃时甲、乙两种溶液的溶质质量分数一定相等
4.如图是M、N 两种固体物质的溶解度曲线,下列说法不正确的是
A.M的溶解度受温度影响较大
B.20 ℃时,M、N的溶解度相同
C.40 ℃时,将35 g M加入50 g水中所得溶液的质量为85 g
D.40 ℃时,M、N饱和溶液溶质质量分数大小关系是M>N
5.将质量均为30 g的甲、乙两种固体分别加入到50 g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是
A.甲的溶解度随温度升高而增大
B.t1 ℃时,甲、乙的溶解度均为20 g
C.温度由t2 ℃降低到t1 ℃时,甲溶液析出5 g固体
D.a、b、c三点中溶质的质量分数由大到小的顺序是:c>a>b
6.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t1 ℃时,甲、乙两种溶液的溶质质量分数相同
B.t1 ℃时,取少量甲的饱和溶液,加入少量乙,不能再溶解
C.t1 ℃时,取少量甲的饱和溶液升温到t2 ℃,变成不饱和溶液
D.t2 ℃时,将等质量的甲、乙分别配成饱和溶液,所得溶液质量甲>乙
7.如图是甲、乙两种固体的溶解度曲线。将t3 ℃时相同质量的甲、乙两种物质的饱和溶液降温到t1 ℃,只有甲的溶液中有固体析出。则乙的溶解度曲线为________(填“X”或“Y”);甲和乙的溶解度相等时的温度为______________;t3 ℃时,将30 g 甲的饱和溶液稀释为质量分数为10%的溶液,需加水的质量为________g。
能力提升
8.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.30 ℃时,甲的饱和溶液溶质质量分数为40%
B.20 ℃时,甲、乙的饱和溶液中所含溶质的质量一定相等
C.将等质量的甲、乙固体,分别配成30 ℃的饱和溶液,所需水的质量:甲>乙
D.将20 ℃时甲、乙的饱和溶液升温到30 ℃,所得甲、乙溶液的溶质质量分数相等
9.t ℃时,某固体物质(不含结晶水)的饱和溶液中,溶质质量随溶剂质量的变化如图中斜线所示。下列说法正确是
A.由图可知,温度升高,该物质的溶解度增大
B.由图可知,t ℃时,该物质的溶解度为40
C.N点表示的溶液中,溶质的质量分数为20%
D.P点、Q点表示的溶液中,溶质的质量分数相同
10.如图是A、B、C三种固体物质的溶解度曲线图,请回答:
(1)A、B、C三种物质的溶解度受温度影响最大的是_______。
(2)t1 ℃时,三种物质溶解度由大到小的顺序是____________。
(3)将接近饱和的A溶液变成饱和溶液的方法是_____________。
(4)在t2 ℃时,将15 g C物质加入到50 g水中,充分搅拌后,所得溶液中溶质的质量分数为_______。
真题练习
11.[2019·聊城]如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是
A.t1 ℃时,甲、乙两种物质的饱和溶液中溶质的质量分数相等
B.由t2 ℃降温到t1 ℃,甲饱和溶液比乙饱和溶液析出晶体的质量多
C.t2 ℃时,将40 g甲物质加入50 g水中,充分溶解后溶液的质量为90 g
D.t2 ℃时,用甲、乙配制等质量的饱和溶液,甲所需要水的质量比乙多
12.[2019·苏州]氯化钠和硝酸钾两种固体的溶解度曲线如图所示。下列说法正确的是
A.硝酸钾的溶解度大于氯化钠的溶解度
B.常用冷却结晶的方法从氯化钠溶液中获得其晶体
C.40 ℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0%
D.将20 ℃的硝酸钾饱和溶液升温至60 ℃,溶液的溶质质量分数增大(忽略水分蒸发)
13.[2019·广东] 下图为两物质的溶解度曲线。请回答:
(1)50 ℃时,Na2Cr2O7的溶解度为______g;60 ℃时溶解度:Na2Cr2O7_______Na2SO4(填“<”、“=”、“>”)。
(2)在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃时,析出Na2Cr2O7______g?(假设不含结晶水)。
参考答案
基础训练
1.【答案】B
2.【答案】B
【解析】A、20 ℃时,b的溶解度大于10 g,故b物质为易溶物质,正确;B、在一定的温度下比较物质的溶解度,在20 ℃时a、c两物质的溶解度相同,错误;C、据图可以看出,温度升高,c物质溶解度减小,正确;D、据图可以看出,50 ℃时,a物质的溶解度为50 g,正确。故选B。
3.【答案】C
【解析】A、溶解度的大小与温度有关,错误;B、35 ℃时,甲的溶解度是60 g,故溶质的质量分数为×100%=37.5%,错误;C、甲物质的溶解度随温度的升高而升高,故降低温度可使接近饱和的甲溶液变成饱和溶液,正确;D、10 ℃时甲、乙两种饱和溶液的溶质质量分数一定相等,不饱和的两种溶液中溶质的质量分数不一定相等,错误。故选C。
4.【答案】C
5.【答案】D
【解析】A、纵坐标是剩余固体质量,温度越高,剩余固体越多,表明溶解度是随温度升高而减小的,错误;B、t1 ℃时,剩余固体都是10 g,说明溶解了20 g,甲、乙的溶解度均为40 g,错误;C、温度由t2 ℃降低到t1 ℃时,固体减少5g,应该是溶解了5 g,错误;D、c中剩余固体最少,a中次之,b中剩余固体最多,所以a、b、c三点中溶质的质量分数由大到小的顺序是c>a>b,正确。故选D。
6.【答案】C
【解析】A、t1 ℃时,甲、乙两种物质的溶解度相等,但未指明溶液的状态,故无法比较溶质质量分数的大小,故错误;B、根据饱和溶液的概念可知,t1 ℃时,取少量甲的饱和溶液,加入少量乙,能溶解乙,但不能溶解甲,故错误;C、由图可知,甲的溶解度随温度的升高而增大且变化较大,故t1 ℃时,取少量甲的饱和溶液升温到t2 ℃,变成不饱和溶液,正确;D、由于t2 ℃时甲、乙两种物质的溶解度大小关系是甲>乙,即等质量的水能溶解的溶质质量为甲>乙,所以用等质量的甲、乙配成t2 ℃时饱和溶液所需水的质量是乙>甲,故错误。故选C。
7.【答案】Y t2 ℃ 70
【解析】t3 ℃时相同质量的甲、乙两种物质的饱和溶液降温到t1 ℃,只有甲的溶液中有固体析出,说明甲物质的溶解度随温度的降低而减小,所以乙的溶解度曲线为Y。通过分析溶解度曲线可知,甲和乙的溶解度相等时的温度为t2 ℃。t3 ℃时,甲物质的溶解度是50 g,将30 g甲的饱和溶液稀释为质量分数为10%的溶液,设需加水的质量为x,根据稀释前后溶质质量相等列等式:30 g××100%=(30 g+x)×10%,x =70 g。
能力提升
8.【答案】D
9.【答案】D
【解析】A、该图是饱和溶液中溶质质量与溶剂质量的关系曲线,故无法判断温度升高,该物质的溶解度增大,故A错误;B、由图可知,t ℃时,该物质的溶解度为40 g,故B错误;C、N点表示的溶液中,溶质的质量分数为×100%<20%,故C错误;D、P点、Q点均表示该物质在t ℃时的饱和溶液,溶质的质量分数相同,故D正确。故选D。
10.【答案】(1)A
(2)C>B>A
(3)加溶质(或蒸发溶剂;或降温)
(4)20%
【解析】(1)由物质的溶解度曲线可知,A、B、C三种物质的溶解度受温度影响最大的是A。(2)由物质的溶解度曲线可知,t1 ℃时,三种物质的溶解度由大到小的顺序是C>B>A。(3)将接近饱和的A溶液变成饱和溶液的方法是加溶质或蒸发溶剂等。(4)在t2 ℃时,C的溶解度是25 g,将15 g C物质加入到50 g水中,充分搅拌后,只能够溶解12.5 g,所得溶液是饱和溶液,溶质的质量分数为× 100%=20%。
真题练习
11.【答案】A
【解析】A、一定温度下,饱和溶液溶质的质量分数=×100%,t1 ℃时,甲、乙的溶解度相等,甲、乙两种饱和溶液的溶质质量分数相等,正确;B、没有确定溶液的质量无法比较甲、乙饱和溶液析出晶体的质量,错误;C、t2 ℃时,甲的溶解度为50 g,即100 g水中最多溶解50 g的甲,40 g甲加入50 g水中,充分溶解后只能溶解25 g,所得的溶液质量为75 g,错误;D、t2 ℃时,甲的溶解度大于乙的溶解度,配制等质量饱和溶液,甲所需要水的质量比乙少,错误。故选A。
12.【答案】C
13.【答案】(1)110 >
(2)50
【解析】(1)由溶解度曲线可知,50 ℃时,Na2Cr2O7的溶解度为110 g;由溶解度曲线可知,60 ℃时,Na2Cr2O7的溶解度曲线位于Na2SO4的上方,故溶解度:Na2Cr2O7>Na2SO4。(2)根据溶解度曲线可知,50 ℃时,Na2Cr2O7的溶解度为110 g;10 ℃时,Na2Cr2O7的溶解度为60 g。结合改变温度,溶解度减小,则m g饱和溶液析出溶质的质量=m g×,在50 ℃时,把210 g Na2Cr2O7饱和溶液降温到10 ℃时,析出Na2Cr2O7的质量=210 g×=50 g。
同课章节目录
