苏教版高中化学必修2 专题2 第一单元 化学反应的限度(共19张PPT)
文档属性
| 名称 | 苏教版高中化学必修2 专题2 第一单元 化学反应的限度(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 109.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-21 00:00:00 | ||
图片预览



文档简介
(共19张PPT)
第一单元 化学反应的限度
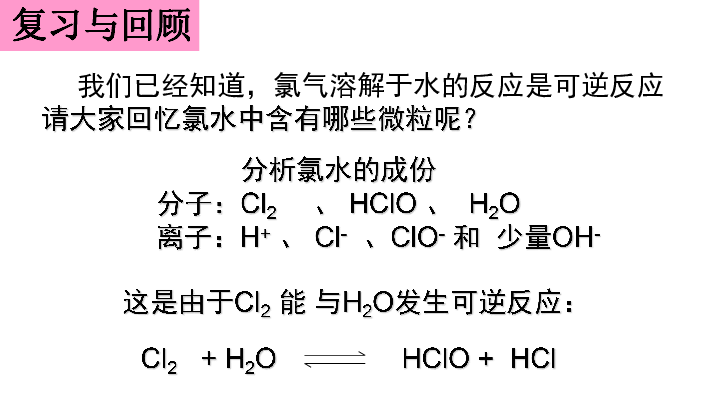
我们已经知道,氯气溶解于水的反应是可逆反应
请大家回忆氯水中含有哪些微粒呢?
分析氯水的成份
分子:Cl2 、 HClO 、 H2O
离子:H+ 、 Cl- 、ClO- 和 少量OH-
这是由于Cl2 能 与H2O发生可逆反应:
Cl2 + H2O HClO + HCl
复习与回顾
活动与探究
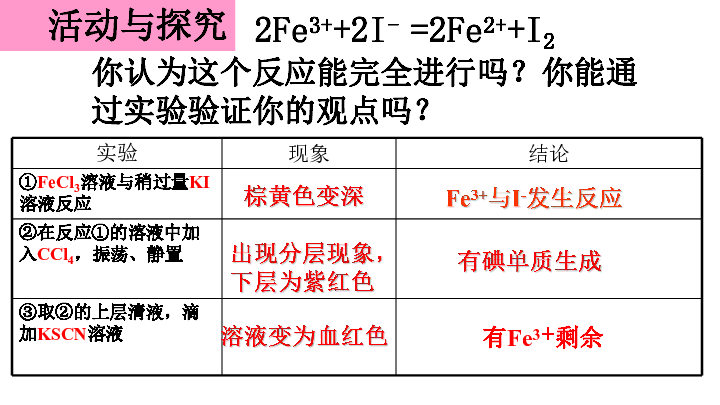
2Fe3++2I- =2Fe2++I2
你认为这个反应能完全进行吗?你能通过实验验证你的观点吗?
实验 现象 结论
①FeCl3溶液与稍过量KI溶液反应
②在反应①的溶液中加入CCl4,振荡、静置
③取②的上层清液,滴加KSCN溶液
有Fe3+剩余
棕黄色变深
出现分层现象,
下层为紫红色
溶液变为血红色
有碘单质生成
Fe3+与I-发生反应
事实表明,许多反应是可逆的。 在同一反应条件下,既可以向正反应方向进行,又可以向逆反应方向进行。
定义:在同一反应条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的反应。
总结 可逆反应的定义、特征
辨析
点燃:2H2+O2=2H2O
通电:2H2O=2H2+O2
是可逆反应吗?
不是
可逆反应强调的是同一条件,同时发生.
例1:
N2 + 3 H2 2 NH3
开始时 3mol 9mol 0
平衡时 0 0 6mol
以下可逆反应可不可能出现这种情况:
不可能,可逆反应的反应物不能全转化为生成物
例2:
只有可逆反应达到平衡时,才会出现物质共存?
错,可逆反应只要反应开始物质都共存
3H2(g) + N2 (g) 2NH3(g)
正向反应
逆向反应
分析:
(1)当反应刚开始时,反应物和生成物的浓
度哪个大?
(2)当反应刚开始时,正反应与逆反应哪个
反应速率大?
(3)随着反应的进行,反应物和生成物浓度
如何变化?
(4)随着反应的进行,v(正)与v(逆)怎样变化?
在密闭容器中加入3molH2和1mol N2发生反应
(5)反应进行到什么时候会“相对静止”?
当正反应速率与逆反应速率相等时
(6)此时,反应物和生成物浓度如何变化?
反应物和生成物浓度均不再改变
(7)给这个状态命名
平衡状态
(8)反应真的停止了吗?
处于动态平衡
可逆反应的最大限度就是到达化学平衡状态
综合分析上述合成氨反应中正、逆反应的反应速率、反应物和生成物浓度随时间变化的情况。
(1)反应开始时:
V(正) 很大,V(逆)为零
(2)反应进行中:
反应物减少,导致V(正) 逐渐减小;生成物由无
到有逐渐增多,导致V(逆) 从零逐渐增大。
(3)反应达到平衡时:
V(正)= V(逆)
反应混合物各组分的浓度不再发生变化
t
V
0
V(正)
V(逆)
V(正) =V(逆)
化学平衡
1、当一个可逆反应进行到正反应速率与逆反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度。
化学平衡状态的特征:逆、等、动、定、变。
逆:化学平衡研究的对象是可逆反应。
等: v(正)=v(逆)(是化学平衡状态的本质)。
动:是动态平衡,正、逆反应还在不断进行,
正、逆反应速率相等,但不等于零。
定:平衡时,各组分的浓度保持一定(是化学平
衡状态的外观特征)。
变:当外界条件发生改变时,则原平衡可能被破
坏,各组分的浓度就会随之发生变化,在新
的一定条 件下又会建立新的平衡状态。
2、任何化学反应在一定条件下都有一定的限度 ,不同反应的限度不同。
3、在可逆反应中,反应物不能按化学计量数之比完全转化为生成物,因此,反应物的转化率小于100%。
4、有些反应的可逆性很小,如Ag++Cl- = AgCl ↓
一般可视为不可逆反应。
5、化学反应的限度可以通过改变条件而改变。
6、在生产和生活中,人们希望促进有利的化学反应,抑制有害的化学反应,这就要通过控制反应条件来使化学反应符合或接近人们的期望。
在一定条件下,某容器中充入N2和H2合成NH3,
以下叙述错误的是 ( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
B
实践
例3:
恒温的密闭容器中,能证明可逆反应
A(g) + B(g) 2C(g),已达平衡的依据是
1、A、B、C共存
2、A的消耗速率= B的生成速率
3、C的浓度不变了
4、体系的总压强不再改变
不能
不能
能
能
关注反应前后气体前面系数和相等的可逆反应
例4:
恒温的密闭容器中,能证明可逆反应
N2 + 3H2 2NH3已达平衡的依据是
1、每有3份H2消耗,同时就有2份NH3生成
2、每有3份H2消耗,同时就有2份NH3消耗
不能
能
3、每有1个N N断裂,同时就有6个N—H形成
不能
4、每有3个H—H断裂,同时就有3个H—H形成
能
例5:
恒温恒容的密闭容器中,能证明可逆反应
2SO2 + O2 2SO3(g)已达平衡的依据是
1、SO2、O2、SO3分子数不变了
2、SO2、O2、SO3分子数之比为2:1:2
3、体系的总压强不再变化
4、混合气体的总物质的量不再变化
5、每有1molO2消耗,同时就有2molSO3生成
6、混合气体的密度不再变化
不能
不能
不能
能
能
能
例6:
恒温的密闭容器中,能证明可逆反应
2A(g) + B(s) 2C(g)到达化学平衡状态
的依据是
1、体系的总压强不再变化
2、混合气体的总物质的量不再变化
3、混合气体的密度不再变化
不能
不能
能
已知C为有色气体
4、混合气体的颜色不再变化
能
第一单元 化学反应的限度
我们已经知道,氯气溶解于水的反应是可逆反应
请大家回忆氯水中含有哪些微粒呢?
分析氯水的成份
分子:Cl2 、 HClO 、 H2O
离子:H+ 、 Cl- 、ClO- 和 少量OH-
这是由于Cl2 能 与H2O发生可逆反应:
Cl2 + H2O HClO + HCl
复习与回顾
活动与探究
2Fe3++2I- =2Fe2++I2
你认为这个反应能完全进行吗?你能通过实验验证你的观点吗?
实验 现象 结论
①FeCl3溶液与稍过量KI溶液反应
②在反应①的溶液中加入CCl4,振荡、静置
③取②的上层清液,滴加KSCN溶液
有Fe3+剩余
棕黄色变深
出现分层现象,
下层为紫红色
溶液变为血红色
有碘单质生成
Fe3+与I-发生反应
事实表明,许多反应是可逆的。 在同一反应条件下,既可以向正反应方向进行,又可以向逆反应方向进行。
定义:在同一反应条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的反应。
总结 可逆反应的定义、特征
辨析
点燃:2H2+O2=2H2O
通电:2H2O=2H2+O2
是可逆反应吗?
不是
可逆反应强调的是同一条件,同时发生.
例1:
N2 + 3 H2 2 NH3
开始时 3mol 9mol 0
平衡时 0 0 6mol
以下可逆反应可不可能出现这种情况:
不可能,可逆反应的反应物不能全转化为生成物
例2:
只有可逆反应达到平衡时,才会出现物质共存?
错,可逆反应只要反应开始物质都共存
3H2(g) + N2 (g) 2NH3(g)
正向反应
逆向反应
分析:
(1)当反应刚开始时,反应物和生成物的浓
度哪个大?
(2)当反应刚开始时,正反应与逆反应哪个
反应速率大?
(3)随着反应的进行,反应物和生成物浓度
如何变化?
(4)随着反应的进行,v(正)与v(逆)怎样变化?
在密闭容器中加入3molH2和1mol N2发生反应
(5)反应进行到什么时候会“相对静止”?
当正反应速率与逆反应速率相等时
(6)此时,反应物和生成物浓度如何变化?
反应物和生成物浓度均不再改变
(7)给这个状态命名
平衡状态
(8)反应真的停止了吗?
处于动态平衡
可逆反应的最大限度就是到达化学平衡状态
综合分析上述合成氨反应中正、逆反应的反应速率、反应物和生成物浓度随时间变化的情况。
(1)反应开始时:
V(正) 很大,V(逆)为零
(2)反应进行中:
反应物减少,导致V(正) 逐渐减小;生成物由无
到有逐渐增多,导致V(逆) 从零逐渐增大。
(3)反应达到平衡时:
V(正)= V(逆)
反应混合物各组分的浓度不再发生变化
t
V
0
V(正)
V(逆)
V(正) =V(逆)
化学平衡
1、当一个可逆反应进行到正反应速率与逆反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度。
化学平衡状态的特征:逆、等、动、定、变。
逆:化学平衡研究的对象是可逆反应。
等: v(正)=v(逆)(是化学平衡状态的本质)。
动:是动态平衡,正、逆反应还在不断进行,
正、逆反应速率相等,但不等于零。
定:平衡时,各组分的浓度保持一定(是化学平
衡状态的外观特征)。
变:当外界条件发生改变时,则原平衡可能被破
坏,各组分的浓度就会随之发生变化,在新
的一定条 件下又会建立新的平衡状态。
2、任何化学反应在一定条件下都有一定的限度 ,不同反应的限度不同。
3、在可逆反应中,反应物不能按化学计量数之比完全转化为生成物,因此,反应物的转化率小于100%。
4、有些反应的可逆性很小,如Ag++Cl- = AgCl ↓
一般可视为不可逆反应。
5、化学反应的限度可以通过改变条件而改变。
6、在生产和生活中,人们希望促进有利的化学反应,抑制有害的化学反应,这就要通过控制反应条件来使化学反应符合或接近人们的期望。
在一定条件下,某容器中充入N2和H2合成NH3,
以下叙述错误的是 ( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
B
实践
例3:
恒温的密闭容器中,能证明可逆反应
A(g) + B(g) 2C(g),已达平衡的依据是
1、A、B、C共存
2、A的消耗速率= B的生成速率
3、C的浓度不变了
4、体系的总压强不再改变
不能
不能
能
能
关注反应前后气体前面系数和相等的可逆反应
例4:
恒温的密闭容器中,能证明可逆反应
N2 + 3H2 2NH3已达平衡的依据是
1、每有3份H2消耗,同时就有2份NH3生成
2、每有3份H2消耗,同时就有2份NH3消耗
不能
能
3、每有1个N N断裂,同时就有6个N—H形成
不能
4、每有3个H—H断裂,同时就有3个H—H形成
能
例5:
恒温恒容的密闭容器中,能证明可逆反应
2SO2 + O2 2SO3(g)已达平衡的依据是
1、SO2、O2、SO3分子数不变了
2、SO2、O2、SO3分子数之比为2:1:2
3、体系的总压强不再变化
4、混合气体的总物质的量不再变化
5、每有1molO2消耗,同时就有2molSO3生成
6、混合气体的密度不再变化
不能
不能
不能
能
能
能
例6:
恒温的密闭容器中,能证明可逆反应
2A(g) + B(s) 2C(g)到达化学平衡状态
的依据是
1、体系的总压强不再变化
2、混合气体的总物质的量不再变化
3、混合气体的密度不再变化
不能
不能
能
已知C为有色气体
4、混合气体的颜色不再变化
能
