人教版初中化学九年级下专题训练,同步练习,复习补习资料:专题10.2.2 溶液酸碱度的表示法——pH(第2课时)
文档属性
| 名称 | 人教版初中化学九年级下专题训练,同步练习,复习补习资料:专题10.2.2 溶液酸碱度的表示法——pH(第2课时) |
|
|
| 格式 | zip | ||
| 文件大小 | 671.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-21 00:00:00 | ||
图片预览



文档简介
第十单元 酸和碱
课题2 酸和碱的中和反应
知识
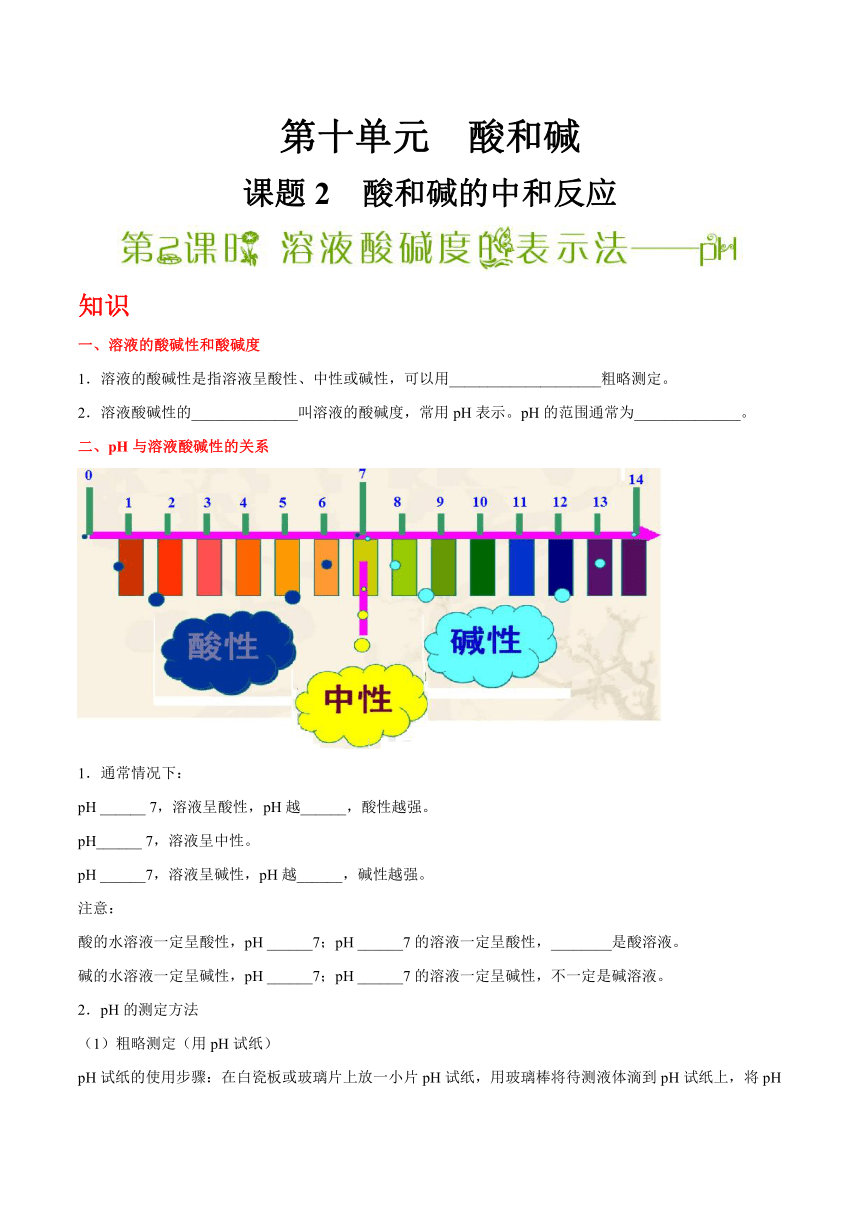
一、溶液的酸碱性和酸碱度
1.溶液的酸碱性是指溶液呈酸性、中性或碱性,可以用____________________粗略测定。
2.溶液酸碱性的______________叫溶液的酸碱度,常用pH表示。pH的范围通常为______________。
二、pH与溶液酸碱性的关系
1.通常情况下:
pH ______ 7,溶液呈酸性,pH越______,酸性越强。
pH______ 7,溶液呈中性。
pH ______7,溶液呈碱性,pH越______,碱性越强。
注意:
酸的水溶液一定呈酸性,pH ______7;pH ______7的溶液一定呈酸性,________是酸溶液。
碱的水溶液一定呈碱性,pH ______7;pH ______7的溶液一定呈碱性,不一定是碱溶液。
2.pH的测定方法
(1)粗略测定(用pH试纸)
pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,将pH试纸显示的颜色与________________比较,读出该溶液的pH。
使用pH试纸是测定pH的最简单方法,只能粗略地测定溶液的酸碱度,测得的pH是________而不是________。
(2)精确测定(用pH计)
pH计又叫_________,是用来精确测定溶液酸碱度的仪器,pH计型号不同精确度也不同。
三、了解溶液的酸碱性的重要意义
1.化工生产中许多反应必须在___________溶液里才能进行。
2.在农业生产中,农作物一般适宜在pH为______________的土壤中生长。
3.测定雨水的pH(因溶解有_________,正常雨水的pH约为5.6,酸雨的pH______ 5.6),可以了解空气的污染情况。
酸雨的危害
4.测定人体内或排出的液体的pH,可以了解人体的健康状况。
人体某些体液的正常pH范围
血浆
唾液
胃液
乳汁
胆汁
胰液
尿液
pH
7.35~7.45
6.6~7.1
0.9~1.5
6.6~7.6
7.1~7.3
7.5~8.0
4.7~8.4
正常的人体体液中一定显酸性的是________________;一定显碱性的是____________________________。
5.洗发剂和护发剂
日常生活中,洗发时一般先用_____剂,后用 剂。洗发剂显 性,护发剂显_____ 性。
一、1.酸碱指示剂
2.强弱程度 0~14
二、1.< 小 = > 大
< < 不一定
> > 不一定
2.(1)标准比色卡 整数 小数
(2)酸度计
三、1.一定pH
2.7或接近7
3.CO2 小于
4.胃液 血浆、胆汁、胰液
5.洗发 护发 碱 酸
重点
一、pH试纸测定溶液酸碱度的注意事项
1.试纸不能直接深入溶液,以免污染溶液。
2.测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这将导致测量不准确,若该溶液为酸性溶液,则pH偏高,若该溶液为碱性溶液,则pH偏低。
3.用pH试纸只能粗略地测定溶液的酸碱度,测得的pH是整数而不能是小数。
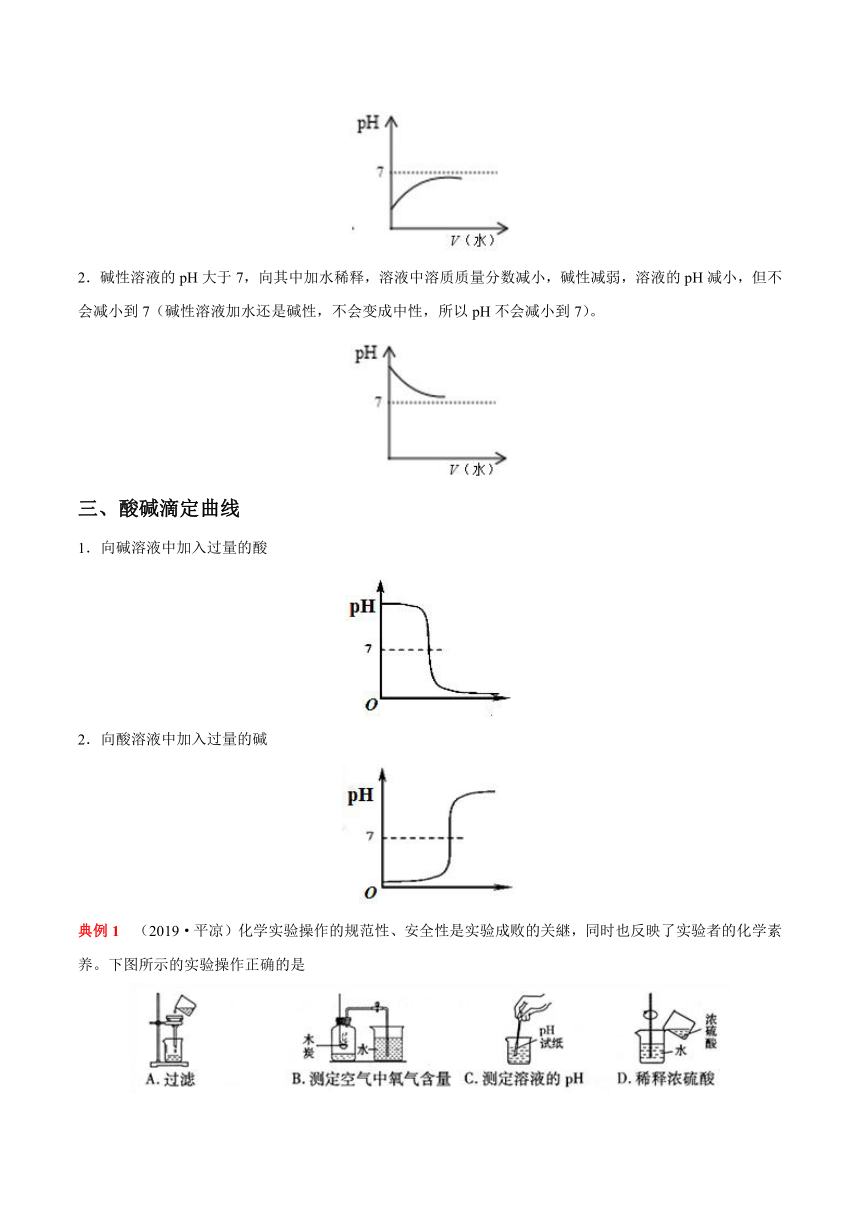
二、溶液的稀释与溶液pH的关系
H+的浓度越大,溶液的酸性越强,pH越小;OH-的浓度越大,溶液的碱性越强,pH越大。溶液中H+或OH-的浓度改变,则pH会相应改变。
1.酸性溶液的pH小于7,向其中加水稀释,溶液中溶质质量分数减小,酸性减弱,溶液的pH增大,但不会增大到7(酸性溶液加水还是酸性,不会变成中性,所以pH不会增大到7)。
2.碱性溶液的pH大于7,向其中加水稀释,溶液中溶质质量分数减小,碱性减弱,溶液的pH减小,但不会减小到7(碱性溶液加水还是碱性,不会变成中性,所以pH不会减小到7)。
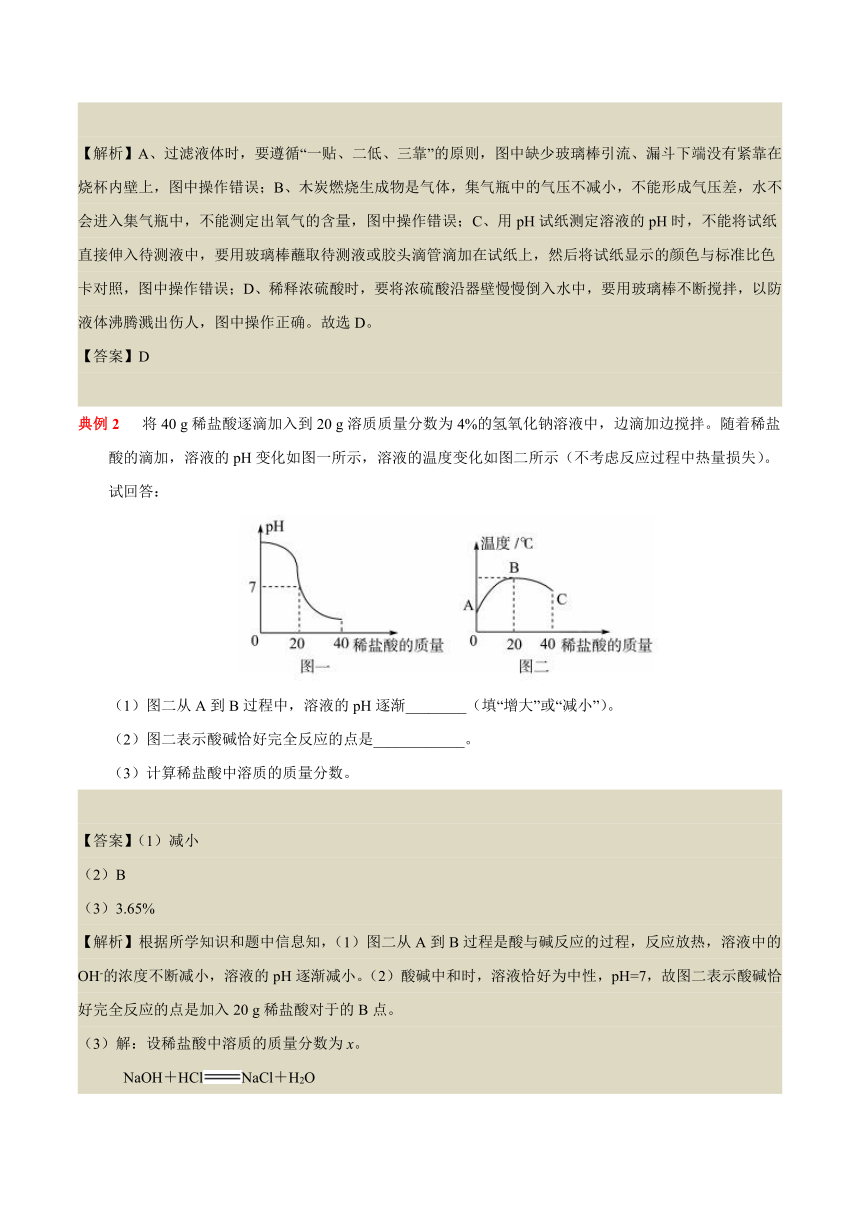
三、酸碱滴定曲线
1.向碱溶液中加入过量的酸
2.向酸溶液中加入过量的碱
典例1 (2019·平凉)化学实验操作的规范性、安全性是实验成败的关継,同时也反映了实验者的化学素养。下图所示的实验操作正确的是
【解析】A、过滤液体时,要遵循“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中操作错误;B、木炭燃烧生成物是气体,集气瓶中的气压不减小,不能形成气压差,水不会进入集气瓶中,不能测定出氧气的含量,图中操作错误;C、用pH试纸测定溶液的pH时,不能将试纸直接伸入待测液中,要用玻璃棒蘸取待测液或胶头滴管滴加在试纸上,然后将试纸显示的颜色与标准比色卡对照,图中操作错误;D、稀释浓硫酸时,要将浓硫酸沿器壁慢慢倒入水中,要用玻璃棒不断搅拌,以防液体沸腾溅出伤人,图中操作正确。故选D。
【答案】D
典例2 将40 g稀盐酸逐滴加入到20 g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
(1)图二从A到B过程中,溶液的pH逐渐________(填“增大”或“减小”)。
(2)图二表示酸碱恰好完全反应的点是____________。
(3)计算稀盐酸中溶质的质量分数。
【答案】(1)减小
(2)B
(3)3.65%
【解析】根据所学知识和题中信息知,(1)图二从A到B过程是酸与碱反应的过程,反应放热,溶液中的OH-的浓度不断减小,溶液的pH逐渐减小。(2)酸碱中和时,溶液恰好为中性,pH=7,故图二表示酸碱恰好完全反应的点是加入20 g稀盐酸对于的B点。
(3)解:设稀盐酸中溶质的质量分数为x。
NaOH+HClNaCl+H2O
40 36.5
20 g×4% 20 g×x
=
解得:x=3.65%
答:稀盐酸中溶质的质量分数是3.65%。
基础训练
1.下列生活中常见的物质,呈碱性的是
A.雪碧pH=3.5 B.牛奶pH=6.5
C.矿泉水pH=7 D.肥皂水pH=9.5
2.测定pH最简单的方法是使用
A.石蕊溶液 B.澄清石灰水
C.酚酞溶液 D.pH试纸
3.土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是
植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A.花生
B.苹果
C.西瓜
D.沙枣
4.某同学用pH计测得生活中一些物质得pH如表。下列说法错误的是
物质
肥皂水
牙膏
西瓜汁
食醋
pH
10.2
8.5
5.8
2.4
A.牙膏显碱性
B.西瓜汁显酸性
C.肥皂水中滴入紫色石蕊试液显红色
D.胃酸过多的人不宜食用过多的食醋
5.下图X、Y、Z表示某些物质的pH。下列判断正确的是
A.X一定是酸 B.Y一定是蒸馏水
C.Z一定是碱 D.Z可能是盐
6.在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图见下图。下列有关认识错误的是
A.反应结束时溶液的pH=7
B.反应前后元素的种类没有变化
C.酸与碱的反应属于中和反应
D.该微观图还可说明所有物质都是由分子构成的
7.下列指定反应的化学方程式正确的是
A.镁条在氧气中燃烧:Mg+O2MgO2
B.古代湿法炼铜:2Fe+3CuSO4Fe2(SO4)3+3Cu
C.酸雨形成原因:CO2+H2OH2CO3
D.用胃舒平[含Al(OH)3]治疗胃酸过多:Al(OH)3+3HClAlCl3+3H2O
8.某中学化学课外活动小组的同学,监测一次降雨过程中雨水的pH。取雨水水样,用pH计(测pH的仪器)测得数据如下:
测定时间
5∶05
5∶15
5∶25
5∶35
5∶45
pH
4.95
4.94
4.86
4.84
4.84
小组同学对数据的分析推理错误的是
A.本次降雨通常会影响作物的生长
B.在测定期间雨水的酸性逐渐减弱
C.本次降雨对大理石建筑有腐蚀作用
D.当时空气中二氧化硫的含量可能超标
9.向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的
A.Mg B.H2O
C.NaOH D.CaCO3
能力提升
10.用pH试纸可以测定溶液的酸碱度,下列说法正确的是
A.测定时将pH试纸直接伸入待测液中
B.与标准比色卡比照后,得出某溶液pH为5.6
C.用湿润pH试纸测得的溶液pH一定偏小
D.石蕊试纸不能准确测定溶液酸碱度
11.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是
A.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
B.图中b点表示硫酸和氢氧化钠溶液恰好完全反应
C.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
D.向c点溶液中滴入紫色石蕊试液,溶液变蓝色
12.下列溶液中pH最小的是
A.使酚酞变红的溶液
B.使石蕊变蓝色的溶液
C.使石蕊变红的溶液
D.使石蕊变紫色的溶液
13.下列所示的四个图像,能正确反映对应变化关系的是
A.加热一定质量的高锰酸钾
B.把一定质量的铜片加入到硝酸银溶液
C.电解水
D.向一定量的氢氧化钠溶液中加水稀释
真题练习
14.[2019·天津]人体中一些体液或排泄物的pH范围如下,其中酸性最强的是
A.胃液0.9~1.5 B.唾液6.6~7.1
C.尿液4.7~8.4 D.胰液7.5~8.0
15.[2019·自贡]肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如下表,则新鲜肉在变质过程中酸性如何变化
名称
新鲜肉
次鲜肉
变质肉
pH
5.8﹣6.2
6.3~6.6
>6.6
A.不变 B.变强 C.变弱 D.无法确定
16.[2019·辽宁]下列食物中,胃酸过多的人空腹时最适宜食用的是
食物
橘子汁
葡萄汁
西瓜汁
玉米粥
pH
3.4~3.8
3.6~4.5
5.6~6.1
6.8~8.0
A.橘子汁 B.葡萄汁 C.西瓜汁 D.玉米粥
17.[2019·重庆]已知生活中厕所清洁剂的pH=1,厨房清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高
B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果
D.厕所清洁剂可能使铁制下水道腐蚀
18.[2019·梧州]某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
参考答案
基础训练
1.【答案】D
2.【答案】D
【解析】A、石蕊溶液只能粗略的测定溶液的酸碱性,不能测出溶液的具体pH,错误;B、澄清石灰水不能测出溶液的pH,错误;C、酚酞溶液只能粗略的测定出溶液是否显碱性,不能测出溶液的具体pH,错误;D、pH试纸可以测出溶液的酸碱度,正确。故选D。
3.【答案】D
【解析】沙枣适宜的pH范围为碱性,不适宜在微酸性的土壤中种植。
4.【答案】C
【解析】A、牙膏pH=8.5>7显碱性,正确;B、西瓜汁pH=5.8<7显酸性,故正确;C、肥皂水的pH=10.2,呈碱性,能使石蕊试液变蓝,故错误;D、食醋的pH=2.4,呈酸性,故胃酸过多的人不宜食用过多的食醋,正确。故选C。
5.【答案】D
【解析】A、X溶液的pH小于7,只能说明该溶液显酸性,不能说明是酸,错误;B、Y溶液的pH=7,说明该溶液显中性,不能说明是水,错误;C、Z溶液的pH大于7,说明溶液显碱性,不能说明溶液是碱,错误;D、盐溶液也可能显碱性,正确。故选D。
6.【答案】D
【解析】A、反应结束时溶液呈中性,pH=7,故A正确;B、反应前后元素的种类没有变化,故B正确;C、酸与碱的反应属于中和反应,故C正确;D、该微观图并不可说明所有物质都是由分子构成的,故D错误。故选D。
7.【答案】D
8.【答案】B
【解析】二氧化硫、氮氧化物是形成酸雨的重要物质,酸雨能够腐蚀建筑物、毁坏森林树木、使水体、土壤酸化等。A、本次降雨属于酸雨,通常会影响作物的生长,故A正确;B、pH越小,酸性越强,故在测定期间雨水的酸性逐渐增强,故B错误;C、本次降雨对大理石建筑有腐蚀作用,故C正确;D、当时空气中二氧化硫的含量可能超标(酸雨有三种类型,硫酸型、硝酸型和混合型,所以是可能为二氧化硫超标),故D正确。故选B。
9.【答案】C
【解析】解答本题的关键应明确两点:(1)pH与溶液酸碱性的关系;(2)酸与其他物质反应溶液的酸碱性变化规律。A、根据题目的函数图像,加入X物质后溶液的pH变大,直到大于7,向稀盐酸中加入Mg,能与酸反应,pH增大,盐酸完全反应后,pH等于7,不会大于7,错误;B、向盐酸中加水,pH变大,但永远小于7,错误;C、加入NaOH,盐酸完全反应后,再加入NaOH,溶液呈碱性,pH大于7,正确;D、加入碳酸钙,与盐酸完全反应后,溶液呈中性,pH不会大于7,错误。故选C。
能力提升
10.【答案】D
【解析】A、测定时用玻璃棒蘸取待测液滴在pH试纸上,错误;B、用pH试纸测得液体的pH,只能精确到整数,错误;C、用湿润pH试纸测得碱性溶液的pH偏小,测得酸性溶液的pH偏大,错误;D、石蕊试纸不能准确测定溶液酸碱度,只能测出溶液是酸性、中性还是碱性,正确。故选D。
11.【答案】B
12.【答案】C
【解析】A、使酚酞变红色的溶液显碱性,pH大于7;B、使石蕊变蓝色的溶液显碱性,pH大于7;C、使石蕊变红色的溶液显酸性,pH小于7;D、使石蕊显紫色的是中性溶液,pH等于7。故选C。
13.【答案】A
【解析】A、高锰酸钾加热一段时间才分解,随着生成氧气量的增加,固体质量在不断减少,但是锰元素的质量不变,所以固体中锰元素的质量分数变大;反应结束后,固体质量不再减少,则固体中锰元素的质量分数也不再改变,正确;B、铜与硝酸银的反应生成银消耗铜,每消耗64份质量的铜则置换出216份质量的银,固体质量会增加,直至反应结束,错误;C、电解水生成氢气和氧气的体积比是2∶1,质量比是8∶1,错误;D、氢氧化钠是一种碱,无论加入多少水稀释,溶液仍显碱性,pH始终大于7,错误。故选A。
真题练习
14.【答案】A
【解析】pH越小,酸性越强,故选A。
15.【答案】C
【解析】pH越大碱性越强,酸性越弱。新鲜肉在变质过程中酸性减弱,碱性增强。故选C。
16.【答案】D
【解析】胃酸的主要成分是盐酸,pH小于7。A、橘子汁的pH小于7,呈酸性,不适合胃酸过多的人空腹食用;B、葡萄汁的pH小于7,呈酸性,不适合胃酸过多的人空腹食用;C、西瓜汁的pH小于7,呈酸性,不适合胃酸过多的人空腹食用;D、玉米粥的pH略大于7,呈弱碱性,胃酸过多的人,空腹时可以食用。故选D。
17.【答案】C
18.【答案】B
【解析】pH=7时表示盐酸和氢氧化钠恰好完全反应生成氯化钠和水。A、图中b点表示氢氧化钠和盐酸恰好完全反应,溶液中的溶质是氯化钠,选项说法正确;B、图中c点所示溶液pH大于7,溶液显碱性,滴加酚酞试液,溶液变红,选项说法错误;C、刚开始的时候溶液pH小于7,显酸性,所以是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中,选项说法正确;D、由a点到b点的pH变化过程证明酸和碱发生了中和反应,选项说法正确。故选B。
科知故事
白兰地——浓缩的精华
1701年西班牙战争爆发,航道不通影响葡萄酒的出口,这导致了葡萄酒大量变质。一位荷兰商人发现妻子香水的材料和葡萄一样都来源于植物,但经过蒸馏之后却有很长的保质期。于是他将葡萄酒蒸馏浓缩后长途运输,发现一点都没有变质,而且这种“浓缩葡萄酒”更加可口,于是开始直接售卖,人们给它起名为“白兰地”。
葡萄酒——意料之外的宠爱
传说葡萄酒起源于波斯古国。有一个国王很爱吃葡萄,有个臣子将很多葡萄密封在木桶中,想等到其他季节奉献给国王。为了防止别人偷吃,他在桶身贴上“毒药”字样,并将其藏到了冷宫中。然而一位寻死的妃子发现了“毒药”,于是喝下了葡萄发酵后的粘稠液体,竟然发现很好喝。于是妃子将桶装玉浆献给了国王,深得国王喜欢,妃子因此再度得宠。
课题2 酸和碱的中和反应
知识
一、溶液的酸碱性和酸碱度
1.溶液的酸碱性是指溶液呈酸性、中性或碱性,可以用____________________粗略测定。
2.溶液酸碱性的______________叫溶液的酸碱度,常用pH表示。pH的范围通常为______________。
二、pH与溶液酸碱性的关系
1.通常情况下:
pH ______ 7,溶液呈酸性,pH越______,酸性越强。
pH______ 7,溶液呈中性。
pH ______7,溶液呈碱性,pH越______,碱性越强。
注意:
酸的水溶液一定呈酸性,pH ______7;pH ______7的溶液一定呈酸性,________是酸溶液。
碱的水溶液一定呈碱性,pH ______7;pH ______7的溶液一定呈碱性,不一定是碱溶液。
2.pH的测定方法
(1)粗略测定(用pH试纸)
pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,将pH试纸显示的颜色与________________比较,读出该溶液的pH。
使用pH试纸是测定pH的最简单方法,只能粗略地测定溶液的酸碱度,测得的pH是________而不是________。
(2)精确测定(用pH计)
pH计又叫_________,是用来精确测定溶液酸碱度的仪器,pH计型号不同精确度也不同。
三、了解溶液的酸碱性的重要意义
1.化工生产中许多反应必须在___________溶液里才能进行。
2.在农业生产中,农作物一般适宜在pH为______________的土壤中生长。
3.测定雨水的pH(因溶解有_________,正常雨水的pH约为5.6,酸雨的pH______ 5.6),可以了解空气的污染情况。
酸雨的危害
4.测定人体内或排出的液体的pH,可以了解人体的健康状况。
人体某些体液的正常pH范围
血浆
唾液
胃液
乳汁
胆汁
胰液
尿液
pH
7.35~7.45
6.6~7.1
0.9~1.5
6.6~7.6
7.1~7.3
7.5~8.0
4.7~8.4
正常的人体体液中一定显酸性的是________________;一定显碱性的是____________________________。
5.洗发剂和护发剂
日常生活中,洗发时一般先用_____剂,后用 剂。洗发剂显 性,护发剂显_____ 性。
一、1.酸碱指示剂
2.强弱程度 0~14
二、1.< 小 = > 大
< < 不一定
> > 不一定
2.(1)标准比色卡 整数 小数
(2)酸度计
三、1.一定pH
2.7或接近7
3.CO2 小于
4.胃液 血浆、胆汁、胰液
5.洗发 护发 碱 酸
重点
一、pH试纸测定溶液酸碱度的注意事项
1.试纸不能直接深入溶液,以免污染溶液。
2.测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这将导致测量不准确,若该溶液为酸性溶液,则pH偏高,若该溶液为碱性溶液,则pH偏低。
3.用pH试纸只能粗略地测定溶液的酸碱度,测得的pH是整数而不能是小数。
二、溶液的稀释与溶液pH的关系
H+的浓度越大,溶液的酸性越强,pH越小;OH-的浓度越大,溶液的碱性越强,pH越大。溶液中H+或OH-的浓度改变,则pH会相应改变。
1.酸性溶液的pH小于7,向其中加水稀释,溶液中溶质质量分数减小,酸性减弱,溶液的pH增大,但不会增大到7(酸性溶液加水还是酸性,不会变成中性,所以pH不会增大到7)。
2.碱性溶液的pH大于7,向其中加水稀释,溶液中溶质质量分数减小,碱性减弱,溶液的pH减小,但不会减小到7(碱性溶液加水还是碱性,不会变成中性,所以pH不会减小到7)。
三、酸碱滴定曲线
1.向碱溶液中加入过量的酸
2.向酸溶液中加入过量的碱
典例1 (2019·平凉)化学实验操作的规范性、安全性是实验成败的关継,同时也反映了实验者的化学素养。下图所示的实验操作正确的是
【解析】A、过滤液体时,要遵循“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中操作错误;B、木炭燃烧生成物是气体,集气瓶中的气压不减小,不能形成气压差,水不会进入集气瓶中,不能测定出氧气的含量,图中操作错误;C、用pH试纸测定溶液的pH时,不能将试纸直接伸入待测液中,要用玻璃棒蘸取待测液或胶头滴管滴加在试纸上,然后将试纸显示的颜色与标准比色卡对照,图中操作错误;D、稀释浓硫酸时,要将浓硫酸沿器壁慢慢倒入水中,要用玻璃棒不断搅拌,以防液体沸腾溅出伤人,图中操作正确。故选D。
【答案】D
典例2 将40 g稀盐酸逐滴加入到20 g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
(1)图二从A到B过程中,溶液的pH逐渐________(填“增大”或“减小”)。
(2)图二表示酸碱恰好完全反应的点是____________。
(3)计算稀盐酸中溶质的质量分数。
【答案】(1)减小
(2)B
(3)3.65%
【解析】根据所学知识和题中信息知,(1)图二从A到B过程是酸与碱反应的过程,反应放热,溶液中的OH-的浓度不断减小,溶液的pH逐渐减小。(2)酸碱中和时,溶液恰好为中性,pH=7,故图二表示酸碱恰好完全反应的点是加入20 g稀盐酸对于的B点。
(3)解:设稀盐酸中溶质的质量分数为x。
NaOH+HClNaCl+H2O
40 36.5
20 g×4% 20 g×x
=
解得:x=3.65%
答:稀盐酸中溶质的质量分数是3.65%。
基础训练
1.下列生活中常见的物质,呈碱性的是
A.雪碧pH=3.5 B.牛奶pH=6.5
C.矿泉水pH=7 D.肥皂水pH=9.5
2.测定pH最简单的方法是使用
A.石蕊溶液 B.澄清石灰水
C.酚酞溶液 D.pH试纸
3.土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是
植物
花生
苹果
西瓜
沙枣
适宜的pH范围
5.0~6.0
5.0~6.5
6.0~7.0
8.0~8.7
A.花生
B.苹果
C.西瓜
D.沙枣
4.某同学用pH计测得生活中一些物质得pH如表。下列说法错误的是
物质
肥皂水
牙膏
西瓜汁
食醋
pH
10.2
8.5
5.8
2.4
A.牙膏显碱性
B.西瓜汁显酸性
C.肥皂水中滴入紫色石蕊试液显红色
D.胃酸过多的人不宜食用过多的食醋
5.下图X、Y、Z表示某些物质的pH。下列判断正确的是
A.X一定是酸 B.Y一定是蒸馏水
C.Z一定是碱 D.Z可能是盐
6.在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图见下图。下列有关认识错误的是
A.反应结束时溶液的pH=7
B.反应前后元素的种类没有变化
C.酸与碱的反应属于中和反应
D.该微观图还可说明所有物质都是由分子构成的
7.下列指定反应的化学方程式正确的是
A.镁条在氧气中燃烧:Mg+O2MgO2
B.古代湿法炼铜:2Fe+3CuSO4Fe2(SO4)3+3Cu
C.酸雨形成原因:CO2+H2OH2CO3
D.用胃舒平[含Al(OH)3]治疗胃酸过多:Al(OH)3+3HClAlCl3+3H2O
8.某中学化学课外活动小组的同学,监测一次降雨过程中雨水的pH。取雨水水样,用pH计(测pH的仪器)测得数据如下:
测定时间
5∶05
5∶15
5∶25
5∶35
5∶45
pH
4.95
4.94
4.86
4.84
4.84
小组同学对数据的分析推理错误的是
A.本次降雨通常会影响作物的生长
B.在测定期间雨水的酸性逐渐减弱
C.本次降雨对大理石建筑有腐蚀作用
D.当时空气中二氧化硫的含量可能超标
9.向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如图所示。试剂X是下列物质中的
A.Mg B.H2O
C.NaOH D.CaCO3
能力提升
10.用pH试纸可以测定溶液的酸碱度,下列说法正确的是
A.测定时将pH试纸直接伸入待测液中
B.与标准比色卡比照后,得出某溶液pH为5.6
C.用湿润pH试纸测得的溶液pH一定偏小
D.石蕊试纸不能准确测定溶液酸碱度
11.某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像,如图所示。下列说法正确的是
A.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
B.图中b点表示硫酸和氢氧化钠溶液恰好完全反应
C.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
D.向c点溶液中滴入紫色石蕊试液,溶液变蓝色
12.下列溶液中pH最小的是
A.使酚酞变红的溶液
B.使石蕊变蓝色的溶液
C.使石蕊变红的溶液
D.使石蕊变紫色的溶液
13.下列所示的四个图像,能正确反映对应变化关系的是
A.加热一定质量的高锰酸钾
B.把一定质量的铜片加入到硝酸银溶液
C.电解水
D.向一定量的氢氧化钠溶液中加水稀释
真题练习
14.[2019·天津]人体中一些体液或排泄物的pH范围如下,其中酸性最强的是
A.胃液0.9~1.5 B.唾液6.6~7.1
C.尿液4.7~8.4 D.胰液7.5~8.0
15.[2019·自贡]肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如下表,则新鲜肉在变质过程中酸性如何变化
名称
新鲜肉
次鲜肉
变质肉
pH
5.8﹣6.2
6.3~6.6
>6.6
A.不变 B.变强 C.变弱 D.无法确定
16.[2019·辽宁]下列食物中,胃酸过多的人空腹时最适宜食用的是
食物
橘子汁
葡萄汁
西瓜汁
玉米粥
pH
3.4~3.8
3.6~4.5
5.6~6.1
6.8~8.0
A.橘子汁 B.葡萄汁 C.西瓜汁 D.玉米粥
17.[2019·重庆]已知生活中厕所清洁剂的pH=1,厨房清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高
B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果
D.厕所清洁剂可能使铁制下水道腐蚀
18.[2019·梧州]某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
参考答案
基础训练
1.【答案】D
2.【答案】D
【解析】A、石蕊溶液只能粗略的测定溶液的酸碱性,不能测出溶液的具体pH,错误;B、澄清石灰水不能测出溶液的pH,错误;C、酚酞溶液只能粗略的测定出溶液是否显碱性,不能测出溶液的具体pH,错误;D、pH试纸可以测出溶液的酸碱度,正确。故选D。
3.【答案】D
【解析】沙枣适宜的pH范围为碱性,不适宜在微酸性的土壤中种植。
4.【答案】C
【解析】A、牙膏pH=8.5>7显碱性,正确;B、西瓜汁pH=5.8<7显酸性,故正确;C、肥皂水的pH=10.2,呈碱性,能使石蕊试液变蓝,故错误;D、食醋的pH=2.4,呈酸性,故胃酸过多的人不宜食用过多的食醋,正确。故选C。
5.【答案】D
【解析】A、X溶液的pH小于7,只能说明该溶液显酸性,不能说明是酸,错误;B、Y溶液的pH=7,说明该溶液显中性,不能说明是水,错误;C、Z溶液的pH大于7,说明溶液显碱性,不能说明溶液是碱,错误;D、盐溶液也可能显碱性,正确。故选D。
6.【答案】D
【解析】A、反应结束时溶液呈中性,pH=7,故A正确;B、反应前后元素的种类没有变化,故B正确;C、酸与碱的反应属于中和反应,故C正确;D、该微观图并不可说明所有物质都是由分子构成的,故D错误。故选D。
7.【答案】D
8.【答案】B
【解析】二氧化硫、氮氧化物是形成酸雨的重要物质,酸雨能够腐蚀建筑物、毁坏森林树木、使水体、土壤酸化等。A、本次降雨属于酸雨,通常会影响作物的生长,故A正确;B、pH越小,酸性越强,故在测定期间雨水的酸性逐渐增强,故B错误;C、本次降雨对大理石建筑有腐蚀作用,故C正确;D、当时空气中二氧化硫的含量可能超标(酸雨有三种类型,硫酸型、硝酸型和混合型,所以是可能为二氧化硫超标),故D正确。故选B。
9.【答案】C
【解析】解答本题的关键应明确两点:(1)pH与溶液酸碱性的关系;(2)酸与其他物质反应溶液的酸碱性变化规律。A、根据题目的函数图像,加入X物质后溶液的pH变大,直到大于7,向稀盐酸中加入Mg,能与酸反应,pH增大,盐酸完全反应后,pH等于7,不会大于7,错误;B、向盐酸中加水,pH变大,但永远小于7,错误;C、加入NaOH,盐酸完全反应后,再加入NaOH,溶液呈碱性,pH大于7,正确;D、加入碳酸钙,与盐酸完全反应后,溶液呈中性,pH不会大于7,错误。故选C。
能力提升
10.【答案】D
【解析】A、测定时用玻璃棒蘸取待测液滴在pH试纸上,错误;B、用pH试纸测得液体的pH,只能精确到整数,错误;C、用湿润pH试纸测得碱性溶液的pH偏小,测得酸性溶液的pH偏大,错误;D、石蕊试纸不能准确测定溶液酸碱度,只能测出溶液是酸性、中性还是碱性,正确。故选D。
11.【答案】B
12.【答案】C
【解析】A、使酚酞变红色的溶液显碱性,pH大于7;B、使石蕊变蓝色的溶液显碱性,pH大于7;C、使石蕊变红色的溶液显酸性,pH小于7;D、使石蕊显紫色的是中性溶液,pH等于7。故选C。
13.【答案】A
【解析】A、高锰酸钾加热一段时间才分解,随着生成氧气量的增加,固体质量在不断减少,但是锰元素的质量不变,所以固体中锰元素的质量分数变大;反应结束后,固体质量不再减少,则固体中锰元素的质量分数也不再改变,正确;B、铜与硝酸银的反应生成银消耗铜,每消耗64份质量的铜则置换出216份质量的银,固体质量会增加,直至反应结束,错误;C、电解水生成氢气和氧气的体积比是2∶1,质量比是8∶1,错误;D、氢氧化钠是一种碱,无论加入多少水稀释,溶液仍显碱性,pH始终大于7,错误。故选A。
真题练习
14.【答案】A
【解析】pH越小,酸性越强,故选A。
15.【答案】C
【解析】pH越大碱性越强,酸性越弱。新鲜肉在变质过程中酸性减弱,碱性增强。故选C。
16.【答案】D
【解析】胃酸的主要成分是盐酸,pH小于7。A、橘子汁的pH小于7,呈酸性,不适合胃酸过多的人空腹食用;B、葡萄汁的pH小于7,呈酸性,不适合胃酸过多的人空腹食用;C、西瓜汁的pH小于7,呈酸性,不适合胃酸过多的人空腹食用;D、玉米粥的pH略大于7,呈弱碱性,胃酸过多的人,空腹时可以食用。故选D。
17.【答案】C
18.【答案】B
【解析】pH=7时表示盐酸和氢氧化钠恰好完全反应生成氯化钠和水。A、图中b点表示氢氧化钠和盐酸恰好完全反应,溶液中的溶质是氯化钠,选项说法正确;B、图中c点所示溶液pH大于7,溶液显碱性,滴加酚酞试液,溶液变红,选项说法错误;C、刚开始的时候溶液pH小于7,显酸性,所以是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中,选项说法正确;D、由a点到b点的pH变化过程证明酸和碱发生了中和反应,选项说法正确。故选B。
科知故事
白兰地——浓缩的精华
1701年西班牙战争爆发,航道不通影响葡萄酒的出口,这导致了葡萄酒大量变质。一位荷兰商人发现妻子香水的材料和葡萄一样都来源于植物,但经过蒸馏之后却有很长的保质期。于是他将葡萄酒蒸馏浓缩后长途运输,发现一点都没有变质,而且这种“浓缩葡萄酒”更加可口,于是开始直接售卖,人们给它起名为“白兰地”。
葡萄酒——意料之外的宠爱
传说葡萄酒起源于波斯古国。有一个国王很爱吃葡萄,有个臣子将很多葡萄密封在木桶中,想等到其他季节奉献给国王。为了防止别人偷吃,他在桶身贴上“毒药”字样,并将其藏到了冷宫中。然而一位寻死的妃子发现了“毒药”,于是喝下了葡萄发酵后的粘稠液体,竟然发现很好喝。于是妃子将桶装玉浆献给了国王,深得国王喜欢,妃子因此再度得宠。
同课章节目录
