苏教版高中化学选修3 专题4 第一单元 分子的极性 手性分子(共23张PPT)
文档属性
| 名称 | 苏教版高中化学选修3 专题4 第一单元 分子的极性 手性分子(共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 17.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-22 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
分子的极性、手性分子
分子的极性
课本54页拓展视野
δ-
δ+
δ+
一、分子的极性——定义
1.极性分子:正电荷重心和负电荷重心不重合的分子称为极性分子。
2.非极性分子:正电荷重心和负电荷重心重合的分子称为非极性分子。
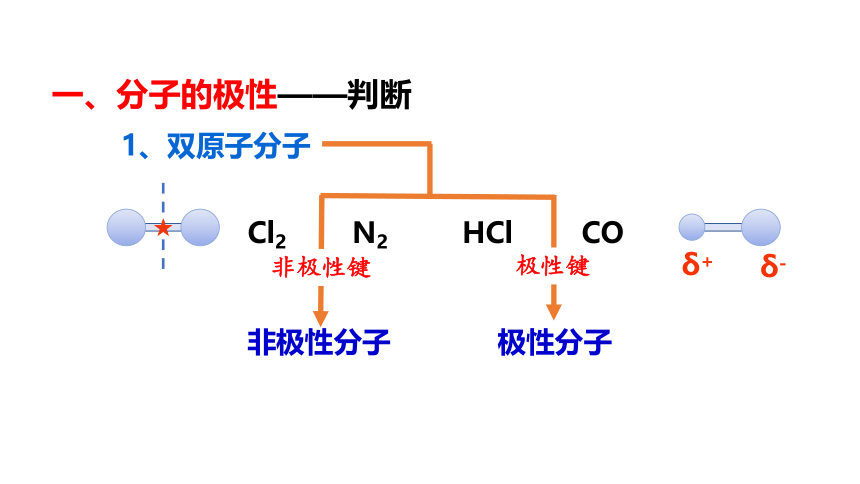
一、分子的极性——判断
1、双原子分子
Cl2 N2 HCl CO
非极性分子
δ+
δ-
极性分子
非极性键
极性键
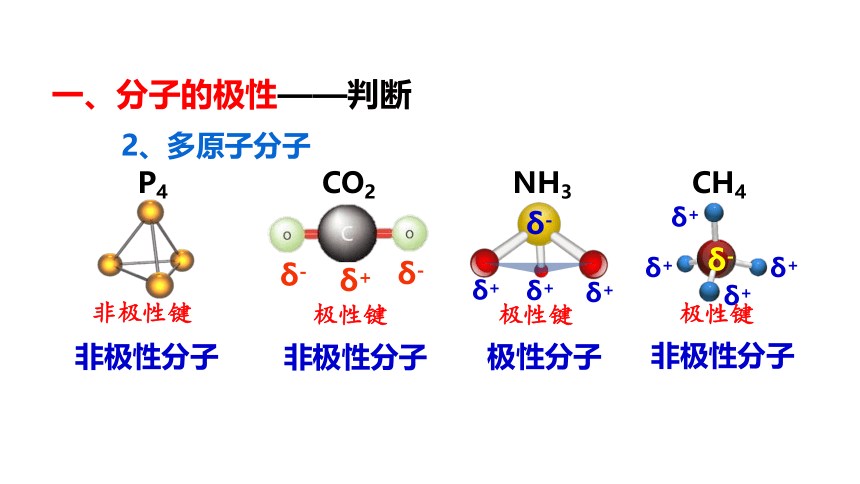
一、分子的极性——判断
2、多原子分子
P4 CO2 NH3 CH4
δ-
δ+
δ-
非极性分子
非极性键
极性键
非极性分子
δ-
δ+
δ+
δ+
极性分子
极性键
δ-
δ+
δ+
δ+
δ+
极性键
非极性分子
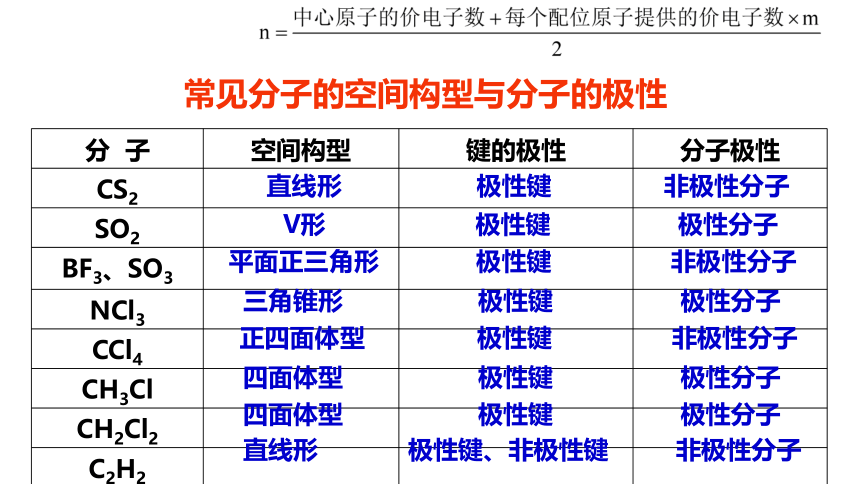
分 子 空间构型 键的极性 分子极性
CS2
SO2
BF3、SO3
NCl3
CCl4
CH3Cl
CH2Cl2
C2H2
直线形 极性键 非极性分子
V形 极性键 极性分子
平面正三角形 极性键 非极性分子
三角锥形 极性键 极性分子
正四面体型 极性键 非极性分子
四面体型 极性键 极性分子
四面体型 极性键 极性分子
直线形 极性键、非极性键 非极性分子
常见分子的空间构型与分子的极性
一、分子的极性——判断
3、ABm型分子极性的判断方法
(1)中心原子A的化合价的绝对值=A原子的最外层电子数,是非极性分子;
(2)中心原子A的化合价的绝对值≠A原子的最外层电子数,是极性分子。
一、分子的极性——影响
一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。
[相似相溶原理]
一、分子的极性——影响
请用相似相溶原理解释“用苯或者四氯化碳可以萃取碘水中的碘。”
手性分子
一对分子,他们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称手性异构体
有手性异构体的分子称为手性分子
二、手性分子——定义
二、手性分子——结构特征
同一个碳原子上连接4个不相同的原子或基团
手性碳原子
(用*C表示)
二、手性分子
手性异构、对映异构、旋光异构
沙利度胺事件
医药史上的悲剧
沙利度胺作为一个手性化合物,其一种异构体具有抑制妊娠反应活性,而另一种异构体有致畸性。
1
2
3
目前沙利度胺在麻风病、风湿性关节炎、自身免疫性红斑狼疮、HIV-I感染等难治性疾病的临床研究中都显示出了很好的疗效。
历史教训要铭记在心
科学研究要严谨细心
课堂巩固
1、判断乙烯、苯、 PCl3、CCl4、SO3分子的极性?
非极性分子
极性分子
课堂巩固
2、下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
3、判断下列分子为手性分子的是( )
B
B
定义法
化合价法
双原子分子
分子极性同化学键的极性
多原子分子
分子极性还与空间构型有关
共价键的极性与
分子极性关系
熟记常见分子空间构型
常见分子空间构型
非极性分子易溶于非极性溶剂
极性分子易溶于极性溶剂
相似相溶原理的应用
分
性
子
极
分子极性的判断方法
课堂小结:
课堂小结:
R1 — C — R2
R3
R4
手性分子
R1、R2、R3、R4各不相同
手性碳原子
*
分子的极性、手性分子
分子的极性
课本54页拓展视野
δ-
δ+
δ+
一、分子的极性——定义
1.极性分子:正电荷重心和负电荷重心不重合的分子称为极性分子。
2.非极性分子:正电荷重心和负电荷重心重合的分子称为非极性分子。
一、分子的极性——判断
1、双原子分子
Cl2 N2 HCl CO
非极性分子
δ+
δ-
极性分子
非极性键
极性键
一、分子的极性——判断
2、多原子分子
P4 CO2 NH3 CH4
δ-
δ+
δ-
非极性分子
非极性键
极性键
非极性分子
δ-
δ+
δ+
δ+
极性分子
极性键
δ-
δ+
δ+
δ+
δ+
极性键
非极性分子
分 子 空间构型 键的极性 分子极性
CS2
SO2
BF3、SO3
NCl3
CCl4
CH3Cl
CH2Cl2
C2H2
直线形 极性键 非极性分子
V形 极性键 极性分子
平面正三角形 极性键 非极性分子
三角锥形 极性键 极性分子
正四面体型 极性键 非极性分子
四面体型 极性键 极性分子
四面体型 极性键 极性分子
直线形 极性键、非极性键 非极性分子
常见分子的空间构型与分子的极性
一、分子的极性——判断
3、ABm型分子极性的判断方法
(1)中心原子A的化合价的绝对值=A原子的最外层电子数,是非极性分子;
(2)中心原子A的化合价的绝对值≠A原子的最外层电子数,是极性分子。
一、分子的极性——影响
一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。
[相似相溶原理]
一、分子的极性——影响
请用相似相溶原理解释“用苯或者四氯化碳可以萃取碘水中的碘。”
手性分子
一对分子,他们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称手性异构体
有手性异构体的分子称为手性分子
二、手性分子——定义
二、手性分子——结构特征
同一个碳原子上连接4个不相同的原子或基团
手性碳原子
(用*C表示)
二、手性分子
手性异构、对映异构、旋光异构
沙利度胺事件
医药史上的悲剧
沙利度胺作为一个手性化合物,其一种异构体具有抑制妊娠反应活性,而另一种异构体有致畸性。
1
2
3
目前沙利度胺在麻风病、风湿性关节炎、自身免疫性红斑狼疮、HIV-I感染等难治性疾病的临床研究中都显示出了很好的疗效。
历史教训要铭记在心
科学研究要严谨细心
课堂巩固
1、判断乙烯、苯、 PCl3、CCl4、SO3分子的极性?
非极性分子
极性分子
课堂巩固
2、下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
3、判断下列分子为手性分子的是( )
B
B
定义法
化合价法
双原子分子
分子极性同化学键的极性
多原子分子
分子极性还与空间构型有关
共价键的极性与
分子极性关系
熟记常见分子空间构型
常见分子空间构型
非极性分子易溶于非极性溶剂
极性分子易溶于极性溶剂
相似相溶原理的应用
分
性
子
极
分子极性的判断方法
课堂小结:
课堂小结:
R1 — C — R2
R3
R4
手性分子
R1、R2、R3、R4各不相同
手性碳原子
*
