苏教版必修二专题1第二单元1.2.3分子间作用力课件(20张PPT)
文档属性
| 名称 | 苏教版必修二专题1第二单元1.2.3分子间作用力课件(20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-23 10:37:42 | ||
图片预览







文档简介
(共20张PPT)
第二单元:微粒间的相互作用力
第三课时 分子间作用力
本节重点
1、了解分子间作用力的含义,
2、掌握分子间作用力对分子构成的物质
某些物理性质的影响。
3、了解氢键的概念及氢键对物质性质的影响
本节难点
分子间作用力的含义,
分子间作用力对分子构成的物质某些物理性质的影响
冰液化、气化现象是物理变化还是化学变化?
冰液化、气化过程中有没有破坏其中的化学键?
那为什么冰液化、气化过程仍要吸收能量呢?
学前导入
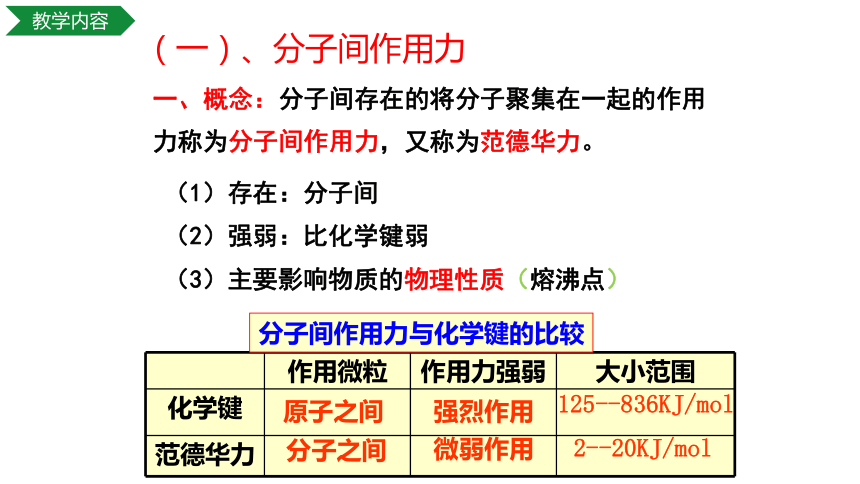
(一)、分子间作用力
(1)存在:分子间
一、概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点)
作用微粒 作用力强弱 大小范围
化学键
范德华力
原子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
教学内容
【问题】
分子间作用力如何影响物质的物理性质?
教学内容
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
卤族元素单质物理性质差异
教学内容
【拓展视野】
一般情况下,相同类型的分子,相对分子量越大,分子间作用力越大,熔沸点越高
比较下列物质的熔沸点的高低
CF4 _ CCl4 _ CBr4 _ CI4
<
<
<
教学内容
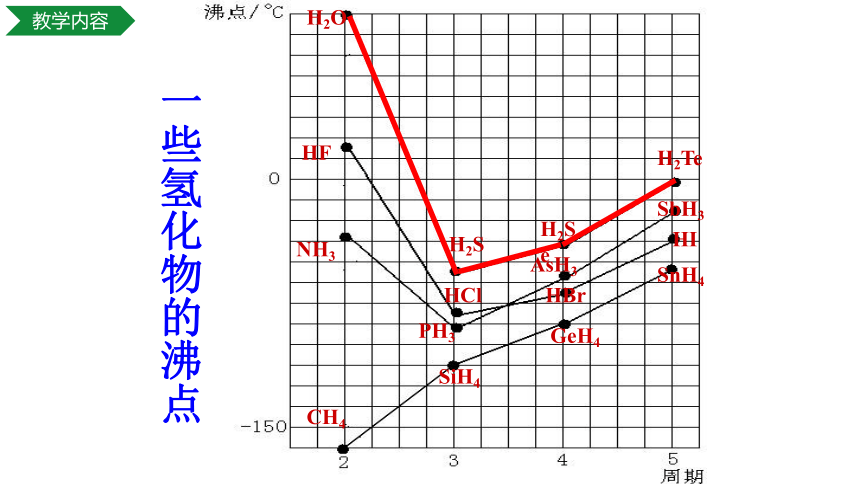
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
NH3
PH3
AsH3
SbH3
CH4
SiH4
GeH4
SnH4
一些氢化物的沸点
教学内容
猜想:
H2O、 NH3、 HF除了分子间作用力之外,是否还存在一种作用力?
结论:
H2O 、NH3 、HF比同主族氢化物的沸点高?
教学内容
相邻但不强烈
(不形成化学键)
相邻而且强烈
(叫氢氧键)
O
O
O
H
H
H
H
H
H
H2O中氢键的形成过程
教学内容
水分子间形成的氢键
在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
教学内容
氢键是化学键吗?
氢键是一种特殊的分子间作用力。不属于化学键。
含有氢键的物质有:H2O、HF、NH3 、乙醇
(二).氢键
教学内容
氢键对物理性质的影响:
⑴氢键的存在使物质的熔沸点相对较高
⑵解释一些反常现象:如水结成冰时,体积膨胀。
教学内容
1.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.HF、HCl、HBr、HI的热稳定性依次减弱
D.CH4、SiH4、GeH4 、SnH4的熔点随相对分子质量的增大而升高
B
练习
随堂练习
2、下列化合物中只有共价键的是( )
A. BaCl2 B. NaOH
C. (NH4)2SO4 D. H2SO4
练习
D
随堂练习
练习
3、共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是( )
A.CO2 B.NaCl
C.NaOH D.I2
B
随堂练习
归纳小结
本节我们重点学习了分子间作用力的概念,要知道哪些物质间存在分子间作用力,分子间作用力对物理性质中熔沸点的影响。对氢键的概念只需了解,知道常见物质中哪些存在氢键,对物质性质的影响。
板书设计
分子间作用力
(一)、分子间作用力
一、概念
1、存在 2、强弱
3、主要影响的物理性质(熔沸点)
一般情况下,相同类型的分子,相对分子量越大,分子间作用力越大,熔沸点越高
二.氢键
氢键是一种特殊的分子间作用力。不属于化学键。
课后作业
课后习题
P17 1---7
第二单元:微粒间的相互作用力
第三课时 分子间作用力
本节重点
1、了解分子间作用力的含义,
2、掌握分子间作用力对分子构成的物质
某些物理性质的影响。
3、了解氢键的概念及氢键对物质性质的影响
本节难点
分子间作用力的含义,
分子间作用力对分子构成的物质某些物理性质的影响
冰液化、气化现象是物理变化还是化学变化?
冰液化、气化过程中有没有破坏其中的化学键?
那为什么冰液化、气化过程仍要吸收能量呢?
学前导入
(一)、分子间作用力
(1)存在:分子间
一、概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点)
作用微粒 作用力强弱 大小范围
化学键
范德华力
原子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
教学内容
【问题】
分子间作用力如何影响物质的物理性质?
教学内容
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
卤族元素单质物理性质差异
教学内容
【拓展视野】
一般情况下,相同类型的分子,相对分子量越大,分子间作用力越大,熔沸点越高
比较下列物质的熔沸点的高低
CF4 _ CCl4 _ CBr4 _ CI4
<
<
<
教学内容
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
NH3
PH3
AsH3
SbH3
CH4
SiH4
GeH4
SnH4
一些氢化物的沸点
教学内容
猜想:
H2O、 NH3、 HF除了分子间作用力之外,是否还存在一种作用力?
结论:
H2O 、NH3 、HF比同主族氢化物的沸点高?
教学内容
相邻但不强烈
(不形成化学键)
相邻而且强烈
(叫氢氧键)
O
O
O
H
H
H
H
H
H
H2O中氢键的形成过程
教学内容
水分子间形成的氢键
在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
教学内容
氢键是化学键吗?
氢键是一种特殊的分子间作用力。不属于化学键。
含有氢键的物质有:H2O、HF、NH3 、乙醇
(二).氢键
教学内容
氢键对物理性质的影响:
⑴氢键的存在使物质的熔沸点相对较高
⑵解释一些反常现象:如水结成冰时,体积膨胀。
教学内容
1.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.HF、HCl、HBr、HI的热稳定性依次减弱
D.CH4、SiH4、GeH4 、SnH4的熔点随相对分子质量的增大而升高
B
练习
随堂练习
2、下列化合物中只有共价键的是( )
A. BaCl2 B. NaOH
C. (NH4)2SO4 D. H2SO4
练习
D
随堂练习
练习
3、共价键、离子键和分子间作用力是构成物质微粒间的不同的作用方式,下列物质中只含有上述一种作用的是( )
A.CO2 B.NaCl
C.NaOH D.I2
B
随堂练习
归纳小结
本节我们重点学习了分子间作用力的概念,要知道哪些物质间存在分子间作用力,分子间作用力对物理性质中熔沸点的影响。对氢键的概念只需了解,知道常见物质中哪些存在氢键,对物质性质的影响。
板书设计
分子间作用力
(一)、分子间作用力
一、概念
1、存在 2、强弱
3、主要影响的物理性质(熔沸点)
一般情况下,相同类型的分子,相对分子量越大,分子间作用力越大,熔沸点越高
二.氢键
氢键是一种特殊的分子间作用力。不属于化学键。
课后作业
课后习题
P17 1---7
