苏教版必修二专题二第二单元2.2.2 热化学方程式 燃料燃烧释放的热量(26张PPT)
文档属性
| 名称 | 苏教版必修二专题二第二单元2.2.2 热化学方程式 燃料燃烧释放的热量(26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 818.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-22 20:48:29 | ||
图片预览







文档简介
(共26张PPT)
组织建设
化学 · 必修2
热化学方程式 燃料燃烧释放的热量
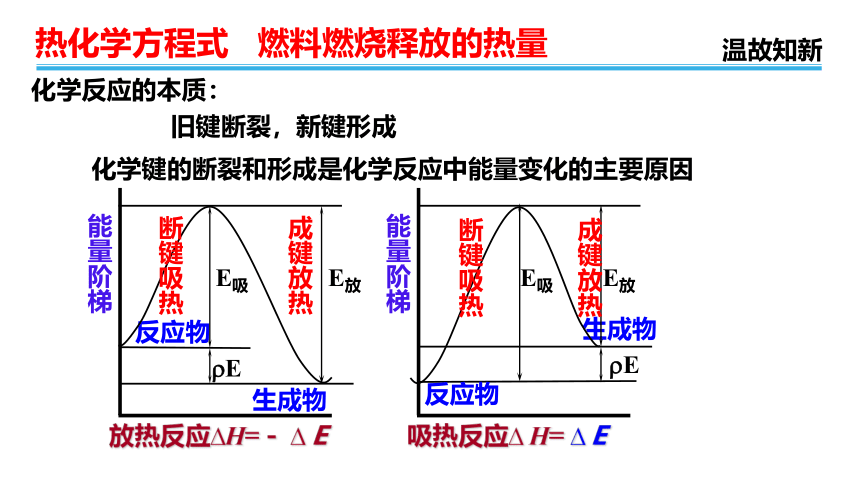
化学反应的本质:
旧键断裂,新键形成
化学键的断裂和形成是化学反应中能量变化的主要原因
能量阶梯
反应物
生成物
?E
断键吸热
E吸
E放
成键放热
能量阶梯
反应物
生成物
?E
断键吸热
E吸
E放
成键放热
放热反应?H=- ?E
吸热反应? H= ?E
温故知新
能量
阶梯
能量
阶梯
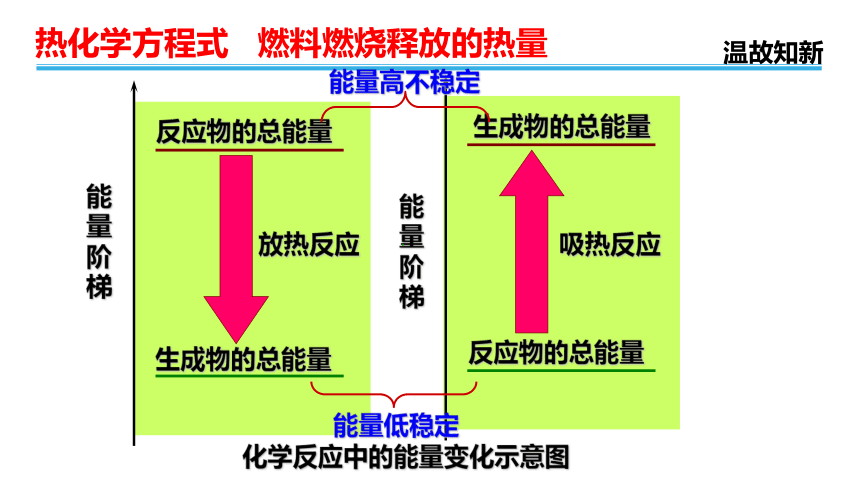
反应物的总能量
生成物的总能量
反应物的总能量
生成物的总能量
放热反应
吸热反应
化学反应中的能量变化示意图
能量低稳定
能量高不稳定
温故知新
三、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式
如:C(s)+O2(g)==CO2(g) △H=-393.5kJ ?mol-1
2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ ?mol-1
CaCO3(s) == CaO(s) +CO2(g) △H= + 178.5 kJ/mol
如何用化学用语表示放热反应和吸热反应?
问题探讨
3、已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。
你能根据以上所给的数据判断反应: 2H2(g)+O2(g)=2H2O(g)
是放热反应吗?
H-O-H
484 kJ
课堂巩固
则热化学方程式为
2H2(g)+O2(g)=2H2O(g)
△H =-484 kJ ?mol- 1
观察比较
氢气燃烧的化学方程式:2H2 + O2 == 2H2O
点燃
氢气燃烧的热化学方程式
① 2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ ?mol- 1
② H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ ?mol- 1
③ H2(g) +1/2 O2(g) =H2O(g) △H =-241.8 kJ ?mol-1
2H2(g)+O2(g)=2H2O(g) △H =-484 kJ ?mol- 1
2、热化学方程式书写原则
a.标明物质状态:用g、l、s分别代表气态(gas)、液态 (liquid)、固态(solid)
b .用△H 标明反应放出或吸收的热量,放热为负值,吸热为正值, 数值与测定条件有关。
c.热化学方程式中各物质前的化学计量数仅表示物质的量 ,不表示分子个数,因此可以是整数或分数。
d.对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
总结感悟
1、关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.放热反应在常温下一定能发生
C.吸热反应在常温下不一定不能发生
D.一个可逆反应,如果正反应是放热反应,则逆反应就是吸热反应
AB
当堂练习
2、在101325Pa和25oC条件下,2molH2与1molO2反应放出484kJ热量,下列热化学方程式正确的是( )
A.2H2+O2=2H2O ? H=-484kJ/mol
B.H2O(l)= H2(g)+ 1/2O2(g) ? H=+242kJ/mol
C.2H2(g)+ O2(g)=2H2O(g) ? H=-484kJ/mol
D.H2(g)+1/2 O2(g)= H2O(l) ? H=+242kJ/mol
B
3、已知每1 mol 乙醇完全燃烧生成二氧化碳和液态水时将放出1366.8kJ热量,写出该反应的热化学方程式。
C2H6O(l)+3O2(g)==2CO2(g)+3H2O(l) ?H=-1366.8kJ/mol
当堂练习
4、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5kJ热量,乙硼烷燃烧的热化学方程式为: 。
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) ?H= -2165kJ/mol
当堂练习
当今人类所使用的燃料主要有哪些?
化石燃料
几种燃料的热值
物质 天然气 石油 煤炭 氢气 甲醇
热值/kJ·g-1 约56 约48 约33 143 23
热值:在一定条件下单位质量的物质完全燃烧所放出的热量
问题思考
目前世界石油、天然气和煤炭的储量
节约能源很重要
拓宽视野
燃料的充分燃烧要满足哪些条件?
燃烧时要有适当过量的氧气。
燃料与空气要有足够大的接触面积
工业上采取粉碎固体燃煤的方法,采用”喷雾”式的燃烧工艺,以增大燃料与空气的接触面,提高效率;
有些液体燃料也可以采用气化方式,提高与空气的接触面积。
煤的燃烧:直接燃烧会生成SO2,导致酸雨
问题讨论
拓宽视野
近年来我国化石燃料和水电消耗
拓宽视野
核能
英国的原子能发电站
拓宽视野
太阳能发电装置
拓宽视野
太阳能
拓宽视野
现在风能已成为一种新能源而被人们广泛地使用。如右图的风力发电机,可以为人们发电。
风能
拓宽视野
生物质能
拓宽视野
羊八井地热电站
其他新能源
拓宽视野
江厦潮汐试验电站
其他新能源
拓宽视野
(1)需注明反应的温度和压强(如不注明,指常温常压)
(2)注明?H并注明 “+”或“-”,单位kJ·mol-1
(3)要注明反应物和生成物的状态
gas liquid solid
(4)热化学方程式的化学计量数只表示物质的量,所以化学计量数可以是分数、小数
(5)化学计量数与?H成正比
书写热化学方程式时应注意:
本课小结
①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1
③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ ? mol-1
1、判断下列热化学反应方程式书写是否正确?
×
×
×
课堂巩固
2、下列热化学方程式书写正确的是( )
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
C
课堂巩固
3、书写下列热化学方程式:
1、在25℃101kPa时,4.0g硫粉在O2中完全燃烧生成SO2,放出37kJ的热量;
2、在25℃101kPa时,1g甲醇(CH4O,液态)完全燃烧生成CO2和液态水时放出22.68kJ的热量。
课堂巩固
组织建设
化学 · 必修2
热化学方程式 燃料燃烧释放的热量
化学反应的本质:
旧键断裂,新键形成
化学键的断裂和形成是化学反应中能量变化的主要原因
能量阶梯
反应物
生成物
?E
断键吸热
E吸
E放
成键放热
能量阶梯
反应物
生成物
?E
断键吸热
E吸
E放
成键放热
放热反应?H=- ?E
吸热反应? H= ?E
温故知新
能量
阶梯
能量
阶梯
反应物的总能量
生成物的总能量
反应物的总能量
生成物的总能量
放热反应
吸热反应
化学反应中的能量变化示意图
能量低稳定
能量高不稳定
温故知新
三、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式
如:C(s)+O2(g)==CO2(g) △H=-393.5kJ ?mol-1
2H2(g)+O2(g)==2H2O(l) △H=-571.6 kJ ?mol-1
CaCO3(s) == CaO(s) +CO2(g) △H= + 178.5 kJ/mol
如何用化学用语表示放热反应和吸热反应?
问题探讨
3、已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。
你能根据以上所给的数据判断反应: 2H2(g)+O2(g)=2H2O(g)
是放热反应吗?
H-O-H
484 kJ
课堂巩固
则热化学方程式为
2H2(g)+O2(g)=2H2O(g)
△H =-484 kJ ?mol- 1
观察比较
氢气燃烧的化学方程式:2H2 + O2 == 2H2O
点燃
氢气燃烧的热化学方程式
① 2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ ?mol- 1
② H2(g) + 1/2O2(g) = H2O(l) △H =-285.8 kJ ?mol- 1
③ H2(g) +1/2 O2(g) =H2O(g) △H =-241.8 kJ ?mol-1
2H2(g)+O2(g)=2H2O(g) △H =-484 kJ ?mol- 1
2、热化学方程式书写原则
a.标明物质状态:用g、l、s分别代表气态(gas)、液态 (liquid)、固态(solid)
b .用△H 标明反应放出或吸收的热量,放热为负值,吸热为正值, 数值与测定条件有关。
c.热化学方程式中各物质前的化学计量数仅表示物质的量 ,不表示分子个数,因此可以是整数或分数。
d.对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
总结感悟
1、关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.放热反应在常温下一定能发生
C.吸热反应在常温下不一定不能发生
D.一个可逆反应,如果正反应是放热反应,则逆反应就是吸热反应
AB
当堂练习
2、在101325Pa和25oC条件下,2molH2与1molO2反应放出484kJ热量,下列热化学方程式正确的是( )
A.2H2+O2=2H2O ? H=-484kJ/mol
B.H2O(l)= H2(g)+ 1/2O2(g) ? H=+242kJ/mol
C.2H2(g)+ O2(g)=2H2O(g) ? H=-484kJ/mol
D.H2(g)+1/2 O2(g)= H2O(l) ? H=+242kJ/mol
B
3、已知每1 mol 乙醇完全燃烧生成二氧化碳和液态水时将放出1366.8kJ热量,写出该反应的热化学方程式。
C2H6O(l)+3O2(g)==2CO2(g)+3H2O(l) ?H=-1366.8kJ/mol
当堂练习
4、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5kJ热量,乙硼烷燃烧的热化学方程式为: 。
B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) ?H= -2165kJ/mol
当堂练习
当今人类所使用的燃料主要有哪些?
化石燃料
几种燃料的热值
物质 天然气 石油 煤炭 氢气 甲醇
热值/kJ·g-1 约56 约48 约33 143 23
热值:在一定条件下单位质量的物质完全燃烧所放出的热量
问题思考
目前世界石油、天然气和煤炭的储量
节约能源很重要
拓宽视野
燃料的充分燃烧要满足哪些条件?
燃烧时要有适当过量的氧气。
燃料与空气要有足够大的接触面积
工业上采取粉碎固体燃煤的方法,采用”喷雾”式的燃烧工艺,以增大燃料与空气的接触面,提高效率;
有些液体燃料也可以采用气化方式,提高与空气的接触面积。
煤的燃烧:直接燃烧会生成SO2,导致酸雨
问题讨论
拓宽视野
近年来我国化石燃料和水电消耗
拓宽视野
核能
英国的原子能发电站
拓宽视野
太阳能发电装置
拓宽视野
太阳能
拓宽视野
现在风能已成为一种新能源而被人们广泛地使用。如右图的风力发电机,可以为人们发电。
风能
拓宽视野
生物质能
拓宽视野
羊八井地热电站
其他新能源
拓宽视野
江厦潮汐试验电站
其他新能源
拓宽视野
(1)需注明反应的温度和压强(如不注明,指常温常压)
(2)注明?H并注明 “+”或“-”,单位kJ·mol-1
(3)要注明反应物和生成物的状态
gas liquid solid
(4)热化学方程式的化学计量数只表示物质的量,所以化学计量数可以是分数、小数
(5)化学计量数与?H成正比
书写热化学方程式时应注意:
本课小结
①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1
③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ ? mol-1
1、判断下列热化学反应方程式书写是否正确?
×
×
×
课堂巩固
2、下列热化学方程式书写正确的是( )
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
C
课堂巩固
3、书写下列热化学方程式:
1、在25℃101kPa时,4.0g硫粉在O2中完全燃烧生成SO2,放出37kJ的热量;
2、在25℃101kPa时,1g甲醇(CH4O,液态)完全燃烧生成CO2和液态水时放出22.68kJ的热量。
课堂巩固
