(新教材)2019-2020新课程同步鲁科版高中化学必修第二册新学案课件:2、2第1课时 化学反应中能量变化的本质及转化形式21张 (共21张PPT)
文档属性
| 名称 | (新教材)2019-2020新课程同步鲁科版高中化学必修第二册新学案课件:2、2第1课时 化学反应中能量变化的本质及转化形式21张 (共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-24 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
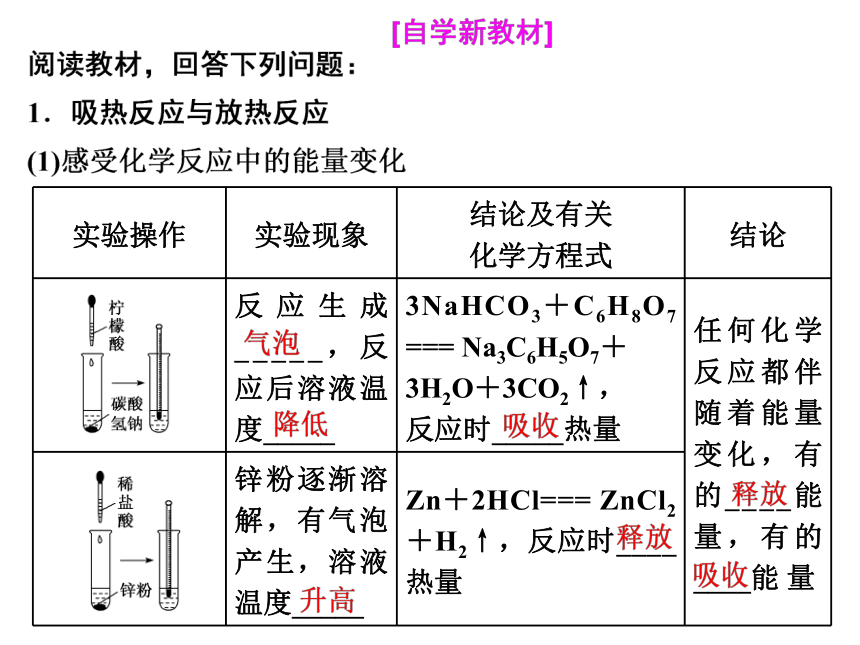
实验操作 实验现象 结论及有关
化学方程式 结论
反应生成_____,反应后溶液温度_____ 3NaHCO3+C6H8O7 === Na3C6H5O7+
3H2O+3CO2↑,
反应时_____热量 任何化学反应都伴随着能量变化,有的____能量,有的____能 量
锌粉逐渐溶解,有气泡产生,溶液温度_____ Zn+2HCl=== ZnCl2+H2↑,反应时____热量
类型
比较 放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
图示
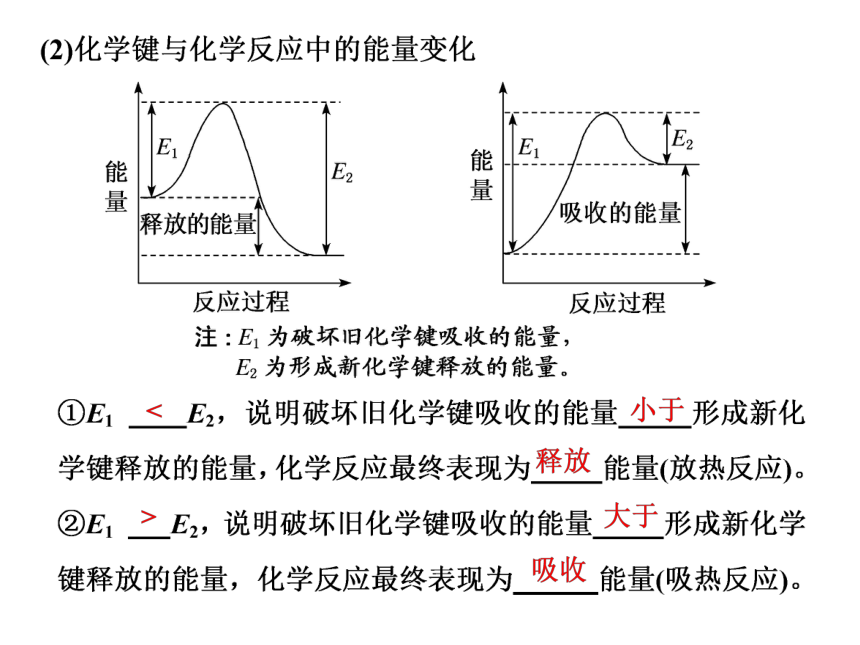
吸收能量(E1)
E1>E2为吸热反应
反应物旧化学键断裂
新化学键形成生成物
E1释放能量(E2)
柠檬酸碳氢
酸
1
稀盐酸
锌粉
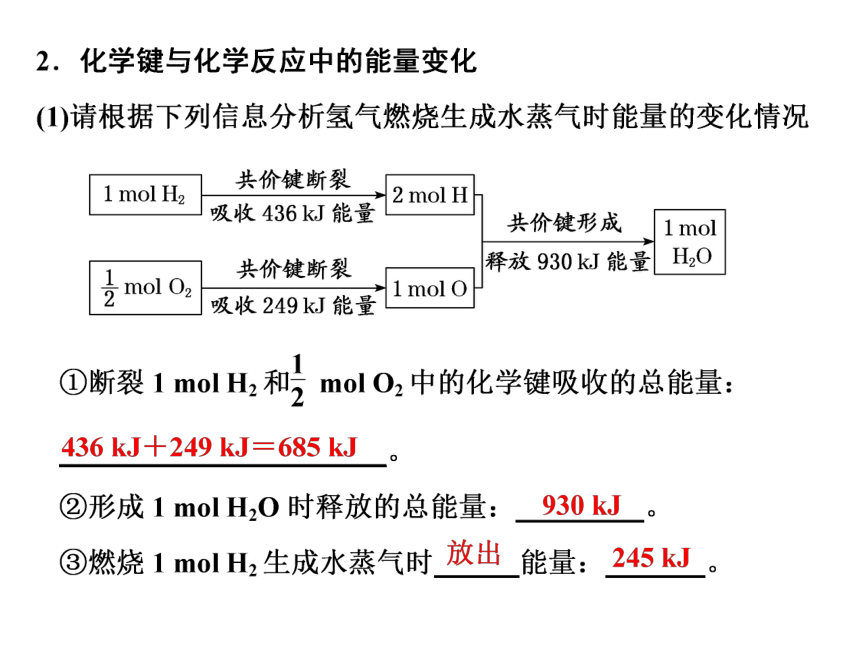
1 mol H2
共价键断裂
2 moth
吸收436k能量
共价键形成「1mol
共价键断裂
释放930k能量H2O
2mol O2
1 mol o
吸收249k能量
能
E1
量
释放的能量
吸收的能量
反应过程
反应过程
注:E1为破坏旧化学键吸收的能量
E2为形成新化学键释放的能量
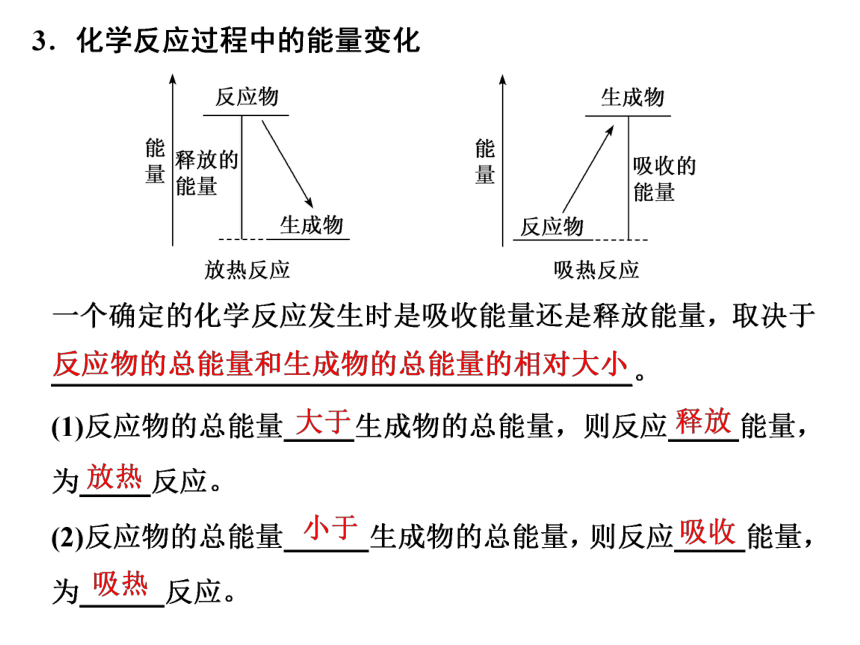
反应物
生成物
能
释放的
能量
吸收的
能量
能量
生成物
反应物
放热反应
吸热反应
反应物
能
释放的
能量
生成物
放热反应
生成物
能量一
吸收的
能量
反应物
吸热反应
判断数目、判断各物质中化学键的数目
计算数值计算断键吸收的能量E1和成键释放的能量E2
比较大小比较能量E1和E2的相对大小,并计算差值
若E1>E2为吸热反应,若E1判断类型
E1和E2的差值为吸收或放出的热量
能↑状态Ⅱ
状态I
状态I
状态Ⅱ
状态Ⅲ
状态Ⅲ、●表示C表示0刀
表示催化剂
反应过程
实验操作 实验现象 结论及有关
化学方程式 结论
反应生成_____,反应后溶液温度_____ 3NaHCO3+C6H8O7 === Na3C6H5O7+
3H2O+3CO2↑,
反应时_____热量 任何化学反应都伴随着能量变化,有的____能量,有的____能 量
锌粉逐渐溶解,有气泡产生,溶液温度_____ Zn+2HCl=== ZnCl2+H2↑,反应时____热量
类型
比较 放热反应 吸热反应
定义 释放热量的化学反应 吸收热量的化学反应
形成原因 反应物具有的总能量大于生成物具有的总能量 反应物具有的总能量小于生成物具有的总能量
图示
吸收能量(E1)
E1>E2为吸热反应
反应物旧化学键断裂
新化学键形成生成物
E1
柠檬酸碳氢
酸
1
稀盐酸
锌粉
1 mol H2
共价键断裂
2 moth
吸收436k能量
共价键形成「1mol
共价键断裂
释放930k能量H2O
2mol O2
1 mol o
吸收249k能量
能
E1
量
释放的能量
吸收的能量
反应过程
反应过程
注:E1为破坏旧化学键吸收的能量
E2为形成新化学键释放的能量
反应物
生成物
能
释放的
能量
吸收的
能量
能量
生成物
反应物
放热反应
吸热反应
反应物
能
释放的
能量
生成物
放热反应
生成物
能量一
吸收的
能量
反应物
吸热反应
判断数目、判断各物质中化学键的数目
计算数值计算断键吸收的能量E1和成键释放的能量E2
比较大小比较能量E1和E2的相对大小,并计算差值
若E1>E2为吸热反应,若E1
E1和E2的差值为吸收或放出的热量
能↑状态Ⅱ
状态I
状态I
状态Ⅱ
状态Ⅲ
状态Ⅲ、●表示C表示0刀
表示催化剂
反应过程
