课题1 生活中常见的盐第二课时 复分解反应及其发生的条件课件(28张PPT)
文档属性
| 名称 | 课题1 生活中常见的盐第二课时 复分解反应及其发生的条件课件(28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-24 00:00:00 | ||
图片预览







文档简介
(共28张PPT)
课题1 生活中常见的盐
第二课时
复分解反应及其发生的条件
碳酸钠、碳酸氢钠和碳酸钙
白色
白色
白色
固体
固体
固体
易溶于水
易溶于水
不溶于水
2、碳酸钠、碳酸氢钠和碳酸钙的俗称
1、物理性质
①、碳酸钠:纯碱、苏打、碱面 (其水溶液显碱性)
②、碳酸氢钠:小苏打、发面粉。 (其水溶液也显碱性)
③、碳酸钙:大理石、石灰石的主要成分。
1、纯碱不是碱,而是碱性的盐。
2、干冰不是冰,而是固态二氧化碳。
3、水银不是银,而是金属汞。
4、铅笔不含铅,而含有石墨。
5、双氧水不是水,而是过氧化氢的水溶液。
6、金刚石不是金,而是碳单质。
7、可燃冰不是冰,而是甲烷的水合物;
物 质 Na2CO3 NaHCO3 CaCO3
颜 色
状 态
溶 水 性
纯碱
苏打
小苏打
大理石
石灰石
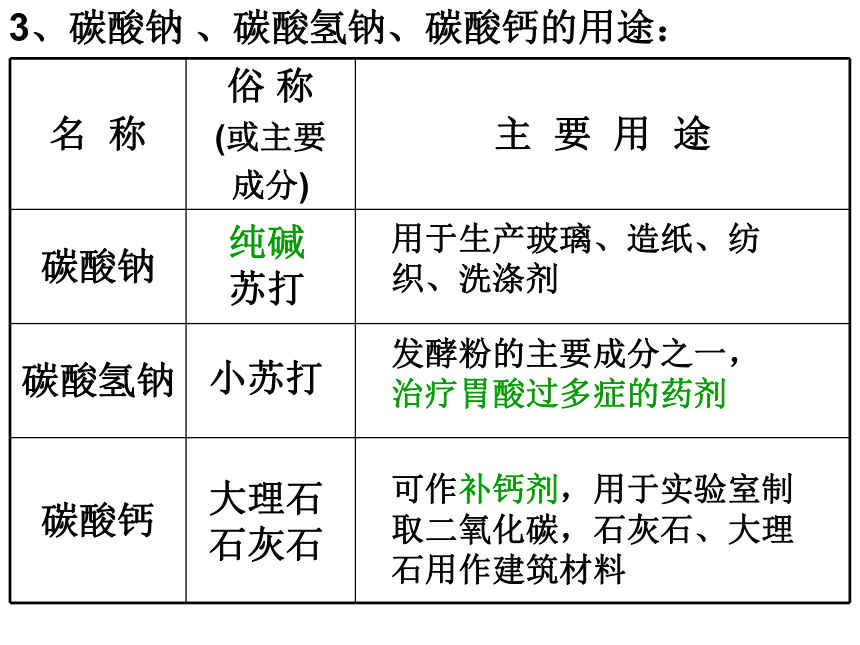
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
3、碳酸钠 、碳酸氢钠、碳酸钙的用途:
名 称 俗 称
(或主要
成分) 主 要 用 途
碳酸钠
碳酸氢钠
碳酸钙
①碳酸钙与盐酸反应的化学方程式:
CaCO3+2HCl=CaCl2+H2O+CO2↑
试着书写下列反应的化学方程式:
②碳酸钠与盐酸:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
③碳酸氢钠与盐酸:
NaHCO3+HCl=NaCl+H2O+CO2↑
观察与思考:
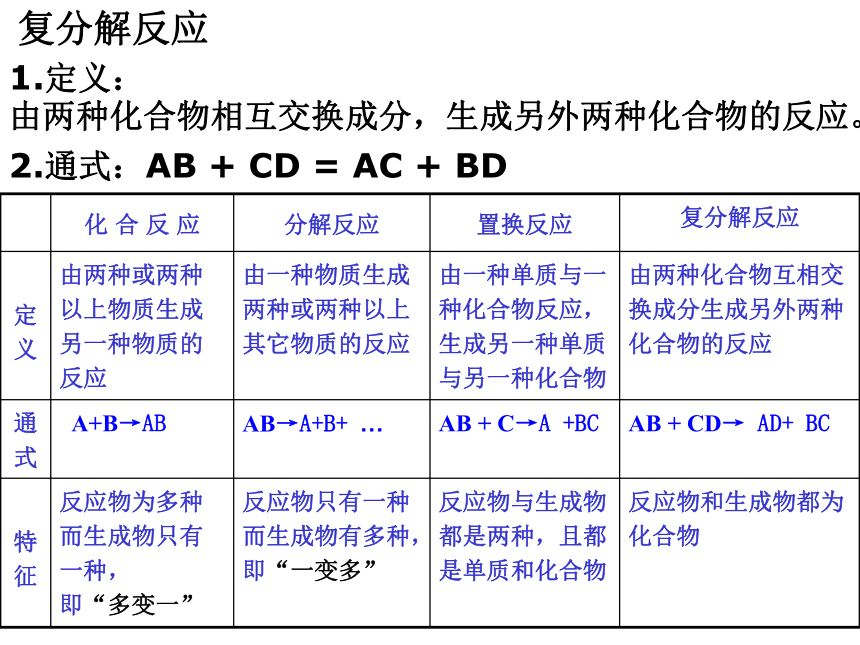
复分解反应
1.定义:
由两种化合物相互交换成分,生成另外两种化合物的反应。
2.通式:AB + CD = AC + BD
化 合 反 应 分解反应 置换反应 复分解反应
定义 由两种或两种以上物质生成另一种物质的反应 由一种物质生成两种或两种以上其它物质的反应 由一种单质与一种化合物反应,生成另一种单质与另一种化合物 由两种化合物互相交换成分生成另外两种化合物的反应
通式 A+B→AB AB→A+B+ … AB + C→A +BC AB + CD→ AD+ BC
特征 反应物为多种而生成物只有一种,
即“多变一” 反应物只有一种而生成物有多种,
即“一变多” 反应物与生成物都是两种,且都是单质和化合物 反应物和生成物都为化合物
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物---盐+水
复分解反应包括:
酸碱盐之间是否一定能发生复分解反应呢?
怎样才能发生复分解反应呢?
3.复分解反应的条件(实验11-3)
讨论:1.上述两个反应是否属于复分解反应?观察到的现
象有什么共同之处?
2.前面学过的中和反应是否也属于复分解反应?
中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生反应
时,可观察到的现象是什么?
是,有沉淀生成。
是,水.
有气体生成
有蓝色沉淀生成
有白色沉淀生成
CuSO4+2NaOH=
Cu(OH)2↓蓝+Na2SO4
Cu SO4溶液+Na OH溶液 Cu SO4溶液+BaCl2溶液
?现 象 ?
方程式 CuSO4+BaCl2=
BaSO4↓+CuCl2
复分解反应发生的条件之一
或有气体(↑)
或有水(H2O)
有沉淀(↓)
复分解反应才能发生
生成物中
4.复分解反应的实质:
1、酸碱盐在溶液中以自由移动的离子形式存在(一般可溶于水)。
2、自由移动的离子间相互能结合成沉淀或气体或者水。
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
生成沉淀:溶液中反应的离子变化
NaOH + HCl = NaCl +H2O
2KOH + H2SO4 = K2SO4 + 2H2O
Na+ 、OH-
H+、Cl-
Na+ 、Cl-
K+ 、OH-
H+、SO42-
K+ 、SO42-
反应生成水时,溶液中离子种类
结论:
发生复分解反应溶液中离子种类是否有变化?
发生变化。
Na2CO3 + 2HCl = 2NaCl + CO2↑+H2O
H+ 、Cl-
Na+ 、CO32-
Na+ 、Cl-
反应生成气体时,溶液中离子种类
结论:
发生复分解反应溶液中离子种类是否有变化?
发生变化。
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4 + KNO3 ——
Na+、NO3-
溶液中反应的离子变化
可见,以上反应生成沉淀或气体或水,
其离子种类均发生变化。
宏观:
微观:
复分解反应发生的条件
试判断下列溶液混合是否能发生复分解反应。
(1)AgNO3 与NaCl
(2)KNO3 与NaCl
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
课本P114 附录表1
运用复分解反应发生的条件判断反应能否发生
复分解反应发生的条件:
生成物中要有_____或有_____或有____生成。
沉淀
气体
水
课本P114
H2O
运用复分解反应发生的条件判断反应能否发生
能
生成水
能
生成气体
能
生成沉淀
不能
没有生成
沉淀或气体
或水
几对特殊离子
Ag+--Cl- 白色沉淀 Fe3+---OH- 褐色沉淀
Ba2+--SO42-白色沉淀 Cu2+-- OH-蓝色沉淀
OH---H+ 生成H2O Mg2+-- OH-白色沉淀
CO32---H+ 有CO2 放出
NH4+-- OH- 有NH3放出
Mg2+ Ba2+ Ca2+ --- CO32- 白色沉淀
这几组离子在溶液中不能共存(即不能同时存在)
本课小结
复分解反应发生条件
有水生成
有气体生成
有沉淀生成
或
或
微观:两种化合物互相交换成分,溶液中离子种类
发生变化时,复分解反应才可以发生。
【练习1】
判断下列离子结合是否能生成沉淀、气体或水
1、H+与OH-; H+与SO42-; H+与CO32- ;
2、 Na+与OH- ;Cu2+与OH-; K+与OH-
3、Cl-与Na+;Cl-与Ag+;Cl-与Cu2+
4、 SO42-与Na+; SO42-与NH4+; SO42-与Ba2+
5、 CO32-与Na+; CO32-与NH4+; CO32-与Ba2+
√
√
×
√
×
√
×
×
×
×
×
×
×
√
√
练习3:判断下列反应能否发生,发生的完成反应的方程式 不反应说明理由。
1.BaCl2+H2SO4=
2.Na2CO3+ 2 HCl=
3.K2SO4+HCl=
4.FeCl3+ 3 NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3=
7.Fe(OH)3+ 3 HNO3=
8.Ba(OH)2+ 2 HCl=
BaSO4↓+2HCl
2NaCl+H2O+CO2↑
Fe(OH)3↓+3NaCl
AgCl↓+KNO3
Fe(NO3)3+3H2O
BaCl2+2H2O
4、 判断下列复分解反应能否发生?如能反应,写出反应的化学方程式,如不反应,说明理由。
① H2SO4+Cu(OH)2
② NaCl+KNO3
③ CuSO4+BaCl2
④BaCO3+NaCl
= CuSO4+2H2O
(不反应)
= BaSO4↓+CuCl2
(不反应,BaCO3不溶)
课题1 生活中常见的盐
第二课时
复分解反应及其发生的条件
碳酸钠、碳酸氢钠和碳酸钙
白色
白色
白色
固体
固体
固体
易溶于水
易溶于水
不溶于水
2、碳酸钠、碳酸氢钠和碳酸钙的俗称
1、物理性质
①、碳酸钠:纯碱、苏打、碱面 (其水溶液显碱性)
②、碳酸氢钠:小苏打、发面粉。 (其水溶液也显碱性)
③、碳酸钙:大理石、石灰石的主要成分。
1、纯碱不是碱,而是碱性的盐。
2、干冰不是冰,而是固态二氧化碳。
3、水银不是银,而是金属汞。
4、铅笔不含铅,而含有石墨。
5、双氧水不是水,而是过氧化氢的水溶液。
6、金刚石不是金,而是碳单质。
7、可燃冰不是冰,而是甲烷的水合物;
物 质 Na2CO3 NaHCO3 CaCO3
颜 色
状 态
溶 水 性
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
3、碳酸钠 、碳酸氢钠、碳酸钙的用途:
名 称 俗 称
(或主要
成分) 主 要 用 途
碳酸钠
碳酸氢钠
碳酸钙
①碳酸钙与盐酸反应的化学方程式:
CaCO3+2HCl=CaCl2+H2O+CO2↑
试着书写下列反应的化学方程式:
②碳酸钠与盐酸:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
③碳酸氢钠与盐酸:
NaHCO3+HCl=NaCl+H2O+CO2↑
观察与思考:
复分解反应
1.定义:
由两种化合物相互交换成分,生成另外两种化合物的反应。
2.通式:AB + CD = AC + BD
化 合 反 应 分解反应 置换反应 复分解反应
定义 由两种或两种以上物质生成另一种物质的反应 由一种物质生成两种或两种以上其它物质的反应 由一种单质与一种化合物反应,生成另一种单质与另一种化合物 由两种化合物互相交换成分生成另外两种化合物的反应
通式 A+B→AB AB→A+B+ … AB + C→A +BC AB + CD→ AD+ BC
特征 反应物为多种而生成物只有一种,
即“多变一” 反应物只有一种而生成物有多种,
即“一变多” 反应物与生成物都是两种,且都是单质和化合物 反应物和生成物都为化合物
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸+金属氧化物---盐+水
复分解反应包括:
酸碱盐之间是否一定能发生复分解反应呢?
怎样才能发生复分解反应呢?
3.复分解反应的条件(实验11-3)
讨论:1.上述两个反应是否属于复分解反应?观察到的现
象有什么共同之处?
2.前面学过的中和反应是否也属于复分解反应?
中和反应的生成物中,相同的生成物是什么?
3.碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生反应
时,可观察到的现象是什么?
是,有沉淀生成。
是,水.
有气体生成
有蓝色沉淀生成
有白色沉淀生成
CuSO4+2NaOH=
Cu(OH)2↓蓝+Na2SO4
Cu SO4溶液+Na OH溶液 Cu SO4溶液+BaCl2溶液
?现 象 ?
方程式 CuSO4+BaCl2=
BaSO4↓+CuCl2
复分解反应发生的条件之一
或有气体(↑)
或有水(H2O)
有沉淀(↓)
复分解反应才能发生
生成物中
4.复分解反应的实质:
1、酸碱盐在溶液中以自由移动的离子形式存在(一般可溶于水)。
2、自由移动的离子间相互能结合成沉淀或气体或者水。
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
生成沉淀:溶液中反应的离子变化
NaOH + HCl = NaCl +H2O
2KOH + H2SO4 = K2SO4 + 2H2O
Na+ 、OH-
H+、Cl-
Na+ 、Cl-
K+ 、OH-
H+、SO42-
K+ 、SO42-
反应生成水时,溶液中离子种类
结论:
发生复分解反应溶液中离子种类是否有变化?
发生变化。
Na2CO3 + 2HCl = 2NaCl + CO2↑+H2O
H+ 、Cl-
Na+ 、CO32-
Na+ 、Cl-
反应生成气体时,溶液中离子种类
结论:
发生复分解反应溶液中离子种类是否有变化?
发生变化。
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4 + KNO3 ——
Na+、NO3-
溶液中反应的离子变化
可见,以上反应生成沉淀或气体或水,
其离子种类均发生变化。
宏观:
微观:
复分解反应发生的条件
试判断下列溶液混合是否能发生复分解反应。
(1)AgNO3 与NaCl
(2)KNO3 与NaCl
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
课本P114 附录表1
运用复分解反应发生的条件判断反应能否发生
复分解反应发生的条件:
生成物中要有_____或有_____或有____生成。
沉淀
气体
水
课本P114
H2O
运用复分解反应发生的条件判断反应能否发生
能
生成水
能
生成气体
能
生成沉淀
不能
没有生成
沉淀或气体
或水
几对特殊离子
Ag+--Cl- 白色沉淀 Fe3+---OH- 褐色沉淀
Ba2+--SO42-白色沉淀 Cu2+-- OH-蓝色沉淀
OH---H+ 生成H2O Mg2+-- OH-白色沉淀
CO32---H+ 有CO2 放出
NH4+-- OH- 有NH3放出
Mg2+ Ba2+ Ca2+ --- CO32- 白色沉淀
这几组离子在溶液中不能共存(即不能同时存在)
本课小结
复分解反应发生条件
有水生成
有气体生成
有沉淀生成
或
或
微观:两种化合物互相交换成分,溶液中离子种类
发生变化时,复分解反应才可以发生。
【练习1】
判断下列离子结合是否能生成沉淀、气体或水
1、H+与OH-; H+与SO42-; H+与CO32- ;
2、 Na+与OH- ;Cu2+与OH-; K+与OH-
3、Cl-与Na+;Cl-与Ag+;Cl-与Cu2+
4、 SO42-与Na+; SO42-与NH4+; SO42-与Ba2+
5、 CO32-与Na+; CO32-与NH4+; CO32-与Ba2+
√
√
×
√
×
√
×
×
×
×
×
×
×
√
√
练习3:判断下列反应能否发生,发生的完成反应的方程式 不反应说明理由。
1.BaCl2+H2SO4=
2.Na2CO3+ 2 HCl=
3.K2SO4+HCl=
4.FeCl3+ 3 NaOH=
5.KCl+AgNO3=
6.K2SO4+NaNO3=
7.Fe(OH)3+ 3 HNO3=
8.Ba(OH)2+ 2 HCl=
BaSO4↓+2HCl
2NaCl+H2O+CO2↑
Fe(OH)3↓+3NaCl
AgCl↓+KNO3
Fe(NO3)3+3H2O
BaCl2+2H2O
4、 判断下列复分解反应能否发生?如能反应,写出反应的化学方程式,如不反应,说明理由。
① H2SO4+Cu(OH)2
② NaCl+KNO3
③ CuSO4+BaCl2
④BaCO3+NaCl
= CuSO4+2H2O
(不反应)
= BaSO4↓+CuCl2
(不反应,BaCO3不溶)
同课章节目录
