高二化学人教版选修4第一在第二节燃烧热_能源课件(27ppt)
文档属性
| 名称 | 高二化学人教版选修4第一在第二节燃烧热_能源课件(27ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 512.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-25 11:21:47 | ||
图片预览








文档简介
(共28张PPT)
由于反应的情况不同,反应热可分为燃烧热、中和热等,其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
实验测得在25℃、101kPa时,1molCH4完全燃烧放出890.31kJ的热量。
CH4(g)+2O2 (g) =CO2 (g) +2H2O (l) ΔH= - 890.31kJ/mol
写出上面的热化学方程式
一.燃烧热
在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
单位为kJ/mol
研究的条件
燃烧物的量
反应程度
反应程度
C -- CO2 (g)
S – SO2 (g)
H– H2O(l)
燃烧热通常可利用仪器由实验测得。
①燃烧热为放出热量,△H<0。(在叙述时用正值描述)
H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol
②燃烧热规定了可燃物的物质的量为1mol.
H2的燃烧热为285.8kJ/mol,
表示在101kPa时,1molH2完全燃烧放出285.8kJ的热量
表示为:△H =-285.8kJ/mol
(1)H2(g)+?O2(g)=H2O(g) ?H=- 241.8kJ/mol
(2)H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) ?H=- 571.6kJ/mol
哪一个是H2的燃烧热? ————
讨 论
⑵
根据你对燃烧热的理解,参照课本表1-1数据,任意写出三到四种物质燃烧反应的热化学方程式。
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) -393.5 乙烷 C2H6(g) -1559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3267.5
二、燃烧热的计算及应用
【练习2】
已知:
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=一11036kJ/mol
C8H18的燃烧热是多少?
△H=-5518kJ/mol
【练习1】
H2的燃烧热为285.8 kJ / mol所表示的含义是?
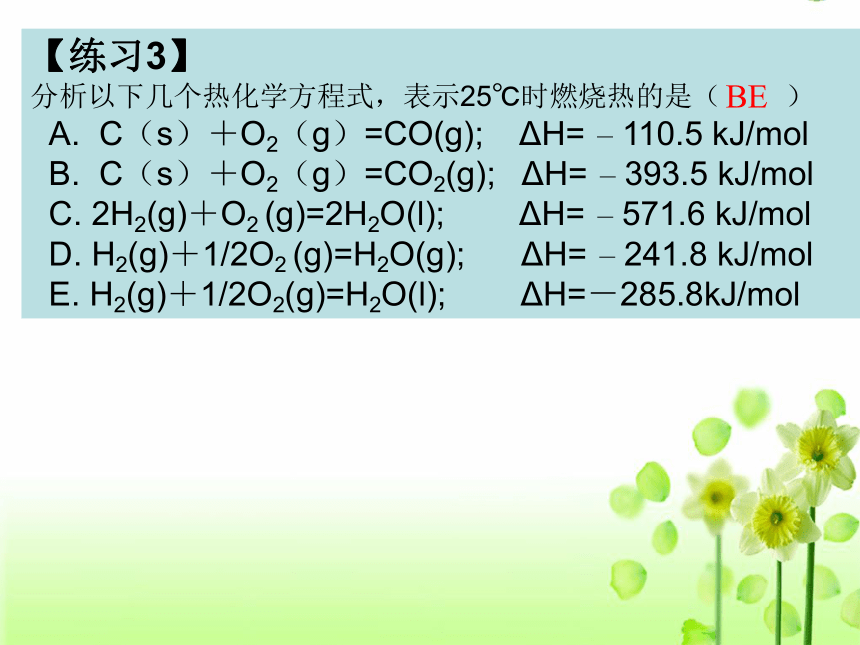
【练习3】
分析以下几个热化学方程式,表示25℃时燃烧热的是( )
A. C(s)+O2(g)=CO(g); ΔH= - 110.5 kJ/mol
B. C(s)+O2(g)=CO2(g); ΔH= - 393.5 kJ/mol
C. 2H2(g)+O2 (g)=2H2O(l); ΔH= - 571.6 kJ/mol
D. H2(g)+1/2O2 (g)=H2O(g); ΔH= - 241.8 kJ/mol
E. H2(g)+1/2O2(g)=H2O(l); ΔH=-285.8kJ/mol
BE
【练习4】已知下列两个热化学方程式:
2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ?mol-1
C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ?mol-1
(1)H2的燃烧热为____________,C3H8的燃烧热为____________
(2)2gH2和2mol C3H8组成的混合气体完全燃烧放出的热量为____________
285.8 kJ?mol-1
2 220 kJ?mol-1
4725.8 kJ
燃烧热和中和热的区别与联系
相
同
点 燃烧热 中和热
能量变化 放热反应
ΔH ΔH<0 , 单位 kJ/mol
不
同
点 反应物的量 1mol可燃物 不限
生成物的量 不限量 1mol H2O
反应热的
含义 1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同 稀酸稀碱中和生成1molH2O时放出的热量,不同的反应物的中和热大致相同
【练习5】? 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在 101 kPa时,1mol CH4 完全燃烧的热化学方程式为:
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
即CH4的燃烧热为 890 kJ/mol。
1000 L CH4 (标准状况)的物质的量为:
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1 = 44.6mol
1mol CH4 完全燃烧放出890kJ的热量,44.6 molCH4 完全燃烧放出的热量为:
44.6 mol×890 kJ/mol=3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为 3.97×104kJ。
【练习6】? 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所产生的热量。
解:根据题意,葡萄糖的燃烧热为2800kJ/mol。
100 g葡萄糖的物质的量为:
n(C6H12O6)= m(C6H12O6 )/M(C6H12O6 )
=100g/180g·mol-1=0.556mol
1mol C6H12O6完全燃烧放出2800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为:
0.556 mol×2800 kJ/mol=1560 kJ
答:100g葡萄糖在人体中完全氧化时产生1560 kJ的热量。
【练习7】 10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能量使500g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为 ,热化学方程式?为 ??。 ????????????????????
解:10g硫磺燃烧共放出热量为:
则1mol(32g)硫磺燃烧放热为
;
?
热化学方程式为:
;
?
【练习8】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且已知:
C(g)+1/2O2 = CO(g) ΔH=-110.5kJ/mol;
CO(g)+1/2O2(g)= CO2(g) ΔH=-283kJ/mol. 与这些碳完全燃烧相比,损失的热量是( )
A.172.5kJ B.1149kJ C.283kJ D.517.5kJ
C
【练习9】根据热化学方程式:
S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,分析下列说法中错误的是
A.S的燃烧热为297.23kJ/mol
B.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23kJ/mol
C.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol。Q的值小于297.23kJ/mol D.1molSO2的键能总和大于1molS和1molO2的键能和
C
【练习10】已知热化学方程式:
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,
则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b, 下列说法正确的是 A.该反应的ΔH2=+483.6kJ/mol B.|ΔH2|<|ΔH1| C.|ΔH2|>|ΔH1| D.热化学方程式中化学计量数表示分子个数
C
【练习11】下列说法正确的是 A.任何化学反应都伴随着能量的变化 B.0.5molH2SO4和0.5molBa(OH)2完全反应所放出 的热量称为中和热 C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热 D.在化学反应中需要加热的反应就是吸热反应
A
【练习12】.已知反应:
① 101 kPa时 2C(s)+ O2(g)===2CO(g) ΔH=-221 kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ?mol-1 下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ?mol-1
B、 ①的反应热为221 kJ?mol-1
C、 HCl和NaOH反应的中和热ΔH=-57.3 kJ?mol-1 ,则 H2SO4和 Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ?mol-1
D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
A
【练习13】.已知下列两个热化学方程式:
C(s)+O2(g) = CO2(g)? ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(g)? ΔH=-483.6 kJ·mol-1
现有0.2 mol碳粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53 kJ的热量。则碳与氢气的物质的量之比是(??? )
A.1∶1????????????? B.1∶2 ????????????C.2∶3????????????? D.3∶2
A
思考与交流
应根据什么标准来选择燃料?
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
例:丙烷
燃烧热值高
石油中储量丰富
开采容易
燃烧时污染小
储存、运输不方便
能
源
化石燃料——煤、石油、天然气
阳光
风力
流水
潮汐
柴草
……
能提供能量的资源
蕴藏量有限
不能再生
污染严重
开
源
节
流
开发新能源
节约现有能源
提高能源利用率
太阳能 氢能
风能 地热能
海洋能 生物质能
资源丰富
可以再生
污染少
燃料的充分燃烧
能源的分类
①一级能源与二级能源
一级能源:从自然界直接取得的能源,如:煤、石油、天然气等;
二级能源:一级能源经过加工转化后得到的能源,如:煤气、电力、沼气、 氢能等
②可再生能源与非可再生能源
可再生能源:可连续再生,永久利用的一级能源,如:水能、风能等;
非可再生能源:经过亿万年形成,短期内无法恢复的能源,如:石油、煤、 天然气等。
③常规能源与新能源
常规能源:已被广泛利用的能源,如:煤、天然气、水能等;
新能源:才刚开始被人类采用先进的方法加以利用的能源以及新发展的利用先进技术获得的能源,如:核聚变能、海洋能、太阳能等。
【练习】
1、下列属于一次能源的是( ),属于二次能源的是( )
A D E
B C
2、为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为 ( )
A
A.碳氢化合物 B.碳水化合物 C.氢气 D.醇类
A 风能 B 电能 C 氢能 D 阳光 E 天然气
3.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( ) ??????????????
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
C
由于反应的情况不同,反应热可分为燃烧热、中和热等,其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
实验测得在25℃、101kPa时,1molCH4完全燃烧放出890.31kJ的热量。
CH4(g)+2O2 (g) =CO2 (g) +2H2O (l) ΔH= - 890.31kJ/mol
写出上面的热化学方程式
一.燃烧热
在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
单位为kJ/mol
研究的条件
燃烧物的量
反应程度
反应程度
C -- CO2 (g)
S – SO2 (g)
H– H2O(l)
燃烧热通常可利用仪器由实验测得。
①燃烧热为放出热量,△H<0。(在叙述时用正值描述)
H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol
②燃烧热规定了可燃物的物质的量为1mol.
H2的燃烧热为285.8kJ/mol,
表示在101kPa时,1molH2完全燃烧放出285.8kJ的热量
表示为:△H =-285.8kJ/mol
(1)H2(g)+?O2(g)=H2O(g) ?H=- 241.8kJ/mol
(2)H2(g)+ ?O2(g)=H2O(l) ?H =- 285.8kJ/mol
(3)2H2(g)+O2(g)=2H2O(l) ?H=- 571.6kJ/mol
哪一个是H2的燃烧热? ————
讨 论
⑵
根据你对燃烧热的理解,参照课本表1-1数据,任意写出三到四种物质燃烧反应的热化学方程式。
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) -393.5 乙烷 C2H6(g) -1559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3267.5
二、燃烧热的计算及应用
【练习2】
已知:
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=一11036kJ/mol
C8H18的燃烧热是多少?
△H=-5518kJ/mol
【练习1】
H2的燃烧热为285.8 kJ / mol所表示的含义是?
【练习3】
分析以下几个热化学方程式,表示25℃时燃烧热的是( )
A. C(s)+O2(g)=CO(g); ΔH= - 110.5 kJ/mol
B. C(s)+O2(g)=CO2(g); ΔH= - 393.5 kJ/mol
C. 2H2(g)+O2 (g)=2H2O(l); ΔH= - 571.6 kJ/mol
D. H2(g)+1/2O2 (g)=H2O(g); ΔH= - 241.8 kJ/mol
E. H2(g)+1/2O2(g)=H2O(l); ΔH=-285.8kJ/mol
BE
【练习4】已知下列两个热化学方程式:
2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ?mol-1
C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ?mol-1
(1)H2的燃烧热为____________,C3H8的燃烧热为____________
(2)2gH2和2mol C3H8组成的混合气体完全燃烧放出的热量为____________
285.8 kJ?mol-1
2 220 kJ?mol-1
4725.8 kJ
燃烧热和中和热的区别与联系
相
同
点 燃烧热 中和热
能量变化 放热反应
ΔH ΔH<0 , 单位 kJ/mol
不
同
点 反应物的量 1mol可燃物 不限
生成物的量 不限量 1mol H2O
反应热的
含义 1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同 稀酸稀碱中和生成1molH2O时放出的热量,不同的反应物的中和热大致相同
【练习5】? 在 101 kPa时,1mol CH4 完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
【解】根据题意,在 101 kPa时,1mol CH4 完全燃烧的热化学方程式为:
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
即CH4的燃烧热为 890 kJ/mol。
1000 L CH4 (标准状况)的物质的量为:
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1 = 44.6mol
1mol CH4 完全燃烧放出890kJ的热量,44.6 molCH4 完全燃烧放出的热量为:
44.6 mol×890 kJ/mol=3.97×104kJ
答:CH4的燃烧热为 890 kJ/mol,1000 L CH4(标准状况)完全燃烧产生的热量为 3.97×104kJ。
【练习6】? 葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(l) ΔH=-2 800 kJ/mol
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算 100 g葡萄糖在人体中完全氧化时所产生的热量。
解:根据题意,葡萄糖的燃烧热为2800kJ/mol。
100 g葡萄糖的物质的量为:
n(C6H12O6)= m(C6H12O6 )/M(C6H12O6 )
=100g/180g·mol-1=0.556mol
1mol C6H12O6完全燃烧放出2800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为:
0.556 mol×2800 kJ/mol=1560 kJ
答:100g葡萄糖在人体中完全氧化时产生1560 kJ的热量。
【练习7】 10g硫磺在O2中完全燃烧生成气态SO2,放出的热量能量使500g H2O温度由18℃升至62.4℃,则硫磺的燃烧热为 ,热化学方程式?为 ??。 ????????????????????
解:10g硫磺燃烧共放出热量为:
则1mol(32g)硫磺燃烧放热为
;
?
热化学方程式为:
;
?
【练习8】在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且已知:
C(g)+1/2O2 = CO(g) ΔH=-110.5kJ/mol;
CO(g)+1/2O2(g)= CO2(g) ΔH=-283kJ/mol. 与这些碳完全燃烧相比,损失的热量是( )
A.172.5kJ B.1149kJ C.283kJ D.517.5kJ
C
【练习9】根据热化学方程式:
S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,分析下列说法中错误的是
A.S的燃烧热为297.23kJ/mol
B.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23kJ/mol
C.S(g)+O2(g)=SO2(g);△H=-Q kJ/mol。Q的值小于297.23kJ/mol D.1molSO2的键能总和大于1molS和1molO2的键能和
C
【练习10】已知热化学方程式:
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,
则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b, 下列说法正确的是 A.该反应的ΔH2=+483.6kJ/mol B.|ΔH2|<|ΔH1| C.|ΔH2|>|ΔH1| D.热化学方程式中化学计量数表示分子个数
C
【练习11】下列说法正确的是 A.任何化学反应都伴随着能量的变化 B.0.5molH2SO4和0.5molBa(OH)2完全反应所放出 的热量称为中和热 C.在101kPa时,1mol碳燃烧放出的热量就是碳的燃烧热 D.在化学反应中需要加热的反应就是吸热反应
A
【练习12】.已知反应:
① 101 kPa时 2C(s)+ O2(g)===2CO(g) ΔH=-221 kJ?mol-1
②稀溶液中,H+(aq)+OH-(aq)==H2O(l) ΔH=-57.3 kJ?mol-1 下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ?mol-1
B、 ①的反应热为221 kJ?mol-1
C、 HCl和NaOH反应的中和热ΔH=-57.3 kJ?mol-1 ,则 H2SO4和 Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ?mol-1
D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
A
【练习13】.已知下列两个热化学方程式:
C(s)+O2(g) = CO2(g)? ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(g)? ΔH=-483.6 kJ·mol-1
现有0.2 mol碳粉和氢气组成的悬浮气体,在氧气中完全燃烧,共放出63.53 kJ的热量。则碳与氢气的物质的量之比是(??? )
A.1∶1????????????? B.1∶2 ????????????C.2∶3????????????? D.3∶2
A
思考与交流
应根据什么标准来选择燃料?
物质的燃烧热
燃料的储量
燃料的开采、运输
燃料储存的条件、价格
燃料对生态环境的影响
例:丙烷
燃烧热值高
石油中储量丰富
开采容易
燃烧时污染小
储存、运输不方便
能
源
化石燃料——煤、石油、天然气
阳光
风力
流水
潮汐
柴草
……
能提供能量的资源
蕴藏量有限
不能再生
污染严重
开
源
节
流
开发新能源
节约现有能源
提高能源利用率
太阳能 氢能
风能 地热能
海洋能 生物质能
资源丰富
可以再生
污染少
燃料的充分燃烧
能源的分类
①一级能源与二级能源
一级能源:从自然界直接取得的能源,如:煤、石油、天然气等;
二级能源:一级能源经过加工转化后得到的能源,如:煤气、电力、沼气、 氢能等
②可再生能源与非可再生能源
可再生能源:可连续再生,永久利用的一级能源,如:水能、风能等;
非可再生能源:经过亿万年形成,短期内无法恢复的能源,如:石油、煤、 天然气等。
③常规能源与新能源
常规能源:已被广泛利用的能源,如:煤、天然气、水能等;
新能源:才刚开始被人类采用先进的方法加以利用的能源以及新发展的利用先进技术获得的能源,如:核聚变能、海洋能、太阳能等。
【练习】
1、下列属于一次能源的是( ),属于二次能源的是( )
A D E
B C
2、为了减少大气污染,许多城市正大力推广汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分均为 ( )
A
A.碳氢化合物 B.碳水化合物 C.氢气 D.醇类
A 风能 B 电能 C 氢能 D 阳光 E 天然气
3.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是( ) ??????????????
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
C
