高一化学必修Ⅱ人教新课标第二章第二节2.2化学能与电能(共22张ppt)
文档属性
| 名称 | 高一化学必修Ⅱ人教新课标第二章第二节2.2化学能与电能(共22张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-25 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
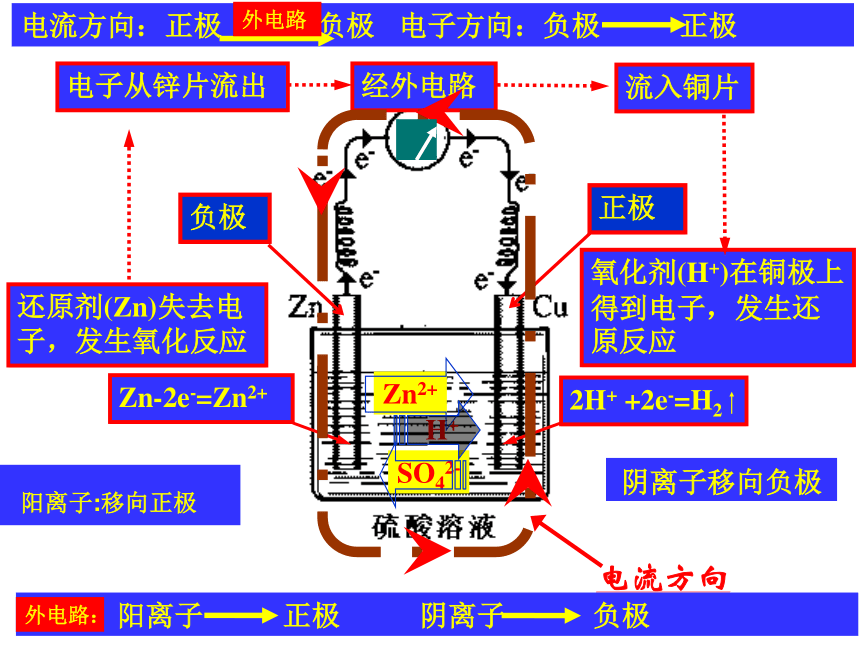
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
电子从锌片流出
流入铜片
经外电路
H+
Zn2+
SO42-
阳离子:移向正极
阴离子移向负极
外电路:
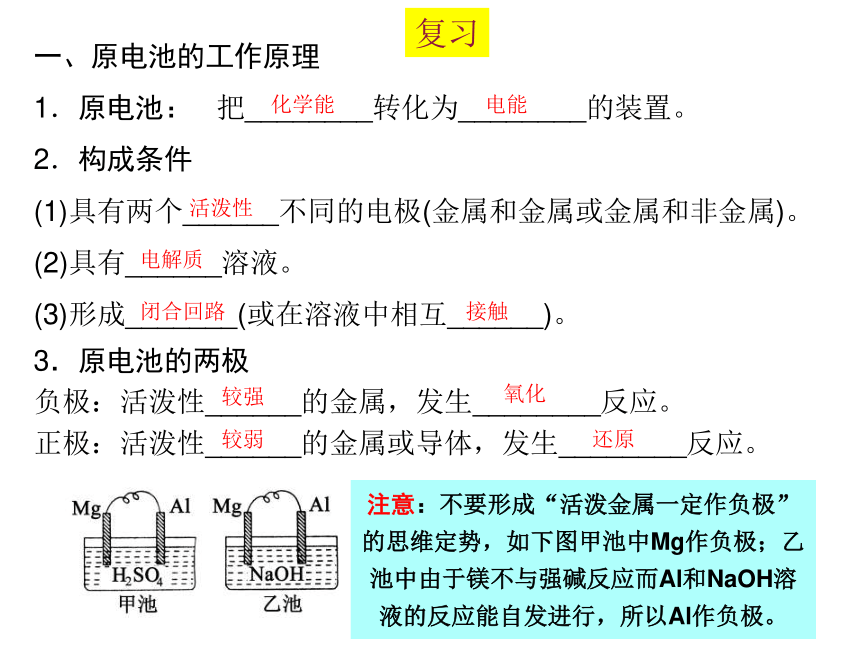
一、原电池的工作原理
1.原电池: 把________转化为________的装置。
2.构成条件
(1)具有两个______不同的电极(金属和金属或金属和非金属)。
(2)具有______溶液。
(3)形成_______(或在溶液中相互______)。
3.原电池的两极
负极:活泼性______的金属,发生________反应。
正极:活泼性______的金属或导体,发生________反应。
化学能
电能
活泼性
电解质
闭合回路
接触
较强
氧化
较弱
还原
注意:不要形成“活泼金属一定作负极”的思维定势,如下图甲池中Mg作负极;乙池中由于镁不与强碱反应而Al和NaOH溶液的反应能自发进行,所以Al作负极。
复习
4.电极反应式的书写和电荷移动方向(见图)
(1)电极反应式的书写
负极:________,电极反应式:____________。
正极:________,电极反应式:____________。
电池总反应:_____________。
(2)电荷移动方向
电子由_____释放,经____沿导线流入____,电解质溶液中的_____移向正极,在其表面得电子被______,形成一个闭合回路。
Zn
Zn-2e-==Zn2+
Cu
Cu2++2e-==Cu
Zn+Cu2+==Zn2++Cu
负极
外电路
正极
阳离子
还原
硫酸铜溶液
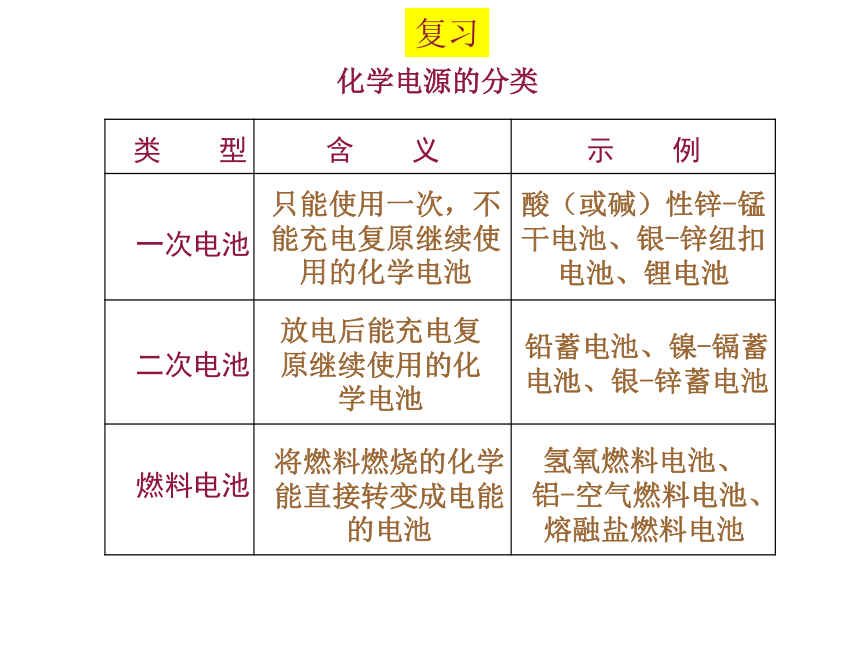
化学电源的分类
类 型
一次电池
二次电池
燃料电池
只能使用一次,不能充电复原继续使用的化学电池
酸(或碱)性锌-锰干电池、银-锌纽扣电池、锂电池
放电后能充电复原继续使用的化学电池
铅蓄电池、镍-镉蓄电池、银-锌蓄电池
将燃料燃烧的化学能直接转变成电能的电池
氢氧燃料电池、铝-空气燃料电池、熔融盐燃料电池
含 义
示 例
复习
二、发展中的化学电源
负极:Zn–2e-====Zn2+
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池,一般电极不反应。
已知:PbSO4难溶于水
Pb + PbO2 + 2H2SO4 ===== 2PbSO4 + 2H2O
负极:Pb + SO42- - 2e-==== PbSO4
正极:PbO2+4H++SO42-+2e-====PbSO4+2H2O
2、铅蓄电池
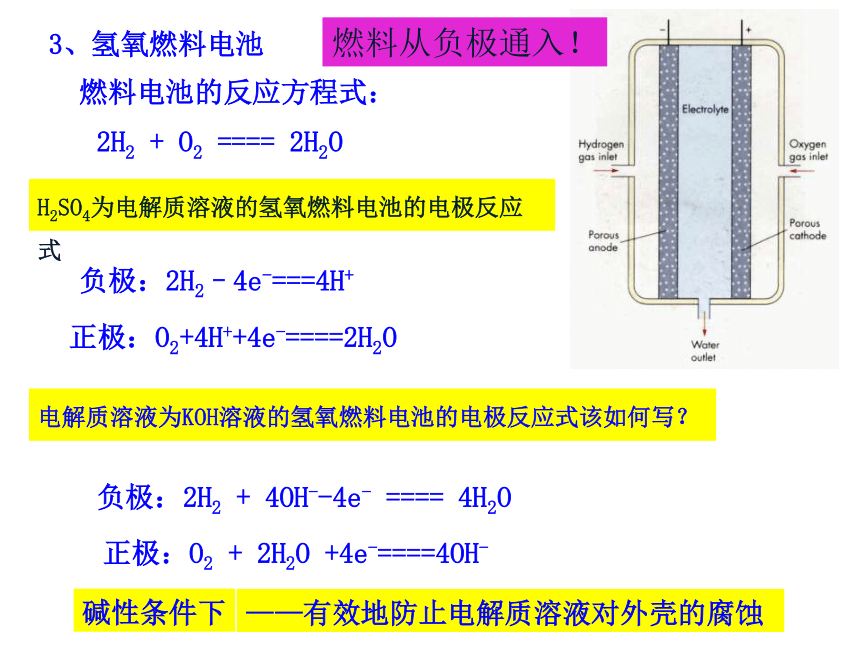
燃料电池的反应方程式:
2H2 + O2 ==== 2H2O
负极:2H2–4e-===4H+
3、氢氧燃料电池
电解质溶液为KOH溶液的氢氧燃料电池的电极反应式该如何写?
正极:O2+4H++4e-====2H2O
负极:2H2 + 4OH--4e- ==== 4H2O
H2SO4为电解质溶液的氢氧燃料电池的电极反应式
正极:O2 + 2H2O +4e-====4OH-
碱性条件下
——有效地防止电解质溶液对外壳的腐蚀
燃料从负极通入!
二、化学电源
1.化学电源是能够实际应用的原电池。作为化学电源的电池有________、________和________等。
一次电池
二次电池
(或可充电电池)
燃料电池
铅(Pb)
PbO2
3.碱性氢氧燃料电池的电极反应:
负极:__________________;
正极:__________________;
电池总反应为:__________________。
2H2+O2===2H2O
O2+2H2O+4e-===4OH-
2H2+4OH--4e-===4H2O
原电池测试
1.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D
2.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
C
A B C D
正极 Zn Cu Cu Zn
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 CuCl2
3.下列叙述中正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中Cu是负极
C.碱式氢氧燃料电池工作时,OH-向正极定向运动
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有
0.4 mol电子通过
4.对于锌—铜—稀H2SO4组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g
③铜片上析出1 gH2 ④铜片上析出1 mol H2
A.①③ B.①④ C.②③ D.②④
D
A
Zn+Cu2+==Zn2++Cu
负极:Zn–2e-====Zn2+
5.有a、b、c 3种金属,将a、b放在稀硫酸中,用导线连接,电流方向由a到b。把a放在c的硫酸盐溶液中,a表面有c析出。这3种金属的活动性顺序是( )。
A.b>a>c B.a>b>c C.c>b>a D.c>a>b
6.下列各个装置中能组成原电池的是 ( )
A
B
7.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A.DCAB B.DABC C.DBAC D.BADC
8.下列化学电池不易造成环境污染的是 ( )
A. 氢氧燃料电池 B.锌锰电池
C.镍镉电池 D. 铅蓄电池
B
A
9.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )。
①锌片溶解了32.5g ②锌片增重32.5g
③铜片上析出lg H2 ④铜片上析出1mol H2
A.①和③ B.①和④ C.②和③ D.②和④
10.由铝、铁、铜和稀硫酸,可以组成原电池的种数是( )。
A.2种 B.3种 C.4种 D.6种
A
B
11.下列关于原电池的叙述中,错误的是( )。
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一级是负极,发生氧化反应
D.原电池放电时,电流的方向是从负极到正极
12.实验室欲快速制取H2,应选用正确的措施是( )。
A.纯锌与稀硫酸反应
B.粗锌跟稀硫酸反应
C.粗锌跟硝酸反应
D.将浸泡过CuS04溶液的Zn跟稀硫酸反应
AD
BD
13.下列叙述正确的是( )。
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.干馏煤气是一级能源
14.关于用水制取二级能源氢气,以下研究方向不正确的是( )。
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
AC
AD
一次能源经加工、转换得到的能源称为二次能源
15.由铜、锌和稀盐酸组成的原电池中:
铜是 极,发生 反应,电极反应式 ;
锌是 极,发生 反应,电极反应式 。
16.(4分)指出下列主要能量变化是怎样转化的:
(1)学校燃烧煤煮饭 ,
(2)给手机的电池充电 ,
(3)用畜电池点亮灯泡 ,
(4)电解水得到O2和H2 。
答案:正;还原 ; 2H++2e-=H2↑;
负;氧化; Zn--2e-=Zn2+ ;
化学能变热能
电能变化学能
化学能变电能
电能变化学能
17.(7分)根据氧化还原反应Cu + 2Ag+ = Cu2+ + 2Ag设计一个原电池?并判断正负极、写出各电极电极反应方程和反应的类型(画出原电池装置图)
Cu
Ag
AgNO3
负极:Cu-2e-==Cu2+
正极: 2Ag++2e-=Ag
提升:以葡萄糖为燃料的微生物燃料电池的结构如图所示。
(1) 该燃料电池的能量转化主要形式是 ;在导线中电子流动方向是 (用a、b表示)。
(2) 该电池负极发生了 反应。(填“氧化”或“还原”)
(3) 该电池能否在高温下工作?理由是: ,
(4) 该电池放电过程中,H+ 离子从 (填“正”或“负”)极区向 (填“正”或“负”)极区迁移。
(5) 在该电池反应中,每消耗1mol O2 ,理论上能生成标准状况下的CO2 L 。
已知该燃料电池的总反应为:
C6H12O6 + 6O2 = 6CO2 + 6H2O。
化学能转变为电能
由b到a
氧化
不能
高温能使微生物蛋白质凝固变性
负
正
22.4L
燃料从负极通入!
走近高考:一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-===2H2O(l)
C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-===4OH-
C
燃料从负极通入!
走近高考:“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,负极反应为H2+CO32-===CO2↑+H2O+2e-,则下列推断中,正确的是( )
A.电池工作时,CO32-向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4OH-===O2↑+2H2O+2e-
D.通氧气的电极为阳极,发生氧化反应
A
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
【归纳小结】
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生 (H2),或质量增加或不变为正极
3、根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
电子从锌片流出
流入铜片
经外电路
H+
Zn2+
SO42-
阳离子:移向正极
阴离子移向负极
外电路:
一、原电池的工作原理
1.原电池: 把________转化为________的装置。
2.构成条件
(1)具有两个______不同的电极(金属和金属或金属和非金属)。
(2)具有______溶液。
(3)形成_______(或在溶液中相互______)。
3.原电池的两极
负极:活泼性______的金属,发生________反应。
正极:活泼性______的金属或导体,发生________反应。
化学能
电能
活泼性
电解质
闭合回路
接触
较强
氧化
较弱
还原
注意:不要形成“活泼金属一定作负极”的思维定势,如下图甲池中Mg作负极;乙池中由于镁不与强碱反应而Al和NaOH溶液的反应能自发进行,所以Al作负极。
复习
4.电极反应式的书写和电荷移动方向(见图)
(1)电极反应式的书写
负极:________,电极反应式:____________。
正极:________,电极反应式:____________。
电池总反应:_____________。
(2)电荷移动方向
电子由_____释放,经____沿导线流入____,电解质溶液中的_____移向正极,在其表面得电子被______,形成一个闭合回路。
Zn
Zn-2e-==Zn2+
Cu
Cu2++2e-==Cu
Zn+Cu2+==Zn2++Cu
负极
外电路
正极
阳离子
还原
硫酸铜溶液
化学电源的分类
类 型
一次电池
二次电池
燃料电池
只能使用一次,不能充电复原继续使用的化学电池
酸(或碱)性锌-锰干电池、银-锌纽扣电池、锂电池
放电后能充电复原继续使用的化学电池
铅蓄电池、镍-镉蓄电池、银-锌蓄电池
将燃料燃烧的化学能直接转变成电能的电池
氢氧燃料电池、铝-空气燃料电池、熔融盐燃料电池
含 义
示 例
复习
二、发展中的化学电源
负极:Zn–2e-====Zn2+
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池,一般电极不反应。
已知:PbSO4难溶于水
Pb + PbO2 + 2H2SO4 ===== 2PbSO4 + 2H2O
负极:Pb + SO42- - 2e-==== PbSO4
正极:PbO2+4H++SO42-+2e-====PbSO4+2H2O
2、铅蓄电池
燃料电池的反应方程式:
2H2 + O2 ==== 2H2O
负极:2H2–4e-===4H+
3、氢氧燃料电池
电解质溶液为KOH溶液的氢氧燃料电池的电极反应式该如何写?
正极:O2+4H++4e-====2H2O
负极:2H2 + 4OH--4e- ==== 4H2O
H2SO4为电解质溶液的氢氧燃料电池的电极反应式
正极:O2 + 2H2O +4e-====4OH-
碱性条件下
——有效地防止电解质溶液对外壳的腐蚀
燃料从负极通入!
二、化学电源
1.化学电源是能够实际应用的原电池。作为化学电源的电池有________、________和________等。
一次电池
二次电池
(或可充电电池)
燃料电池
铅(Pb)
PbO2
3.碱性氢氧燃料电池的电极反应:
负极:__________________;
正极:__________________;
电池总反应为:__________________。
2H2+O2===2H2O
O2+2H2O+4e-===4OH-
2H2+4OH--4e-===4H2O
原电池测试
1.在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D
2.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
C
A B C D
正极 Zn Cu Cu Zn
负极 Cu Zn Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4 CuCl2
3.下列叙述中正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中Cu是负极
C.碱式氢氧燃料电池工作时,OH-向正极定向运动
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有
0.4 mol电子通过
4.对于锌—铜—稀H2SO4组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g
③铜片上析出1 gH2 ④铜片上析出1 mol H2
A.①③ B.①④ C.②③ D.②④
D
A
Zn+Cu2+==Zn2++Cu
负极:Zn–2e-====Zn2+
5.有a、b、c 3种金属,将a、b放在稀硫酸中,用导线连接,电流方向由a到b。把a放在c的硫酸盐溶液中,a表面有c析出。这3种金属的活动性顺序是( )。
A.b>a>c B.a>b>c C.c>b>a D.c>a>b
6.下列各个装置中能组成原电池的是 ( )
A
B
7.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A.DCAB B.DABC C.DBAC D.BADC
8.下列化学电池不易造成环境污染的是 ( )
A. 氢氧燃料电池 B.锌锰电池
C.镍镉电池 D. 铅蓄电池
B
A
9.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )。
①锌片溶解了32.5g ②锌片增重32.5g
③铜片上析出lg H2 ④铜片上析出1mol H2
A.①和③ B.①和④ C.②和③ D.②和④
10.由铝、铁、铜和稀硫酸,可以组成原电池的种数是( )。
A.2种 B.3种 C.4种 D.6种
A
B
11.下列关于原电池的叙述中,错误的是( )。
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一级是负极,发生氧化反应
D.原电池放电时,电流的方向是从负极到正极
12.实验室欲快速制取H2,应选用正确的措施是( )。
A.纯锌与稀硫酸反应
B.粗锌跟稀硫酸反应
C.粗锌跟硝酸反应
D.将浸泡过CuS04溶液的Zn跟稀硫酸反应
AD
BD
13.下列叙述正确的是( )。
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.干馏煤气是一级能源
14.关于用水制取二级能源氢气,以下研究方向不正确的是( )。
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
AC
AD
一次能源经加工、转换得到的能源称为二次能源
15.由铜、锌和稀盐酸组成的原电池中:
铜是 极,发生 反应,电极反应式 ;
锌是 极,发生 反应,电极反应式 。
16.(4分)指出下列主要能量变化是怎样转化的:
(1)学校燃烧煤煮饭 ,
(2)给手机的电池充电 ,
(3)用畜电池点亮灯泡 ,
(4)电解水得到O2和H2 。
答案:正;还原 ; 2H++2e-=H2↑;
负;氧化; Zn--2e-=Zn2+ ;
化学能变热能
电能变化学能
化学能变电能
电能变化学能
17.(7分)根据氧化还原反应Cu + 2Ag+ = Cu2+ + 2Ag设计一个原电池?并判断正负极、写出各电极电极反应方程和反应的类型(画出原电池装置图)
Cu
Ag
AgNO3
负极:Cu-2e-==Cu2+
正极: 2Ag++2e-=Ag
提升:以葡萄糖为燃料的微生物燃料电池的结构如图所示。
(1) 该燃料电池的能量转化主要形式是 ;在导线中电子流动方向是 (用a、b表示)。
(2) 该电池负极发生了 反应。(填“氧化”或“还原”)
(3) 该电池能否在高温下工作?理由是: ,
(4) 该电池放电过程中,H+ 离子从 (填“正”或“负”)极区向 (填“正”或“负”)极区迁移。
(5) 在该电池反应中,每消耗1mol O2 ,理论上能生成标准状况下的CO2 L 。
已知该燃料电池的总反应为:
C6H12O6 + 6O2 = 6CO2 + 6H2O。
化学能转变为电能
由b到a
氧化
不能
高温能使微生物蛋白质凝固变性
负
正
22.4L
燃料从负极通入!
走近高考:一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-===2H2O(l)
C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-===4OH-
C
燃料从负极通入!
走近高考:“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2===2H2O,负极反应为H2+CO32-===CO2↑+H2O+2e-,则下列推断中,正确的是( )
A.电池工作时,CO32-向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4OH-===O2↑+2H2O+2e-
D.通氧气的电极为阳极,发生氧化反应
A
判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
【归纳小结】
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生 (H2),或质量增加或不变为正极
3、根据原电池两极发生的变化来判断:
原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
