人教版高中化学选修四第二章第三节2.3-化学平衡-课件(共22张PPT)
文档属性
| 名称 | 人教版高中化学选修四第二章第三节2.3-化学平衡-课件(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 441.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-25 00:00:00 | ||
图片预览





文档简介
(共22张PPT)
第二章 化学反应速率和化学平衡
第三节 化 学 平 衡
思考1:一定温度下,在100克水里加入大量的蔗糖,蔗糖开始溶解,等到固体蔗糖的质量再也不改变了,得到的溶液是什么溶液?
蔗糖的饱和溶液
思考2:饱和溶液中溶质的溶解过程完全停止了吗?
饱和溶液的溶解平衡
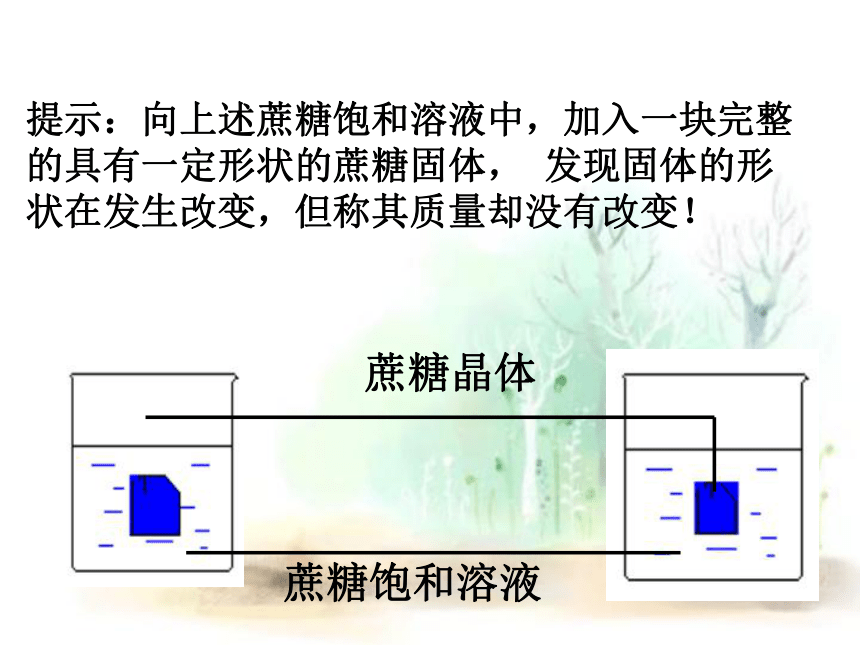
提示:向上述蔗糖饱和溶液中,加入一块完整的具有一定形状的蔗糖固体, 发现固体的形状在发生改变,但称其质量却没有改变!
蔗糖饱和溶液
蔗糖晶体
蔗糖饱和溶液
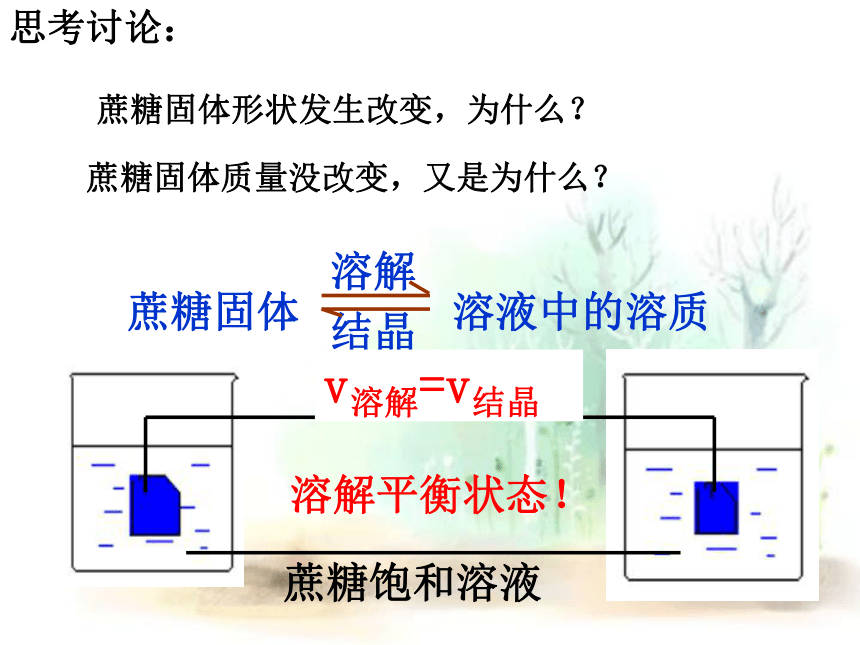
蔗糖固体
溶液中的溶质
溶解
结晶
蔗糖晶体
蔗糖固体形状发生改变,为什么?
蔗糖固体质量没改变,又是为什么?
思考讨论:
溶解平衡状态!
v溶解=v结晶
蔗糖的溶解过程
动画模拟--溶解平衡的建立
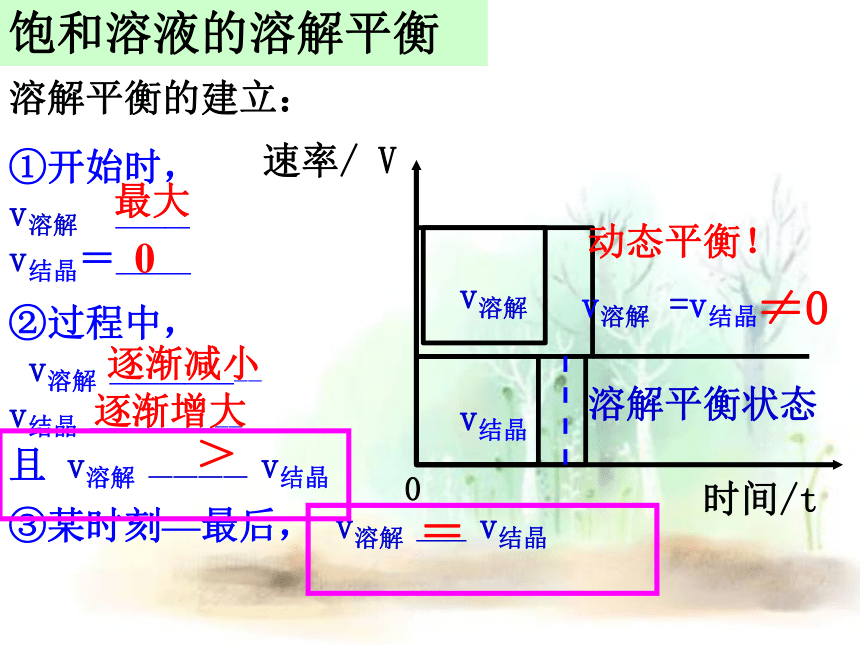
溶解平衡的建立:
①开始时,
v溶解 ———
v结晶=———
②过程中,
v溶解 ———————
v结晶 ———————
且 v溶解 ———— v结晶
最大
0
逐渐减小
逐渐增大
③某时刻—最后, v溶解 —— v结晶
=
>
时间/t
速率/ V
0
v溶解
v结晶
v溶解 =v结晶
溶解平衡状态
饱和溶液的溶解平衡
≠0
动态平衡!
实质:
v溶解 =v结晶
特征:
溶解平衡
饱和溶液的浓度不变
固体溶质的质量不变
一.可逆反应
在相同条件下,既能向正反应方向进行,同时,又能向逆反应方向进行的化学反应。
定义:
下列反应是否为可逆反应:
1.H2O通电分解成H2和O2,与H2、O2燃烧
生成H2O;
2.同一条件下,N2和H2生成NH3的反应与
NH3的分解反应
练习一:
基础巩固
3.思考题:一定条件下,在密闭容器中加入
1molN2与3molH2,体系中能否生成2molNH3?
不是
是
不能
思考3:既然可逆反应不能进行到底,它能进行到什么程度呢?(即为反应限度问题)
化学反应限度即为化学平衡问题!
二、化学平衡状态
在一定温度下,密闭容器中,发生反应
CO+H2O CO2+H2,数据记录如下:
1.化学平衡状态的建立
分析:反应物和生成物的浓度怎样变化的?
浓度变化导致速率如何变化?
①开始时:
反应物浓度————,V正———— ;
生成物浓度为————,V逆——;
最大
最大
0
0
逐渐减小
逐渐减小
逐渐增大
逐渐增大
②过程中:
反应物浓度———————,V正——————— ;
生成物浓度——————,V逆——————————;
且V正 V逆
③某一时刻----最终:
反应物和生成物的浓度
V正 V逆
不再改变
>
=
二、化学平衡状态---化学反应的限度
2、定义:
在一定条件下,可逆反应的V正=V逆(≠0),
反应体系中各组分的含量不再改变,即反应在
该条件下达到了限度,称之为化学平衡状态,
简称化学平衡。
含量包括: c、m、n,百分含量(质量分数、物质的量分数、体积分数)
实质:
特征:
化学平衡
反应体系中所有反应物和
生成物的质量(或浓度)不变
V正=V逆
练习二:
在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
A .C的生成速率与C分解的速率相等
B. A、B、C的浓度相等
C. A、B、C的分子数之比为1:3:2
D. A、B、C的浓度不再变化
AD
基础训练
一定条件下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2同时生成n molAB
B.单位时间内生成2n molAB同时生成n mol B2
C.单位时间内生成n mol A2同时生成n mol B2
D.单位时间内生成n molA2同时消耗nmol B2
BD
练习三:
小试牛刀
V逆
V正
V逆
V逆
V逆
V正
V逆
V正
异侧同向,同侧异向,比例计量
反应2NO2 (g) N2O4(g),证明该反应达到
平衡状态的是( )
A.NO2的消耗速率与N2O4的生成速率相等
B.NO2与N2O4的分子个数比为1:2
C.体系颜色不变
D.体系温度不变
CD
练习四:
巩固提升
一定条件下,反应N2+3H2 2NH3达到平衡的标志是 ( )
A、1个N≡N键断裂的同时,有3个H-H键形成
B、1个N≡N键断裂的同时,有3个H-H键断裂
C、1个N≡N键断裂的同时,有3个N-H键断裂
D、1个N≡N键断裂的同时,有6个N-H键断裂
AD
要注意成键、断键与反应方向之间的关系,化学键数与物质的量之间的联系。
练习五:
巩固提升
溶解平衡
可逆反应
化学平衡状态
课堂小结:
限度
{
建立
1.建立
2.运用等、定
判断平衡状态
希望同学们学会用过程的可逆性,事物的两面性,和化学平衡的观点看待身边的事物,你们对客观世界的认识和理解就会更深刻,处理各种关系时就会有更多的变通方法,事半功倍!
,则证明一定达平衡状态
变量
不再改变
达平衡状态
变量
不再改变
判断平衡状态的思想
恒量
不能用来衡量是否达平衡状态
恒量
无论平衡与否,都不变
{
在一定温度下容积一定的容器中,下列物理量不再发生变化时,表明A(g)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.气体的总物质的量
B.混合气体的压强
C.混合气体的平均分子量
D.混合气体的密度
ABC
练习六:
挑战极限
溶解平衡
可逆反应
化学平衡状态
课堂小结:
限度
{
建立
1.建立
2.运用等、定
判断平衡状态
希望同学们学会用过程的可逆性,事物的两面性,和化学平衡的观点看待身边的事物,你们对客观世界的认识和理解就会更深刻,处理各种关系时就会有更多的变通方法,事半功倍!
第二章 化学反应速率和化学平衡
第三节 化 学 平 衡
思考1:一定温度下,在100克水里加入大量的蔗糖,蔗糖开始溶解,等到固体蔗糖的质量再也不改变了,得到的溶液是什么溶液?
蔗糖的饱和溶液
思考2:饱和溶液中溶质的溶解过程完全停止了吗?
饱和溶液的溶解平衡
提示:向上述蔗糖饱和溶液中,加入一块完整的具有一定形状的蔗糖固体, 发现固体的形状在发生改变,但称其质量却没有改变!
蔗糖饱和溶液
蔗糖晶体
蔗糖饱和溶液
蔗糖固体
溶液中的溶质
溶解
结晶
蔗糖晶体
蔗糖固体形状发生改变,为什么?
蔗糖固体质量没改变,又是为什么?
思考讨论:
溶解平衡状态!
v溶解=v结晶
蔗糖的溶解过程
动画模拟--溶解平衡的建立
溶解平衡的建立:
①开始时,
v溶解 ———
v结晶=———
②过程中,
v溶解 ———————
v结晶 ———————
且 v溶解 ———— v结晶
最大
0
逐渐减小
逐渐增大
③某时刻—最后, v溶解 —— v结晶
=
>
时间/t
速率/ V
0
v溶解
v结晶
v溶解 =v结晶
溶解平衡状态
饱和溶液的溶解平衡
≠0
动态平衡!
实质:
v溶解 =v结晶
特征:
溶解平衡
饱和溶液的浓度不变
固体溶质的质量不变
一.可逆反应
在相同条件下,既能向正反应方向进行,同时,又能向逆反应方向进行的化学反应。
定义:
下列反应是否为可逆反应:
1.H2O通电分解成H2和O2,与H2、O2燃烧
生成H2O;
2.同一条件下,N2和H2生成NH3的反应与
NH3的分解反应
练习一:
基础巩固
3.思考题:一定条件下,在密闭容器中加入
1molN2与3molH2,体系中能否生成2molNH3?
不是
是
不能
思考3:既然可逆反应不能进行到底,它能进行到什么程度呢?(即为反应限度问题)
化学反应限度即为化学平衡问题!
二、化学平衡状态
在一定温度下,密闭容器中,发生反应
CO+H2O CO2+H2,数据记录如下:
1.化学平衡状态的建立
分析:反应物和生成物的浓度怎样变化的?
浓度变化导致速率如何变化?
①开始时:
反应物浓度————,V正———— ;
生成物浓度为————,V逆——;
最大
最大
0
0
逐渐减小
逐渐减小
逐渐增大
逐渐增大
②过程中:
反应物浓度———————,V正——————— ;
生成物浓度——————,V逆——————————;
且V正 V逆
③某一时刻----最终:
反应物和生成物的浓度
V正 V逆
不再改变
>
=
二、化学平衡状态---化学反应的限度
2、定义:
在一定条件下,可逆反应的V正=V逆(≠0),
反应体系中各组分的含量不再改变,即反应在
该条件下达到了限度,称之为化学平衡状态,
简称化学平衡。
含量包括: c、m、n,百分含量(质量分数、物质的量分数、体积分数)
实质:
特征:
化学平衡
反应体系中所有反应物和
生成物的质量(或浓度)不变
V正=V逆
练习二:
在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是 ( )
A .C的生成速率与C分解的速率相等
B. A、B、C的浓度相等
C. A、B、C的分子数之比为1:3:2
D. A、B、C的浓度不再变化
AD
基础训练
一定条件下,反应A2(g)+B2(g) 2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol A2同时生成n molAB
B.单位时间内生成2n molAB同时生成n mol B2
C.单位时间内生成n mol A2同时生成n mol B2
D.单位时间内生成n molA2同时消耗nmol B2
BD
练习三:
小试牛刀
V逆
V正
V逆
V逆
V逆
V正
V逆
V正
异侧同向,同侧异向,比例计量
反应2NO2 (g) N2O4(g),证明该反应达到
平衡状态的是( )
A.NO2的消耗速率与N2O4的生成速率相等
B.NO2与N2O4的分子个数比为1:2
C.体系颜色不变
D.体系温度不变
CD
练习四:
巩固提升
一定条件下,反应N2+3H2 2NH3达到平衡的标志是 ( )
A、1个N≡N键断裂的同时,有3个H-H键形成
B、1个N≡N键断裂的同时,有3个H-H键断裂
C、1个N≡N键断裂的同时,有3个N-H键断裂
D、1个N≡N键断裂的同时,有6个N-H键断裂
AD
要注意成键、断键与反应方向之间的关系,化学键数与物质的量之间的联系。
练习五:
巩固提升
溶解平衡
可逆反应
化学平衡状态
课堂小结:
限度
{
建立
1.建立
2.运用等、定
判断平衡状态
希望同学们学会用过程的可逆性,事物的两面性,和化学平衡的观点看待身边的事物,你们对客观世界的认识和理解就会更深刻,处理各种关系时就会有更多的变通方法,事半功倍!
,则证明一定达平衡状态
变量
不再改变
达平衡状态
变量
不再改变
判断平衡状态的思想
恒量
不能用来衡量是否达平衡状态
恒量
无论平衡与否,都不变
{
在一定温度下容积一定的容器中,下列物理量不再发生变化时,表明A(g)+3B(g) 2C(g)+D(g)已达平衡状态的是 ( )
A.气体的总物质的量
B.混合气体的压强
C.混合气体的平均分子量
D.混合气体的密度
ABC
练习六:
挑战极限
溶解平衡
可逆反应
化学平衡状态
课堂小结:
限度
{
建立
1.建立
2.运用等、定
判断平衡状态
希望同学们学会用过程的可逆性,事物的两面性,和化学平衡的观点看待身边的事物,你们对客观世界的认识和理解就会更深刻,处理各种关系时就会有更多的变通方法,事半功倍!
