人教版(新课程标准)必修2 第一章 第三节 化学键 第一课时(28张)
文档属性
| 名称 | 人教版(新课程标准)必修2 第一章 第三节 化学键 第一课时(28张) |
|
|
| 格式 | zip | ||
| 文件大小 | 557.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-25 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
化 学 键
——离 子 键
高一化学组:王 路
什么是“键”?《现代汉语词典》上对“键”的释义有如下四个条目:
①使轴与轮、皮带轮等连接并固定在一起的零件
②插门用的金属棍子。
③计算机、打字机或其他机器上,使用时按动的部分。
在化学结构式中表示原子价的短横线。
元素周期表中的元素至今已经发现了94种天然存在的元素加上人工合成的24种元素合计118种元素。这些元素也是由数量有限的原子构成的。可是目前发现与合成的化合物己经超过1亿3千多万种,显然,这些数量庞大的化合物都是由原子结合在一起而构成的。原子之间是靠“化学键”结合在起的。
与宏观物体中的各种“键”不同,物质中的“化学键”是我们看不见摸不着的微观存在。想要真切的感受到这种存在,我们只能从研究宏观现象入手。
现象:
黄色火焰,白烟。
结论:钠与氯气之间能发生反应。
化学方程式:2Na+Cl2=2NaCl
思考:钠原子和氯原子为什么要聚集在一起?它们是怎样聚集在一起的?
常见的不需用“群居”的原子:
He、Ne、Ar、Kr(单原子分子)
思考:它们的结构有何特点和共性?
结论:“独居”是因为价层电子全 部排满。
若要“群居”则表明要朝着价电子层排满的方向进行。
思考:分析钠和氯的原子结构,
如何才能做到价电子层全部排满?
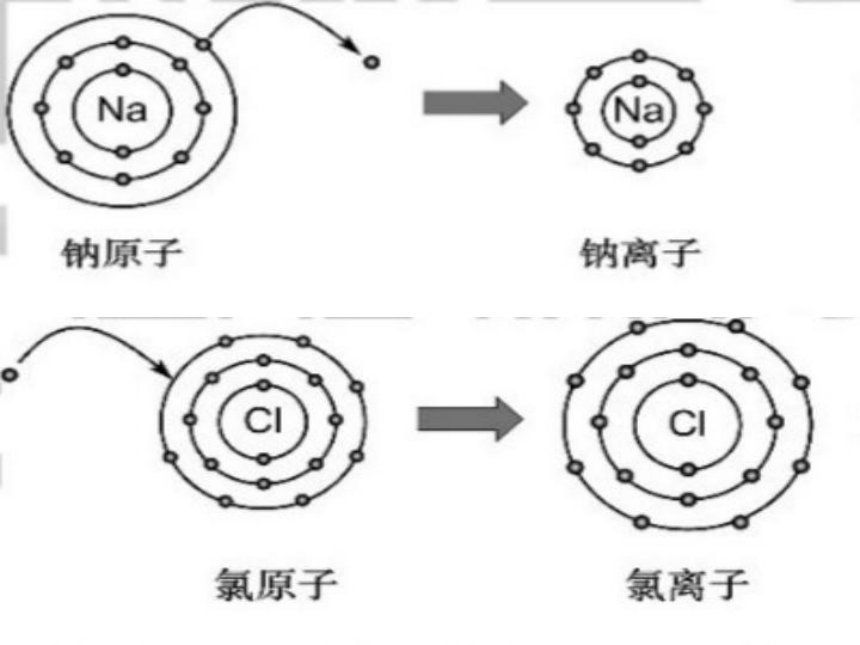
实际上,当Na+和Cl_彼此聚集靠近时,二者的原子核之间、核外电子之间均存在同性电荷产生的斥力:同时方的原子核另一方的核外电子之间也存在异性电荷产生的引力(静电作用)。在这两种矛盾的、强烈的相互作用之下,当达到某一距离时,引力和斥力达到平衡,带正电荷的Na+和帯负电荷的Cl_通过静电作用紧密的结合在一起。
1、定义: 氯化钠中Na+和Cl_离子间的
这种带相反电荷离子之间的相互作用称
为离子键( ionic bond),是一种电性作用。
思考:离子键的成键微粒是什么?
微粒之间以何种作用力结合?
2、成键微粒:阴阳离子。
3、相互作用:静电作用。
思考:要形成离子键,必须要有阴阳离
子,什么样的元素原子容易形成阴离子?
什么样的元素原子容易形成阳离子?
金属性强的元素原子易失去电子,非金
属性强的元素原子容易得到电子。
形成阳离子意味着____电子;(得或失)
形成阴离子意味着____电子;(得或失)
思考:依据元素周期表及元素周期律,
哪些元素原子金属性强?
哪些元素原子非金属性强?
分析:金属性比较强的:
第IA族元素(除H),第ⅡA族元素
非金属性比较强的:
第ⅥA族元素,第ⅦA族元素
4、常见含离子键物质:
①活泼金属(第IA、ⅡA族)离子与非金属第ⅥA、ⅦA族离子;
(如NaCl、K2S、NaF、Na2O,CaO)
②活泼金属离子与酸根离子;
(如NaOH、KNO3)
③铵根离子与酸根离子;
(如NH4Cl、NH4NO3)
思考:以前学习中我们已经知道氯化钠中含有Na+和Cl_,现在我们又知道Na+和Cl_通过离子键结合形成氯化钠,那么氯化钠是否就像下图这样一个Na+和一个Cl_构成一个“氯化钠分子”呢?
科学数据:一个“白烟”中的氯化钠颗粒直径至少为100nm,氯离子半径为181pm,钠离子半径为102pm。
(1nm=106pm)
一个氯化钠分子直径:
2×(181+102)pm
一个“白烟”中的氯化钠颗粒直径至少为100×106pm
结论:一个“白烟”中的氯化钠颗粒含有
很多个Na+和Cl_。
5、定义:我们把像氯化钠这种由离子键形成的化合物叫离子化合物。离子化合物的晶体称为离子晶体。
NaCl、K2S、NaF、NaOH、KNO3、 NH4Cl、NH4NO3、Na2O,CaO等均属于离子化合物。
它们都能形成离子晶体,离子晶体具有
硬度大,熔点高,固体时不导电,熔融
状态时导电的特点。
思考:如何选择合适的化学用语表达离子化合物?
仔细观察之下我们可以发现,原子之间彼此形成化学键时往往只涉及到最外层的电子(即价电子),为了简使起见,我们可以在元素符号周围用?(或×)来表示原子的最外层电子。这样的式子叫做电子式。
6、离子化合物形成过程的表示—电子式
电子式:在元素符号周围用小黑点(或x)表示原子的最外层电子的式子。
①原子的电子式:常把其最外层电子数 用小黑点“.”或小叉“×”来表示。
如:写出Na、Mg、Al、S、Cl、O、F几种原子的电子式
②阳离子的电子式:
③阴离子的电子式:
④离子化合物的电子式
Na+ Ba2+
例如:钠离子:
氟离子:
如:AB型:KBr:
MgO :
AB2型:CaBr2:
钡离子:
例如:氧离子:
A2B型:Na2S:
[ 练习] 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
用电子式可以直观地
看到原子结构特点与键之间的关系。
表示出原子之间是怎样结合的
Al3+
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并
AB型
AB2型
A2B型
2-
[课堂练习] KBr NaCl CaCl2 K2O
⑤用 电子式 表示 离子化合物 的 形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化钙的形成过程
Cl ·
··
··
··
[ Cl ]-
··
··
:
:
Na ·
+
→
Na+
Br ·
··
··
:
·Ca·
Ca2+
Br ·
··
··
:
+
→
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
[ 练习] ⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
注
意
· O ·
··
··
[ O ]2-
··
··
:
:
· Mg ·
+
→
Mg2+
· S ·
··
··
2K.
+
→
K+
[ S ]2-
··
··
:
:
K+
注意点
1. 离子须注明电荷数;
2. 相同的原子可以合并写,相同的离子要单个写;
3.阴离子要用方括号括起;
4.不能把 “→”写成 “ ==”
5.用箭头表明电子转移方向(也可不标)
2、M元素的一个原子失去两个电子转移到Y元素的两个原子中去,形成离子化合物Z,下列说法中不正确的是( )
A:M形成+2价阳离子 B:Z可以表示为MY2
C:Z一定溶于水 D:Z的熔点较高
1、写出下列微粒的电子式
Ba2+、 S2-、N、O、O2- 、Ca、 Ca2+、F- Na2S、MgO、CaBr2
3、氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出H2。下列叙述中,不正确的是( )
A:NaH的电子式为Na+[:H]-
B:NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C:微粒半径H-<Li+
D:NaH与H2O反应时,水作氧化剂。
课后总结:
1、离子键的定义;
2、组成微粒;
3、相互作用力;
4、离子化合物定义;
5、常见离子化合物物质类别;
6、电子式表示离子化合物。
谢 谢 !!
化 学 键
——离 子 键
高一化学组:王 路
什么是“键”?《现代汉语词典》上对“键”的释义有如下四个条目:
①使轴与轮、皮带轮等连接并固定在一起的零件
②插门用的金属棍子。
③计算机、打字机或其他机器上,使用时按动的部分。
在化学结构式中表示原子价的短横线。
元素周期表中的元素至今已经发现了94种天然存在的元素加上人工合成的24种元素合计118种元素。这些元素也是由数量有限的原子构成的。可是目前发现与合成的化合物己经超过1亿3千多万种,显然,这些数量庞大的化合物都是由原子结合在一起而构成的。原子之间是靠“化学键”结合在起的。
与宏观物体中的各种“键”不同,物质中的“化学键”是我们看不见摸不着的微观存在。想要真切的感受到这种存在,我们只能从研究宏观现象入手。
现象:
黄色火焰,白烟。
结论:钠与氯气之间能发生反应。
化学方程式:2Na+Cl2=2NaCl
思考:钠原子和氯原子为什么要聚集在一起?它们是怎样聚集在一起的?
常见的不需用“群居”的原子:
He、Ne、Ar、Kr(单原子分子)
思考:它们的结构有何特点和共性?
结论:“独居”是因为价层电子全 部排满。
若要“群居”则表明要朝着价电子层排满的方向进行。
思考:分析钠和氯的原子结构,
如何才能做到价电子层全部排满?
实际上,当Na+和Cl_彼此聚集靠近时,二者的原子核之间、核外电子之间均存在同性电荷产生的斥力:同时方的原子核另一方的核外电子之间也存在异性电荷产生的引力(静电作用)。在这两种矛盾的、强烈的相互作用之下,当达到某一距离时,引力和斥力达到平衡,带正电荷的Na+和帯负电荷的Cl_通过静电作用紧密的结合在一起。
1、定义: 氯化钠中Na+和Cl_离子间的
这种带相反电荷离子之间的相互作用称
为离子键( ionic bond),是一种电性作用。
思考:离子键的成键微粒是什么?
微粒之间以何种作用力结合?
2、成键微粒:阴阳离子。
3、相互作用:静电作用。
思考:要形成离子键,必须要有阴阳离
子,什么样的元素原子容易形成阴离子?
什么样的元素原子容易形成阳离子?
金属性强的元素原子易失去电子,非金
属性强的元素原子容易得到电子。
形成阳离子意味着____电子;(得或失)
形成阴离子意味着____电子;(得或失)
思考:依据元素周期表及元素周期律,
哪些元素原子金属性强?
哪些元素原子非金属性强?
分析:金属性比较强的:
第IA族元素(除H),第ⅡA族元素
非金属性比较强的:
第ⅥA族元素,第ⅦA族元素
4、常见含离子键物质:
①活泼金属(第IA、ⅡA族)离子与非金属第ⅥA、ⅦA族离子;
(如NaCl、K2S、NaF、Na2O,CaO)
②活泼金属离子与酸根离子;
(如NaOH、KNO3)
③铵根离子与酸根离子;
(如NH4Cl、NH4NO3)
思考:以前学习中我们已经知道氯化钠中含有Na+和Cl_,现在我们又知道Na+和Cl_通过离子键结合形成氯化钠,那么氯化钠是否就像下图这样一个Na+和一个Cl_构成一个“氯化钠分子”呢?
科学数据:一个“白烟”中的氯化钠颗粒直径至少为100nm,氯离子半径为181pm,钠离子半径为102pm。
(1nm=106pm)
一个氯化钠分子直径:
2×(181+102)pm
一个“白烟”中的氯化钠颗粒直径至少为100×106pm
结论:一个“白烟”中的氯化钠颗粒含有
很多个Na+和Cl_。
5、定义:我们把像氯化钠这种由离子键形成的化合物叫离子化合物。离子化合物的晶体称为离子晶体。
NaCl、K2S、NaF、NaOH、KNO3、 NH4Cl、NH4NO3、Na2O,CaO等均属于离子化合物。
它们都能形成离子晶体,离子晶体具有
硬度大,熔点高,固体时不导电,熔融
状态时导电的特点。
思考:如何选择合适的化学用语表达离子化合物?
仔细观察之下我们可以发现,原子之间彼此形成化学键时往往只涉及到最外层的电子(即价电子),为了简使起见,我们可以在元素符号周围用?(或×)来表示原子的最外层电子。这样的式子叫做电子式。
6、离子化合物形成过程的表示—电子式
电子式:在元素符号周围用小黑点(或x)表示原子的最外层电子的式子。
①原子的电子式:常把其最外层电子数 用小黑点“.”或小叉“×”来表示。
如:写出Na、Mg、Al、S、Cl、O、F几种原子的电子式
②阳离子的电子式:
③阴离子的电子式:
④离子化合物的电子式
Na+ Ba2+
例如:钠离子:
氟离子:
如:AB型:KBr:
MgO :
AB2型:CaBr2:
钡离子:
例如:氧离子:
A2B型:Na2S:
[ 练习] 写出下列微粒的电子式:
硫原子、 溴原子、 硫离子、溴离子、铝离子
·S·
··
··
Br ·
··
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
用电子式可以直观地
看到原子结构特点与键之间的关系。
表示出原子之间是怎样结合的
Al3+
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并
AB型
AB2型
A2B型
2-
[课堂练习] KBr NaCl CaCl2 K2O
⑤用 电子式 表示 离子化合物 的 形成过程
用电子式表示氯化钠的形成过程
用电子式表示溴化钙的形成过程
Cl ·
··
··
··
[ Cl ]-
··
··
:
:
Na ·
+
→
Na+
Br ·
··
··
:
·Ca·
Ca2+
Br ·
··
··
:
+
→
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
[ 练习] ⑴ 用电子式表示氧化镁的形成过程
⑵ 用电子式表示硫化钾的形成过程
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
注
意
· O ·
··
··
[ O ]2-
··
··
:
:
· Mg ·
+
→
Mg2+
· S ·
··
··
2K.
+
→
K+
[ S ]2-
··
··
:
:
K+
注意点
1. 离子须注明电荷数;
2. 相同的原子可以合并写,相同的离子要单个写;
3.阴离子要用方括号括起;
4.不能把 “→”写成 “ ==”
5.用箭头表明电子转移方向(也可不标)
2、M元素的一个原子失去两个电子转移到Y元素的两个原子中去,形成离子化合物Z,下列说法中不正确的是( )
A:M形成+2价阳离子 B:Z可以表示为MY2
C:Z一定溶于水 D:Z的熔点较高
1、写出下列微粒的电子式
Ba2+、 S2-、N、O、O2- 、Ca、 Ca2+、F- Na2S、MgO、CaBr2
3、氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应放出H2。下列叙述中,不正确的是( )
A:NaH的电子式为Na+[:H]-
B:NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C:微粒半径H-<Li+
D:NaH与H2O反应时,水作氧化剂。
课后总结:
1、离子键的定义;
2、组成微粒;
3、相互作用力;
4、离子化合物定义;
5、常见离子化合物物质类别;
6、电子式表示离子化合物。
谢 谢 !!
