高中化学人教版选修5导学案 第3章 第3节 乙酸及羧酸导学案
文档属性
| 名称 | 高中化学人教版选修5导学案 第3章 第3节 乙酸及羧酸导学案 |

|
|
| 格式 | zip | ||
| 文件大小 | 1003.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-26 00:00:00 | ||
图片预览



文档简介
第三章 第三节 乙酸及羧酸
【学习目标】
1、掌握乙酸的分子结构、物理性质、化学性质,掌握乙酸乙酯的实验操作过程
2、了解羧酸的分类和命名,掌握常见的羧酸的性质
【主干知识梳理】
一、乙酸的分子结构和物理性质
1、乙酸的分子结构
分子式 电子式 结构式 结构简式 比例模型 官能团
羧基
2、乙酸的物理性质:乙酸俗名 ,是一种无色液体,具有 气味,易挥发,溶点 16.6℃,沸点 117.9℃, 易溶于 。当温度低于 16.6 时,乙酸就会凝结成像冰一样的晶体,所以无水乙酸又叫冰醋酸
【热身训练 1】
1、下列关于乙酸的说法不正确的是( ) A.乙酸是一种重要的有机酸,是具有强烈刺激性气味的液体 B.乙酸分子中含有四个氢原子,所以乙酸是四元酸 C.无水乙酸又称冰醋酸,它是纯净物 D.乙酸易溶于水和乙醇
二、乙酸的化学性质
1、乙酸的弱酸性(具有酸的通性):乙酸是一种 ,其酸性比碳酸的 ,具有酸的通性。在水中可以电离出
H+,电离方程式为:CH3COOH CH3COO—+H+
乙酸的酸性 相关的化学方程式
①乙酸能使紫色石蕊溶液变红色
②与活泼金属(Na)反应
③与某些金属氧化物(CaO)反应
④与碱(NaOH、Cu(OH)2)发生中和反应
⑤与某些盐(Na2CO3、NaHCO3)反应
【热身训练 2】
1、下列事实能说明碳酸的酸性比乙酸弱的是( ) A.乙酸能发生酯化反应,而碳酸不能 B.碳酸和乙酸都能与碱反应 C.乙酸易挥发,而碳酸不稳定易分解 D.乙酸和 Na2CO3 反应可放出 CO2
2、下列关于乙酸性质的叙述中,错误的是( ) A.乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生 CO2 气体 B.乙酸具有氧化性,能跟钠反应放出 H2 C.乙酸分子中含有碳氧双键,所以它能与氢气发生加成反应 D.乙酸在温度低于 16.6℃时,就凝结成冰状晶体
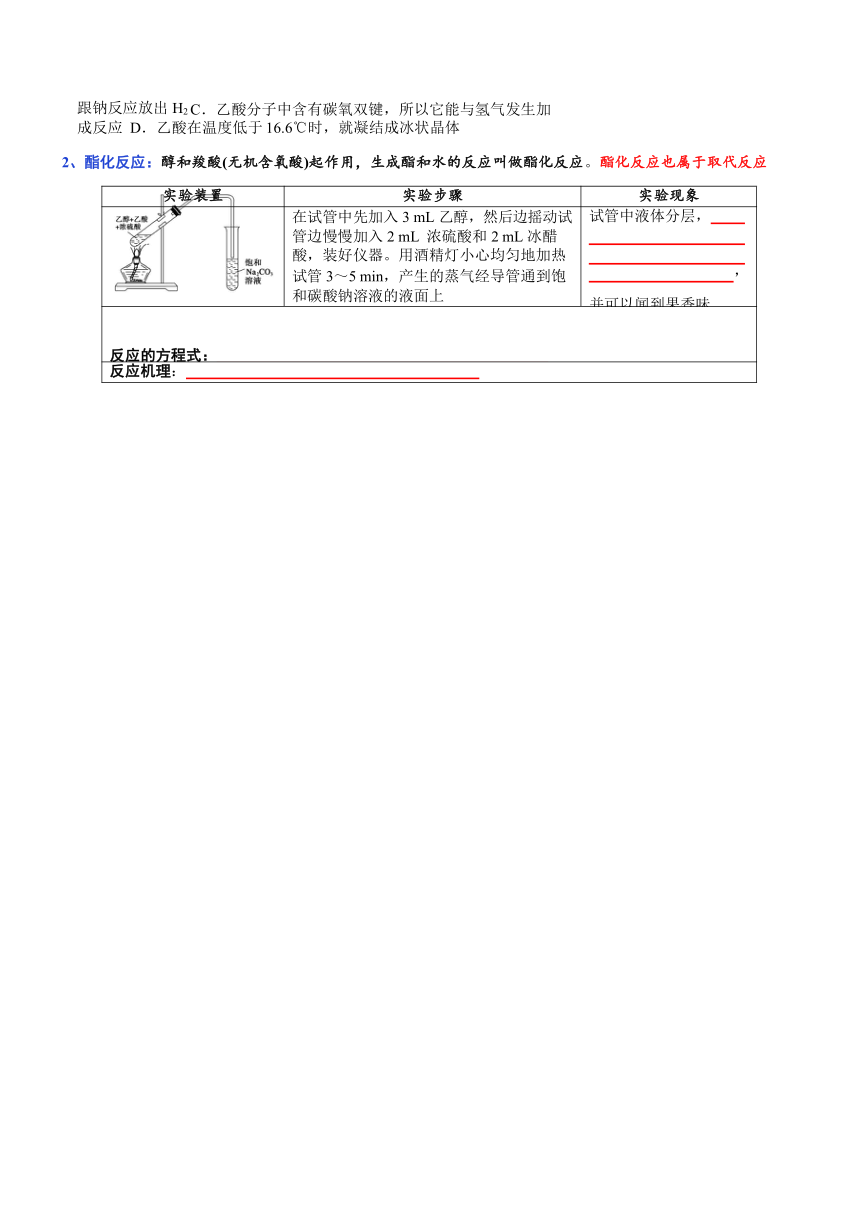
2、酯化反应:醇和羧酸(无机含氧酸)起作用,生成酯和水的反应叫做酯化反应。酯化反应也属于取代反应
实验装置 实验步骤 实验现象
在试管中先加入 3 mL 乙醇,然后边摇动试 试管中液体分层,
管边慢慢加入 2 mL 浓硫酸和 2 mL 冰醋
酸,装好仪器。用酒精灯小心均匀地加热
试管 3~5 min,产生的蒸气经导管通到饱 和碳酸钠溶液的液面上 ,并可以闻到果香味
反应的方程式:
反应机理:
【微点拨】
①浓硫酸的作用是: ;除去生成物中的水,使反应向生成物的方向移动,增大乙酸乙酯的产率
②饱和 Na2CO3 溶液的作用:
③实验中药品的添加顺序:先加 ,再加 ,最后加
④加入碎瓷片的作用:防止暴沸
⑤实验中,乙醇过量的原因:提高乙酸的转化率
⑥导气管伸到饱和碳酸钠溶液液面上的目的:防止倒吸
⑦长导管作用:导气兼冷凝作用
⑧不能用 NaOH 溶液代替饱和 Na2CO3 溶液:乙酸乙酯在强碱 NaOH 存在下水解较彻底,几乎得不到乙酸乙酯
⑨在该反应中,为什么要强调加冰醋酸和无水乙醇,而不用他们的水溶液?
因为冰醋酸与无水乙醇基本不含水,可以促使反应向生成酯的方向进行
⑩为什么刚开始加热时要缓慢?防止反应物还未来得及反应即被加热蒸馏出来,造成反应物的损失
?酯化反应的机理探究——同位素示踪原子法 在上述这个酯化反应中,生成物水中的氧原子是由乙酸分子中的羧基上的羟基提供,还是由乙醇分子的羟基 提供?如何能证明你的判断是正确的?能否提供理论或实验依据?
脱水有两种情况,(1)酸脱羟基醇脱氢;(2)醇脱羟基酸脱氢。在化学上为了辨明反应历程,常用同位素示踪法。 即把某些分不清的原子做上记号,类似于侦察上的跟踪追击。事实上,科学家把乙醇分子中的氧原子换成放 射性同位素 18O,结果检测到只有生成的乙酸乙酯中才有 18O,说明脱水情况为第一种,即乙酸与乙醇在浓硫 酸作用下发生酯化反应的机理是“酸脱羟基醇脱氢”。放射性同位素示踪法可用于研究化学反应机理,是匈牙 利科学家海维西(G.Hevesy)首先使用的,他因此获得 1943 年诺贝尔化学奖 酯化反应机理: (羧酸脱羟基醇脱氢)
【热身训练 3】
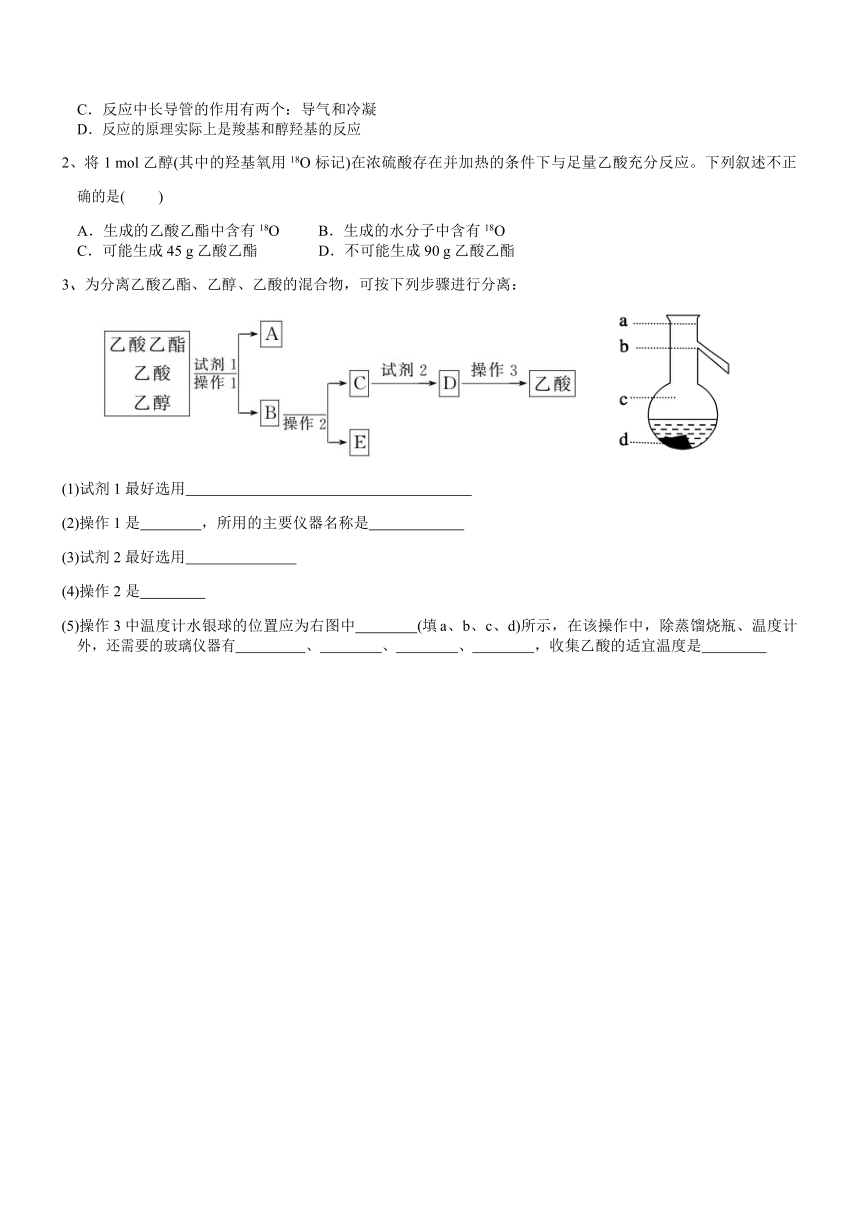
1、关于实验室制取少量乙酸乙酯的实验,下列说法错误的是( )
A.三种反应物混合时的操作方法可以是在试管中加入一定量的乙酸和乙醇后,再慢慢滴加一定量的浓硫酸, 并不断摇动
B.为加快化学反应速率,应当用大火快速加热
C.反应中长导管的作用有两个:导气和冷凝 D.反应的原理实际上是羧基和醇羟基的反应
2、将 1 mol 乙醇(其中的羟基氧用 18O 标记)在浓硫酸存在并加热的条件下与足量乙酸充分反应。下列叙述不正
确的是( )
A.生成的乙酸乙酯中含有 18O B.生成的水分子中含有 18O C.可能生成 45 g 乙酸乙酯 D.不可能生成 90 g 乙酸乙酯
3、为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
(1)试剂 1 最好选用
(2)操作 1 是 ,所用的主要仪器名称是
(3)试剂 2 最好选用
(4)操作 2 是
(5)操作 3 中温度计水银球的位置应为右图中 (填 a、b、c、d)所示,在该操作中,除蒸馏烧瓶、温度计 外,还需要的玻璃仪器有 、 、 、 ,收集乙酸的适宜温度是
三、羧酸
1、定义:羧酸是由烃基(或氢原子)与 相连组成的有机化合物,官能团为
2、通式:一元羧酸的通式为 R—COOH,饱和一元羧酸的分子通式:CnH2nO2 或
3、分类 (1)按分子中烃基的结构分类
(2)按分子中羧基的数目分类
【热身训练 4】
1、下列说法中,不正确的是( )
A.烃基与羧基直接相连的化合物叫做羧酸 B.饱和链状一元羧酸的组成符合 CnH2nO2 C.羧酸在常温下都能发生酯化反应 D.羧酸的官能团是—COOH 2、某有机物的结构简式为 ,则它是( )
A.饱和二元羧酸 B.芳香酸 C.脂环酸 D.高级脂肪酸
4、羧酸的命名
(1)俗名:某些羧酸最初是根据来源命名,称为俗名
如:甲酸来自蚂蚁,称为蚁酸;乙酸存在于食醋中,称为醋酸;苯甲酸存在于安息香胶中,称为安息香酸
(2)系统命名法:
①选主链,称某酸:选择含有 在内的最长碳链作为 ,根据主链的碳的数目命名为“某酸”
②编号位,定支链:主链编号时要从羧基上的碳原子开始编号
③写名称:取代基位次——取代基名称——某酸。名称中不必对羧基定位,因羧基必然在其主链的边端
(3)若分子中含有双键(或三键),则选含有羧基和双键(或三键)的最长碳链作为主链,根据主链上的碳原子数目称 “某烯(炔)酸”
(4)芳香族羧酸,若芳香环上连有取代基,则从羧基所连的碳原子开始编号,并使取代基的位次最小 (5)二元羧酸命名时,选择含有两个羧基的最长碳链作为主链,然后根据主链碳原子的数目称为某二酸
5、羧酸的物理性质 (1)溶解性:羧酸在水中的溶解性由组成羧酸的两个部分烃基(R—)和羧基(—COOH)所起的作用的相对大小决定;
R—部分不溶于水;羧基部分溶于水。当羧酸碳原子数在 4 以下时—COOH 部分的影响起主要作用,所以能与 水互溶。随着分子中碳链的增长,R—部分的影响起主要作用,所以羧酸在水中的溶解度迅速减小,直至相对 分子质量与烷烃相近时,它们的溶解度相近
(2)熔沸点:羧酸分子间可以形成氢键,这不仅是影响羧酸在水中的溶解性的因素,也是影响其沸点的主要因素 之一。羧酸中的两个氧原子,既能通过羟基氢和羟基氢形成氢键,也可以通过羰基氧和羟基氢形成氢键。所 以羧酸形成氢键的机会比相对分子质量相近的醇多,所以羧酸的沸点比相应的醇的沸点高
6、羧酸的化学性质 (1)弱酸性:RCOOH RCOO—+H+
羧酸的酸性 相关的化学方程式
羧酸能使紫色石蕊溶液变红色
②与活泼金属(Na)反应
③与某些金属氧化物(Na2O)反应
④与碱(NaOH、Cu(OH)2)发生中和反应
⑤与某些盐(Na2CO3、NaHCO3)反应
酚、醇、羧酸的羟基性质比较
含羟基的物质比较项目 醇羟基 水羟基 酚羟基 羧羟基
羟基上氢原子活泼性 从左到右依次增强
在水溶液中电离 极难电离 极难电离 微弱电离 部分电离
酸碱性 中性 中性 很弱的酸性 弱酸性
与 Na 反应 反应放出 H2 反应放出 H2 反应放出 H2 反应放出 H2
与 NaOH 反应 不反应 不反应 反应 反应
与 Na2CO3 反应 不反应 反应 反应
与 NaHCO3 反应 不反应 不反应 反应放出 CO2
【微点拨】
①常见物质的酸性:HCl(H2SO4)>乙二酸>甲酸>苯甲酸>乙酸>丙酸>H2CO3>苯酚>HCO3->CH3CH2OH
②和 Na2CO3 反应生成气体:1 mol —COOH 生成 0.5 mol CO2 气体
③和 NaHCO3 反应生成气体:1 mol —COOH 生成 1 mol CO2 气体
④和 Na 反应生成气体:1 mol —COOH 生成 0.5 mol H2;1 mol —OH 生成 0.5 mol H2
【热身训练 5】
1、某有机物与过量的钠反应得到 VA L 气体,另一份等质量的该有机物与纯碱刚好反应得到 VB L 气体(相同状况), 若 VA>VB,则该有机物可能是( )
A.HOCH2CH2OH B.CH3COOH C.HOOC—COOH D.HOOC—C6H4—OH
2、有机物 A 的结构简式是,下列有关 A 的性质的叙述中错误的是( ) A.A 与金属钠完全反应时,两者物质的量之比是 1∶3
B.A 与氢氧化钠完全反应时,两者物质的量之比是 1∶3 C.A 能与碳酸钠溶液反应
D.A 既能与羧酸反应,又能与醇反应
3、某有机物 A 的结构简式为 ,若取等质量的 A 分别与足量的 Na、NaOH、新制 的 Cu(OH)2 悬浊液充分反应,理论上消耗这三种物质的物质的量之比为( )
A.3∶2∶1 B.3∶2∶2 C.6∶4∶5 D.3∶2∶3
(2)酯化反应 :
无机含氧酸与醇作用也能生成酯
如:乙醇与硝酸的酯化反应:C2H5OH+HONO2 浓硫酸 C2H5—O—NO2(硝酸乙酯)+H2O
乙醇与硫酸的酯化反应:C2H5OH+HO—SO3H 100C C2H5—O—SO3H(硫酸氢乙酯)+H2O
四、特殊的羧酸
1、甲酸
(1)物理性质:甲酸俗称蚁酸,是有刺激性气味的无色液体,沸点 100.7 ℃,有腐蚀性,能和水、乙醇混溶
(2)分子组成和结构
(3)化学性质
①弱酸性:甲酸的电离方程式
②与活泼金属(Mg)反应放出 H2
③与某些金属氧化物(Na2O)反应
④与碱(NaOH)中和
⑤与某些盐(NaHCO3)反应
⑥甲酸与乙醇酯化反应
⑦甲酸与银氨溶液的反应
⑧甲酸与 Cu(OH)2 的反应
⑨甲酸与 Cu(OH)2 的反应(加热)
a、结构的特殊性决定了性质的特殊性,甲酸具有其它羧酸所没有的性质——还原性b、能发生银镜反应的有机物除了醛类,还有甲酸、甲酸盐、甲酸某酯
【热身训练 6】
1、某同学在学习了乙酸的性质后,根据甲酸的结构( )对甲酸的化学性质进行了下列推断,其中不正 确的是( )
A.能与碳酸钠溶液反应 B.能发生银镜反应 C.不能使酸性 KMnO4 溶液褪色 D.能与单质镁反应 2、若检验甲酸溶液中是否存在甲醛,下列操作中,正确的是( )
A.加入新制的 Cu(OH)2 悬浊液后加热,若有红色沉淀产生,则证明甲醛一定存在
B.若能发生银镜反应,则证明甲醛一定存在
C.与足量 NaOH 溶液混合,若其加热蒸出的产物能发生银镜反应,则甲醛一定存在
D.先将溶液充分进行酯化反应,收集生成物进行银镜反应,若有银镜生成,则甲醛一定存在 3、下列哪一种试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液( )
A.银氨溶液 B.浓溴水 C.新制 Cu(OH)2 悬浊液 D.FeCl3 溶液
2、乙二酸
(1)物理性质:俗称“草酸”,无色透明晶体,通常带两个结晶水,[(COOH)2?2H2O],加热至 100℃时失水成无水 草酸,易溶于水和乙醇。草酸钙难溶于水,是人体膀胱结石和肾结石的主要成分。乙二酸是最简单的饱和二 元羧酸,是二元羧酸中酸性最强的
(2)分子组成和结构
分子式 结构式 结构简式 结构特点
一个分子中含有两个羧基
(3)化学性质:乙二酸有较强的还原性,可被高锰酸钾氧化
①弱酸性:乙二酸的电离方程式
②乙二酸与酸性高锰酸钾溶液的反应
③乙二酸在浓硫酸作用下脱水
3、苯甲酸:俗称安息香酸,是白色针状晶体,易升华,微溶于水,易溶于乙酸、乙醚。苯甲酸及其钠盐或钾盐 常用作防腐剂
4、高级脂肪酸:高级脂肪酸指的是分子中含碳原子数较多的脂肪酸,它们的酸性很弱,在水中的溶解度不大甚 至难溶于水,硬脂 酸(C17H35COOH)、软脂酸(C15H31COOH)、油酸(C17H33COOH)、亚油酸(C17H31COOH)都是 常见的高级脂肪酸
5、羟基酸:如:柠檬酸、苹果酸、乳酸等,分子中含有羟基和羧基,因此既有羟基的特性,又有羧基的特性
【热身训练 7】
1、樱桃是一种抗氧化的水果,对人体有很大的益处,樱桃中含有一种羟基酸具有健脾作用。下列有关说法正确 的是( )
A.该羟基酸含有 3 种不同化学环境的氢原子 B.通常条件下,该羟基酸可以发生取代、消去和加成反应 C.该羟基酸可以使酸性高锰酸钾溶液褪色
D.含 1 mol 该羟基酸的溶液可与含 3 mol 氢氧化钠的溶液恰好完全反应
2、咖啡酸可用作化学原料的中间体,其结构如下所示,下列关于咖啡酸的说法中不正确的是( )
A.能发生加聚反应 B.能与 Na2CO3 溶液反应
C.1 mol 咖啡酸最多能与 3 mol NaOH 反应 D.1 mol 咖啡酸最多能与 3 mol Br2 反应
3、分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )
A.分子中含有 2 种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1 mol 分枝酸最多可与 3 mol NaOH 发生中和反应
(分枝酸)
D.可使溴的 CCl4 溶液、酸性 KMnO4 溶液褪色,且原理相同
4、羧酸 M 和羧酸 N 的结构简式如下图所示。下列关于这两种有机物说法正确的是( )
A.两种羧酸都能与溴水发生反应 B.两种羧酸遇 FeCl3 溶液都能发生显色反应 C.羧酸 M 与羧酸 N 相比少了两个碳碳双键
D.等物质的量的两种羧酸与足量烧碱溶液反应时,消耗 NaOH 的量相同
5、巴豆酸的结构简式为 CH3—CH===CH—COOH。试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸 反应的物质是( )
①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤酸性 KMnO4 溶液
A.②④⑤ B.①③④ C.①②③④ D.①②③④⑤
五、“形形色色”的酯化反应——酯化反应的通式:
1、一元羧酸与一元醇的酯化反应:RCOOH+HOR′ RCOOR′+H2O
甲酸与甲醇
2、多元醇与一元羧酸的酯化反应 (乙二醇和乙酸)
1:1 反应
1:2 反应
3、多元羧酸与一元醇的酯化反应 (乙二酸和乙醇)
1:1 反应
1:2 反应
4、多元羧酸与多元醇的酯化反应 (乙二酸和乙二醇)
1:1 成链状
1:1 成环状
成聚酯
5、羟基酸的酯化反应 (乳酸)
两分子乳酸 酯化成链状
两分子乳酸 酯化成环状
一分子乳酸 酯化成环状
乳酸的缩聚 反应
【课后作业】
1、乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是( ) A.乙酸的官能团为—OH B.乙酸的酸性比碳酸弱 C.乙酸能够与金属钠反应产生氢气 D.乙酸能使紫色的石蕊溶液变蓝
2、下列说法中,不正确的是( )
A.烃基与羧基直接相连的化合物叫做羧酸 B.饱和链状一元羧酸的组成符合 CnH2nO2 C.羧酸在常温下都能发生酯化反应 D.羧酸的官能团是—COOH
3、钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH,从产生氢气的剧烈程度可推断出 这三种物质产生 H+的难易程度是(从难到易的顺序)( )
A.①②③ B.②③① C.③①② D.②①③ 4、下列关于羧酸化学性质的说法中,正确的是( )
A.羧酸是弱酸,其酸性比碳酸的弱 B.羧酸能够发生酯化反应,该反应也是取代反应 C.羧酸发生化学反应的部位只有羧基 D.羧酸不能被还原为相应的醇
5、下列物质中,属于饱和一元脂肪酸的是( )
A.乙二酸 B.苯甲酸 C.硬脂酸 D.石炭酸 6、下列有机物中,互为同系物的是( )
A.甲酸与油酸 B.软脂酸和丙烯酸 C.硬脂酸和油酸 D.甲酸与硬脂酸 7、实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是( )
A.饱和食盐水 B.饱和碳酸钠溶液 C.饱和 NaOH 溶液 D.浓硫酸
8 、 已 知 在 水 溶 液 中 存 在 平 衡 : 当 与
CH3CH2OH 发生酯化反应时,不可能生成的物质是( )
C.H—18OH D.H2O
9、阿魏酸化学名称为 4-羟基-3-甲氧基肉桂酸,可以做医药、保健品、化妆品原料和食品添加剂,结构简式为
。在阿魏酸溶液中加入合适试剂(可以加热),检验其官能团。下列试剂、现
象、结论都正确的是( )
选项 试剂 现象 结论
A 氯化铁溶液 溶液变蓝色 它含有酚羟基
B 银氨溶液 产生银镜 它含有醛基
C 碳酸氢钠溶液 产生气泡 它含有羧基
D 溴水 溶液褪色 它含有碳碳双键
10、某有机物 A 的结构简式为 ,取一定量 Na、NaOH、NaHCO3 分别与等物质的量的该物质 充分反应(反应时可加热煮沸),则消耗 Na、NaOH、NaHCO3 三种物质的物质的量之比为( )
A.2∶2∶1 B.1∶1∶1 C.3∶2∶1 D.3∶3∶2
11、取一定量的有机物和足量 Na 反应得到 Va L H2,取另一份等物质的量的同种有机物和足量 NaHCO3 反应得 到 Vb L CO2,若在同温同压下,Va=Vb≠0,则该有机物可能是( )
A.② B.②③④ C.只有④ D.①
12、2016 年诺贝尔化学奖由法国、美国及荷兰的三位化学家获得,以表彰他们在“分子马达”研究方面的成就, 一种光驱分子马达结构如图所示。下列有关该分子的说法正确的是( )
A.该分子属于芳香烃 B.两个苯环一定处于同一平面
C.能与 NaHCO3 和酸性 KMnO4 溶液反应 D.1 mol 该分子最多可与 2 mol H2 发生加成反应
13、(双选)下列说法中,正确的是( )
A. 的名称是 2-甲基-3-羟基戊酸
B.CH3COOH 与 CH3CH18OH 发生酯化反应可生成酯 CH3CO18OCH2CH3
C.乙酸、苯酚均能与 NaOH 溶液反应,二者分子中官能团相同
D.可用新制的 Cu(OH)2 来区分甲醇、甲酸、乙醛、乙酸
14、某种有机物的氧化产物是甲,还原产物是乙。甲和乙都能和钠反应放出氢气,甲和乙反应生成丙,甲和丙 都能发生银镜反应,则该有机物是( )
A.甲醇 B.甲醛 C.甲酸 D.乙醛 15、分子式为 C4H8O3 的有机物,一定条件下具有如下性质:
①在浓硫酸存在下,能分别与 CH3CH2OH 或 CH3COOH 反应
②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物质,该物质只存在一种结构形式
③在浓硫酸存在下,能生成一种分子式为 C4H6O2 的五元环状化合物 则 C4H8O3 的结构简式为( )
A. HOCH2COOCH2CH3 B. CH3CH(OH)CH2COOH
C. HOCH2CH2CH2COOH D. CH3CH2CH(OH)COOH
16、EPA、DPA、DHA(结构式见下图)是三种ω-3 不饱和脂肪酸,是人体大脑发育、成长的重要物质。下列说法 不正确的是( )
A.EPA 与 DPA 互为同系物 B.DPA 与 DHA 互为同分异构体
C.EPA 的分子式为 C20H30O D.EPA、DPA、DHA 均能使溴的四氯化碳溶液褪色
17、A、B、C、D、E 均为有机化合物,它们之间的关系如下图所示(提示:RCH===CHR′在高锰酸钾酸性溶液 中反应生成 RCOOH 和 R′COOH,其中 R 和 R′为烷基)。回答下列问题:
(1)直链化合物 A 的相对分子质量小于 90,A 分子中碳、氢元素的总质量分数为 0.814,其余为氧元素质量分数, 则 A 的分子式为
(2)已知 B 与 NaHCO3 溶液完全反应,其物质的量之比为 1∶2,则在浓硫酸的催化下,B 与足量的 C2H5OH 发生 反应的化学方程式是 ,反应类型为
(3)A 可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则 A 的结构简式是 (4)D 的同分异构体中,能与 NaHCO3 溶液反应放出 CO2 的有 种,其相应的结构简式是 18、化合物 A 最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A 的钙
盐是人们喜爱的补钙剂之一。A 在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在 下,A 可发生如下图所示的反应:
试写出:
(1)化合物的结构简式:A ,B ,D (2)化学方程式:A―→E
A―→F (3)指出反应类型:A―→E
A―→F
19、乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味。实验室制备乙酸异戊酯的反应装置示意图和 有关信息如下:
实验步骤:在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min, 反应液冷至室温后,倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水 硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答 下列问题:
(1)装置B的名称是
(2)在洗涤操作中,第一次水洗的主要目的是 ; 第二次水洗的主要目的是
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 a. 直接将乙酸异戊酯从分液漏斗的上口倒出
b. 直接将乙酸异戊酯从分液漏斗的下口放出
c. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d. 先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出 (4)本实验中加入过量乙酸的目的是 (5)实验中加入少量无水硫酸镁的目的是 (6)在蒸馏操作中,仪器选择及安装都正确的是
a b c d (7)本实验的产率是
a. 30% b. 40% c. 60% d. 90%
(8)在进行蒸馏操作时,若从 130 ℃开始收集馏分,产率偏 (填“高”或“低”),原因是
。
分子式 电子式 结构式 结构简式 结构特点
醛基的性质:银镜反应,与 H2 还原反应 羧酸的性质:酸的通性,酯化反应
2
相对分子质量 密度 /g·cm-3 沸点 /℃ 水中溶解度
异戊醇 88 0.8123 131 微溶
乙酸 60 1.0492 118 溶
乙酸异戊酯 130 0.8670 142 难溶
