人教版(新课程标准)选修4 第四章 第一节原电池基本原理
文档属性
| 名称 | 人教版(新课程标准)选修4 第四章 第一节原电池基本原理 |

|
|
| 格式 | zip | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-26 00:00:00 | ||
图片预览



文档简介
(共10张PPT)
原电池基本原理
选修四第四章第一节 第一讲
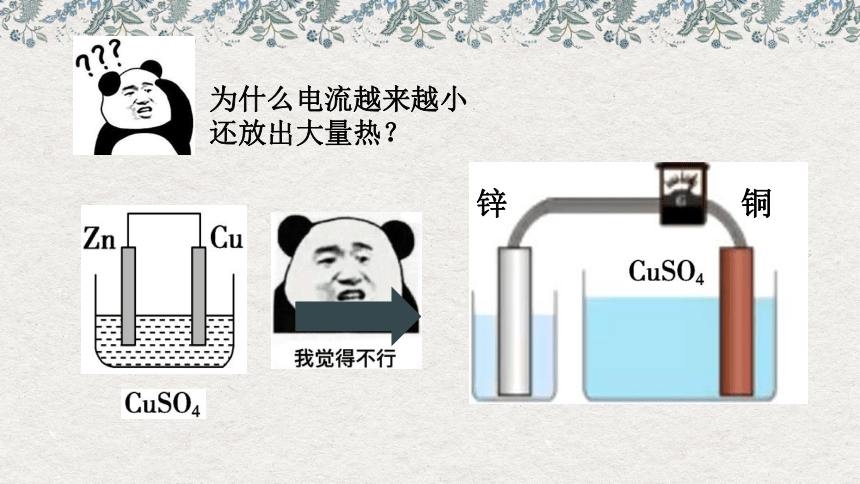
但问题出现了,当该原电池连接电流表并开始工作一段时间后,电流表的示数在逐渐减小,甚至快到0的位置。同时溶液还是热的。
设计原电池
设计步骤:
①根据反应式确定电极材料
②判断电解质溶液
Cu2++Zn=Cu+Zn2+
负极反应式:Zn-2e-=Zn2+
正极反应式:Cu2++2e-=Cu
为什么电流越来越小
还放出大量热?
锌
铜
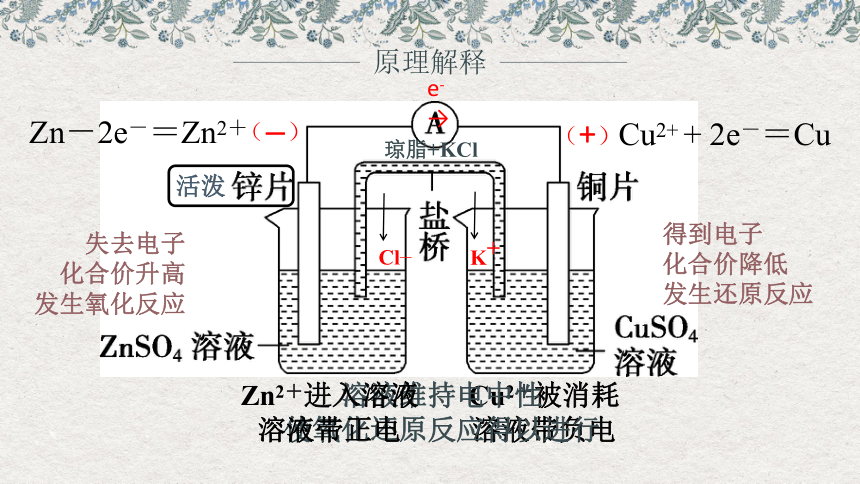
Cu2+被消耗
溶液带负电
溶液维持电中性
使氧化还原反应得以进行
原理解释
活泼
e-
→
失去电子
化合价升高
发生氧化反应
Cl—
K+
琼脂+KCl
(—)
(+)
Zn-2e-=Zn2+
Cu2+ + 2e-=Cu
得到电子
化合价降低
发生还原反应
Zn2+进入溶液溶液带正电
不同点:双液原电池将氧化反应与还原反应分开进行,避免相互反应的电极与溶液直接接触将化学能转化为热能,造成能量损耗。同时也能够产生持续稳定的电流。
对比二者
锌半电池
铜半电池
相同点:反应原理完全相同
负极材料:_____________________ 正极材料:_________________________
电解质溶液:___________________ 电解质溶液:_______________________
负极反应式:___________________ 正极反应式:________________________
设计一个原电池
根据下面的氧化还原反应设计一个双液原电池,并标出相关信息
可选择的电极材料有:Mg、Al、Zn、Fe、Cu、Ag、Pt、碳棒
可选择的电解质溶液有:HCl、NaCl、ZnCl2、FeCl2
Zn(s) + Fe2+(aq) = Zn2+(aq) + Fe(s)
负极材料:______________ 正极材料:______________
电解质溶液:____________ 电解质溶液:____________
负极反应式:____________ 正极反应式:____________
Zn
FeCl2
Zn-2e-=Zn2+
Fe2++2e-=Fe
不与负极反应
NaCl、ZnCl2
活泼性比负极弱的金属或石墨
Fe、Cu、Ag、
Pt、碳棒
①
②
根据装置
写出电极反应式
(找总反应口诀:看对角线)
总反应离子方程式:______________________ 总反应离子方程式:_______________________
负极反应式:____________________________ 负极反应式:_____________________________
正极反应式:____________________________ 正极反应式:_____________________________
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+2H+=Fe2++H2↑
Cu+2Ag+=Cu2++Ag
Cu-2e-=Cu2+
2Ag++2e-=2Ag
知识小结
一、构成条件
二、原电池工作原理
1、活泼性不同的两种金属
2、电解质溶液
3、形成闭合回路
三、双液原电池注意事项
1、同侧不反应
2、对角线作总反应
3、盐桥的作用
再见!
课后作业:
教材P73作业
原电池基本原理
选修四第四章第一节 第一讲
但问题出现了,当该原电池连接电流表并开始工作一段时间后,电流表的示数在逐渐减小,甚至快到0的位置。同时溶液还是热的。
设计原电池
设计步骤:
①根据反应式确定电极材料
②判断电解质溶液
Cu2++Zn=Cu+Zn2+
负极反应式:Zn-2e-=Zn2+
正极反应式:Cu2++2e-=Cu
为什么电流越来越小
还放出大量热?
锌
铜
Cu2+被消耗
溶液带负电
溶液维持电中性
使氧化还原反应得以进行
原理解释
活泼
e-
→
失去电子
化合价升高
发生氧化反应
Cl—
K+
琼脂+KCl
(—)
(+)
Zn-2e-=Zn2+
Cu2+ + 2e-=Cu
得到电子
化合价降低
发生还原反应
Zn2+进入溶液溶液带正电
不同点:双液原电池将氧化反应与还原反应分开进行,避免相互反应的电极与溶液直接接触将化学能转化为热能,造成能量损耗。同时也能够产生持续稳定的电流。
对比二者
锌半电池
铜半电池
相同点:反应原理完全相同
负极材料:_____________________ 正极材料:_________________________
电解质溶液:___________________ 电解质溶液:_______________________
负极反应式:___________________ 正极反应式:________________________
设计一个原电池
根据下面的氧化还原反应设计一个双液原电池,并标出相关信息
可选择的电极材料有:Mg、Al、Zn、Fe、Cu、Ag、Pt、碳棒
可选择的电解质溶液有:HCl、NaCl、ZnCl2、FeCl2
Zn(s) + Fe2+(aq) = Zn2+(aq) + Fe(s)
负极材料:______________ 正极材料:______________
电解质溶液:____________ 电解质溶液:____________
负极反应式:____________ 正极反应式:____________
Zn
FeCl2
Zn-2e-=Zn2+
Fe2++2e-=Fe
不与负极反应
NaCl、ZnCl2
活泼性比负极弱的金属或石墨
Fe、Cu、Ag、
Pt、碳棒
①
②
根据装置
写出电极反应式
(找总反应口诀:看对角线)
总反应离子方程式:______________________ 总反应离子方程式:_______________________
负极反应式:____________________________ 负极反应式:_____________________________
正极反应式:____________________________ 正极反应式:_____________________________
Fe-2e-=Fe2+
2H++2e-=H2↑
Fe+2H+=Fe2++H2↑
Cu+2Ag+=Cu2++Ag
Cu-2e-=Cu2+
2Ag++2e-=2Ag
知识小结
一、构成条件
二、原电池工作原理
1、活泼性不同的两种金属
2、电解质溶液
3、形成闭合回路
三、双液原电池注意事项
1、同侧不反应
2、对角线作总反应
3、盐桥的作用
再见!
课后作业:
教材P73作业
