高二化学人教版选修4第一章化学反应与能量综合练习(含详解)
文档属性
| 名称 | 高二化学人教版选修4第一章化学反应与能量综合练习(含详解) |  | |
| 格式 | zip | ||
| 文件大小 | 190.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-30 21:42:19 | ||
图片预览




文档简介
高二选修四化学周练
1.已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJ?mol-1
下列说法不正确的是( )
A.该反应可作为氢氧燃料电池的反应原理 B.破坏1mol H-O键需要的能量是463.4 kJ
C.H2O(g)=H2(g) +1/2O2(g) ΔH = +241.8 kJ?mol-1 D.H2(g)中的H-H键比H2O(g)中的H-O键牢固
2.已知:2H2(g)+ O2(g)=2H2O(l) ΔH=-572 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶2 B.1∶3 C.1∶4 D.2∶3
3.化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198?P—O:360?O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为 ( )
A.-1638 kJ·mol-1 B.+ 638 kJ·mol- C.-126 kJ·mol-1 D.+126 kJ·mol-1
4.某有机物的结构简式为,则下列说法错误的是( )
A.该有机物的分子式为C12H12O4
B.1mol该有机物最多能与4mol H2反应
C.该有机物可与碳酸氢钠溶液反应放出CO2,生成2.24L CO2(标况下)需要0.1mol该有机物
D.该有机物可发生氧化、取代、加成和还原反应
5.反应3A(g)+B(g)2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为( )
A.v(A)=0.15 mol·L?1 B.v(B)=0.05 mol·L?1·s?1 C.v(C)=0.10 mol·L?1·min?1 D.v(D)=0.10 mol·L?1·min?1
6.100 mL 6 mol·L-1H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠固体 B.醋酸钠固体 C.硫酸钾固体 D.硝酸钠固体
7.已知:①H2O(g)=H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)=C2H5OH(l) ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )(单位:kJ)
A.Q1+Q2+Q3 B.1.5Q1-0.5Q2+0.5Q3
C.0.5Q1-1.5Q2+0.5Q3 D.0.5(Q1+Q2+Q3)
8.按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的ΔH=__________。
(2)在1.01×105 Pa时,16 g S在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S燃烧的热化学方程式为_________________________________________________________________。
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1 g甲硅烷自燃放出44.6 kJ热量,其热化学方程式为____________________________________________________________。
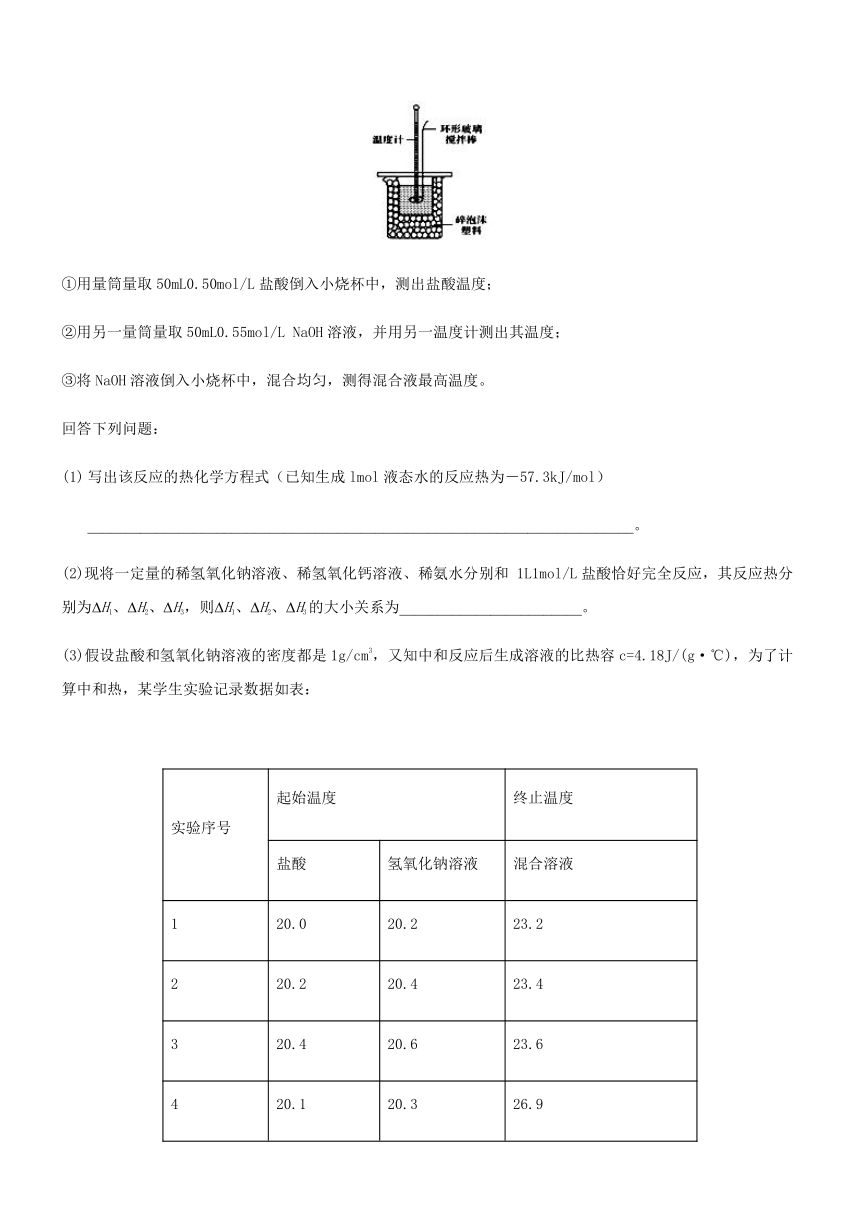
9.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1) 写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)
________________________________________________________________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为?H1、?H2、?H3,则?H1、?H2、?H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
4 20.1 20.3 26.9
依据该学生的实验数据计算,该实验测得的中和热?H____?????_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是( )
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
10.氮及其化合物在人们的生活经常出现
(1)汽车尾气中NO生成过程的能量变化示意图如下:
该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)一定温度下,在体积为0.5 L的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如右图所示。
①该反应的化学反应方程式:____________________________________________________________。
②在0~3 min内,用Y表示的反应速率为___________________。
③下列叙述能说明该反应已达到化学平衡状态的是_____________(填字母)。
a.容器内压强不再发生变化 b.X的体积分数不再发生变化
c.容器内原子总数不再发生变化 d.相同时间内消耗nmolY的同时生成2nmol X
④反应达到平衡后,若降低温度,则υ(正)______,υ(逆)________。(填“增大”“减小”或“不变”)。
(3)反应 A(g)+3B(g)═2C(g)+3D(g)在四种不同情况下的反应速率分别为:
①υ (A)=0.015mol (L?s)﹣1 ②υ (B)=0.09mol (L?s)﹣1
③υ (C)=2.4mol (L?min )﹣1 ④υ (D)=0.045mol (L?s)﹣1
该反应在四种不同情况下速率由大到小的顺序为(用序号填空)__________________________。
11.甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为_________________________________________。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) = CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是_________。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。
根据图信息分析,与汽油相比,甲醇作为燃料的优点是______________________________________________。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
① 补全上图:图中A处应填入______。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______(填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) = CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) = H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) = CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) = CH3OH(g) 。该反应的ΔH为_________ kJ/mol。
高二化学周练一参考答案
1. 【答案】D 【解析】A. 该反应是氧化还原反应,可以用作氢氧燃料电池的原理,A正确;
B. 根据题中的热化学方程式得:ΔH=2EH-H+EO-O-4EH-O,EH-O==463.4kJ·mol-1,B正确;
C. 根据盖斯定律得:H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ?mol-1,C正确;
D. 由题知,H-H键键能为436 kJ·mol-1,H-O键键能为463.4 kJ·mol-1,H-O键 键能更大,所以H-O键更牢固,D错误;
故合理选项为D。
2. 【答案】B 【详解】H2与CH4的混合气体112 L(标准状况),其物质的量为5mol,其完全燃烧生成CO2和H2O(l),实验测得反应放热3 695 kJ。设H2与CH4的物质的量分别为x和(5mol-x),则0.5x572 kJ·mol-1+(5mol-x)890 kJ·mol-1=3 695 kJ,解之得,x=1.25mol,(5mol-x)=3.75mol,原混合气体中H2与CH4的物质的量之比是1∶3,故选B。
3. 【答案】A 【详解】各化学键键能为:P-P 198kJ?mol-1、P-O 360kJ?mol-1、O=O 498 kJ?mol-1,
反应热的焓变:△H=反应物总键能-生成物总键能,则反应P4(白磷)+3O2=P4O6的反应热为:△H=6×198kJ?mol-1+3×498kJ?mol-1-12×360kJ?mol-1=-1638kJ?mol-1,
答案选A。
4. 【答案】B 【解析】A.由结构简式可知有机物的分子式为C12H12O4,故A正确;
B.能与氢气发生加成反应的为碳碳双键、苯环和醛基,则1mol该有机物最多能与5mol H2反应,故B错误;
C.只有羧基与碳酸氢钠反应,则0.1mol有机物可生成0.1mol二氧化碳,体积为2.24L,故C正确;
D.含有碳碳双键、醛基,可发生加成、氧化、还原反应,含有羧基,可发生取代反应,故D正确。
故选:B。
5. 【答案】C 【解析】反应3A(g)+B(g)2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则用物质B表示0~4min内此反应的平均速率为。
【详解】
A. 化学反应速率的单位为或,故A错误;
B. 由分析可知,,故B错误;
C. ,故C正确;
D. D为固体,无法计算其浓度,故无法用其表示化学反应速率,故D错误;
故答案选C。
6. 【答案】B 【解析】根据反应的实质为Zn+2H+═Zn2++H2↑,Zn过量时,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量。
A项、碳酸钠与稀硫酸反应生成CO2、水和硫酸钠,减少了溶液中氢离子的物质的量和浓度,反应速率降低,但生成的氢气也减少,故A错误;
B项、醋酸钠与稀硫酸反应生成醋酸和硫酸钠,醋酸为弱酸,溶液中氢离子浓度减小,反应速率降低,但与锌反应的氢离子物质的量没有变化,生成氢气的总量没有变化,故B正确;
C项、硫酸钾固体溶于稀硫酸,溶液中氢离子的物质的量和浓度均不变,反应速率和生成氢气的总量都没有变化,故C错误;
D项、加入硝酸钠固体,NO3-在酸性条件下表现强氧化性,与锌反应生成一氧化氮得不到氢气,故D错误;
故选B。
7. 【答案】B 【解析】由盖斯定律,①×3+③-②得到反应C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),则△H=3ΔH1+ΔH3—ΔH2=-(3Q1-Q2+ Q3)kJ/mol,23g酒精物质的量为=0.5mol,则23g酒精完全燃烧生成液态水放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJ,故选B。
8. 【答案】-286 kJ·mol-1 S(s)+O2(g)SO2(g) ΔH=-297 kJ·mol-1 SiH4(g)+2O2(g)SiO2(s)+2H2O(l) ΔH=-1 427.2 kJ·mol-1
【解析】根据燃烧热的概念计算燃烧热;根据题干信息书写热化学方程式。
(1)燃烧热是指1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,4 g氢气放出572 kJ的热量,则1molH2的燃烧放出的热量为572 kJ/2=286kJ,所以ΔH=-286 kJ·mol-1,
故答案为:-286 kJ·mol-1;
(2)16 g S燃烧放出148.5 kJ的热量,则1molS燃烧放出的热量为148.5 kJ×2=297 kJ,则S燃烧的热化学方程式为:S(s)+O2(g)SO2(g) ΔH=-297 kJ·mol-1,
故答案为:S(s)+O2(g)SO2(g) ΔH=-297 kJ·mol-1;
(3)1 g甲硅烷自燃放出44.6 kJ热量,则1mol甲硅烷自燃放出44.6 kJ×32=1 427.2 kJ 热量,其热化学方程式为SiH4(g)+2O2(g)SiO2(s)+2H2O(l) ΔH=-1 427.2 kJ·mol-1,
故答案为:SiH4(g)+2O2(g)SiO2(s)+2H2O(l) ΔH=-1 427.2 kJ·mol-1。
9. 【答案】HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol △H1=△H2<△H3 -51.8kJ/mol 不相等 相等 D
【解析】
(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol;
(2)NaOH、Ca(OH)2都属于强碱,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1mol?L-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1mol?L-1的稀盐酸恰好完全反应放热小于57.3kJ,放热反应的?H<0,所以△H1=△H2<△H3;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.1℃,反应后温度为:23.2℃,反应前后温度差为:3.1℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.5℃,反应后温度为:23.6℃,反应前后温度差为:3.1℃;第4次实验盐酸和NaOH溶液起始平均温度为20.2℃,反应后温度为:26.9℃,反应前后温度差为:6.7℃,误差太大,舍去;则实验中平均温度差为3.1℃,50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g?℃),代入公式Q=cm△t得生成0.025mol的水放出热量Q=4.18J/(g?℃)×100g×3.1℃=12958J=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol;
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增多,但是中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,测得中和热数值相等,故答案为:不相等;相等;
(5)A、提高所用试剂量的准确度可提高测量反应热的精确度;
B、能减少热量散失,可提高实验精度;
C、能减少热量散失,可提高实验精度;
D、温度计用500℃量程,最小刻度变大,测定温度不准确,使实验精度降低。
答案选D。
10. 【答案】吸收 183 2X?Y 0.2mol/(L·min) ab 减小 减小 ②>③>①=④
【解析】(1)若断键吸收的总能量大于成键放出的总能量为吸热反应,反之为放热反应;
(2) ①反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,根据物质的量的变化判断计量数之间的关系;
②根据 计算以气体Y表示的平均反应速率;
③根据平衡标志判断是否达到平衡状态。
④降低温度反应速率一定减小;
(3)根据反应速率之比等于化学计量数之比判断。
【详解】
(1)根据图示,断键吸收的总能量是945 kJ +498 kJ =1443kJ,成键放出的总能量为2mol×630 kJ/mol=1260 kJ,放出的能量小于吸收的能量,所以1mol N2和1molO2完全反应生成NO,会吸收1443kJ-1260kJ=183kJ的能量;
(2) ①由图象可知, Y的物质的量逐渐增多,X的物质的量逐渐减少,则X为反应物,Y为生成物,在相等的时间内X、Y的物质的量变化之比为0.6:0.3=2:1,所以反应方程式应为:2X?Y;
②根据0.2mol/(L·min);
③a.2X?Y反应前后气体物质的量是变量,在恒容容器中总压强是变量,总压强不再发生变化一定平衡,故选a;
b.X的体积分数不再发生变化,说明X的浓度不再变化,一定达到平衡状态,故选b;
c.根据质量守恒,原子总数是恒量,容器内原子总数不再发生变化,不一定平衡,故不选c;
d.相同时间内消耗nmolY的同时生成2nmol X,都是逆反应速率,不能推出正逆反应速率相等,不一定平衡,不选d;
④降低温度反应速率减小,所以反应达到平衡后,若降低温度,则υ(正)减小,υ(逆)减小;
(3) ①υ (A) ÷1=0.015mol (L?s)﹣1÷1=0.015mol (L?s)﹣1;
②υ (B) ÷3=0.09mol (L?s)﹣1÷3=0.03mol (L?s)﹣1
③υ (C) ÷2=2.4mol (L?min )﹣1÷2=1.2mol (L?min )﹣1=0.02 mol (L?s)﹣1
④υ (D) ÷3=0.045mol (L?s)﹣1÷3=0.015mol (L?s)﹣1;速率由大到小的顺序为②>③>①=④。
11. 【答案】C8H18(l) + 25/2O2(g)=8CO2(g) + 9H2O(l) ΔH=-5518 kJ/mol C8H18 汽车的加速性能相同的情况下,CO排放量低,污染小 1 mol CO2(g) + 3 mol H2(g) 不变 -91
【解析】
(1)根据书写热化学反应方程式的方法书写;
(2)假设质量均为1g,计算出1g CH3OH和1g辛烷完全燃烧放出的热量,再判断;
(3)根据图像可知,甲醇作为燃料时,根据汽车的加速性能与 CO排放量的关系分析解答;
(4)①CO2(g)和H2(g)为原料生成1mol甲醇和1mol水,根据质量守恒分析解答;②根据催化剂与焓变的关系判断;
(5)根据盖斯定律分析解答。
【详解】
(1)在25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量,所以其热化学反应方程式为:C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ?mol-1,故答案为:C8H18(l)+O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJ?mol-1;
(2)假设质量均为1g,则1g CH3OH完全燃烧放出的热量==22kJ,1g辛烷完全燃烧放出的热量==48kJ,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是C8H18(或辛烷),故答案为:C8H18(或辛烷);
(3)根据图像可知,汽车的加速性能相同的情况下,甲醇作为燃料时CO排放量低,污染小,故答案为:汽车的加速性能相同的情况下,CO排放量低,污染小;
(4)①以CO2(g)和H2(g)为原料合成甲醇,反应生成1mol甲醇和1mol水,根据质量守恒,需要1mol二氧化碳和3mol氢气,因此图中A处应填入1 mol CO2(g) + 3 mol H2(g),故答案为:1 mol CO2(g) + 3 mol H2(g);
②加入催化剂,不能改变反应的焓变,因此Δ H不变,故答案为:不变;
(5)①CO(g)+1/2 O2(g) =CO2(g) Δ H1=-283 kJ/mol ,②H2(g)+1/2 O2(g) = H2O(g) Δ H2=-242 kJ/mol,③CH3OH(g) + 3/2 O2(g) =CO2 (g) + 2H2O(g) Δ H3=-676 kJ/mol,根据盖斯定律,将①+②×2-③,得:CO(g) + 2H2(g) =CH3OH(g) ΔH=(-283 kJ/mol)+(-242 kJ/mol)×2-(-676 kJ/mol)=-91 kJ/mol,故答案为:-91。
