第六单元 碳和碳的氧化物 复习课件(22张PPT)
文档属性
| 名称 | 第六单元 碳和碳的氧化物 复习课件(22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 18:12:39 | ||
图片预览




文档简介
(共22张PPT)
复习 碳和碳的氧化物
学科:化学
年级:九年级
版本:人民教育出版社
现在给大家提供C、H、O、Ca四种元素,请大家以最快的速度说出它们能组成哪些物质?
课前热身:
1、能熟练表达碳单质、二氧化碳和一氧化碳的性质、用途等。会熟练书写相关反应的化学方程式。
2、会用比较法对碳及其化合物的性质进行复习归纳,并能建构他们的相互转换关系。
目标要求:
复习方法 :比较学习法
建构归纳法
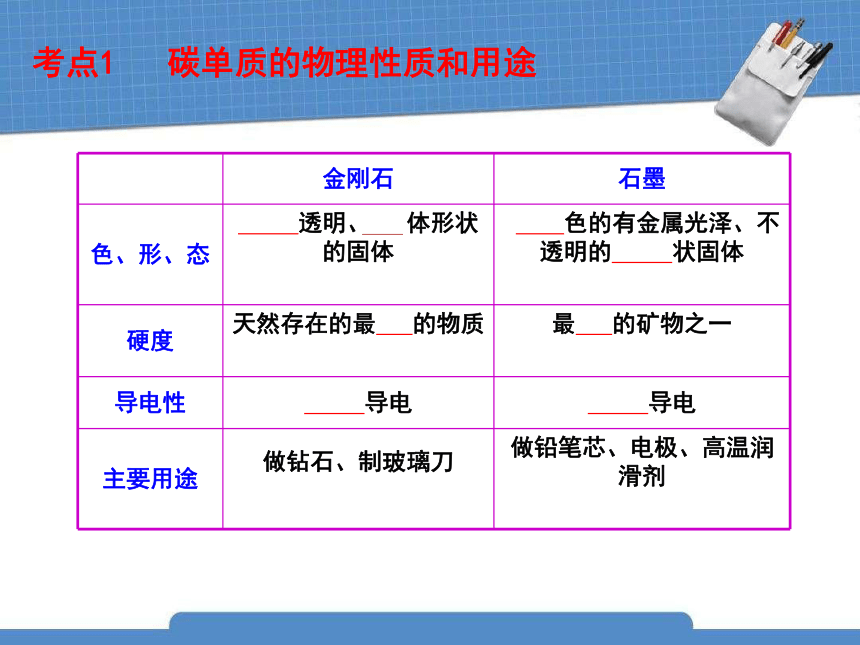
考点1 碳单质的物理性质和用途
金刚石 石墨
色、形、态 透明、 体形状的固体
色的有金属光泽、不透明的 状固体
硬度 天然存在的最 的物质
最 的矿物之一
导电性 导电 导电
主要用途 做钻石、制玻璃刀
做铅笔芯、电极、高温润滑剂
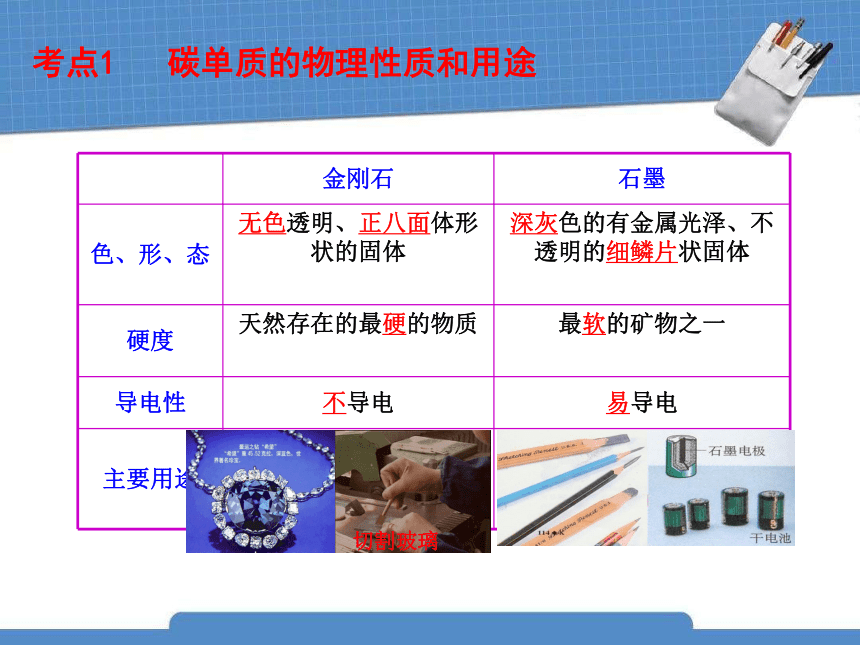
考点1 碳单质的物理性质和用途
金刚石 石墨
色、形、态 无色透明、正八面体形状的固体
深灰色的有金属光泽、不透明的细鳞片状固体
硬度 天然存在的最硬的物质
最软的矿物之一
导电性 不导电 易导电
主要用途 做钻石、制玻璃刀
做铅笔芯、电极、高温润滑剂
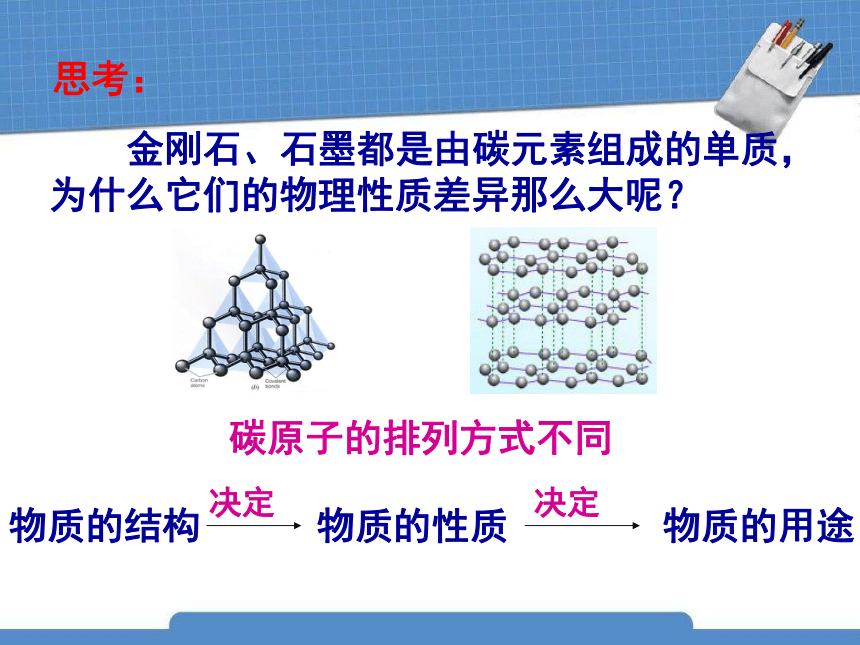
金刚石、石墨都是由碳元素组成的单质,为什么它们的物理性质差异那么大呢?
思考:
碳原子的排列方式不同
决定
决定
用墨书写或绘画
作
可燃性
还原性
化学性质
(O2不充足)
(O2充足)
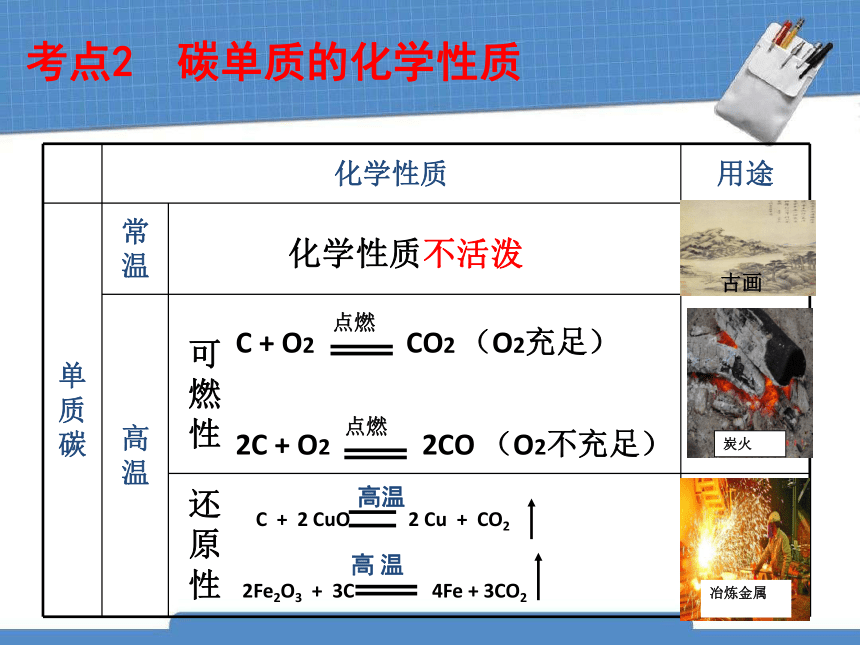
考点2 碳单质的化学性质
化学性质 用途
单质碳 常温
高温
用墨书写或绘画
作燃料
冶炼金属
可燃性
还原性
化学性质不活泼
考点2 碳单质的化学性质
化学性质 用途
单质碳 常温
高温
色 味 体,固体为
色 味 体
比空气
比空气
溶于水
溶于水
能用 法
或 法收集
只能用 法收集
考点3 二氧化碳和一氧化碳的性质
CO2 CO
物理性质 颜色状态
密度
溶解性
收集方法
无色无味气体,固体为干冰
无色无味气体
比空气大
比空气略小
能溶于水
难溶于水
能用向上排空气法或排水法收集
只能用排水法收集
考点3 二氧化碳和一氧化碳的性质
CO2 CO
物理性质 颜色状态
密度
溶解性
收集方法
既不 也
不支持
无
无
无
无
考点3 二氧化碳和一氧化碳的性质
物质 一氧化碳 二氧化碳
化
学
性
质 可燃性
还原性
与水反应
与石灰水反应
毒性
既不燃烧也
不支持燃烧
无
无
H2O+CO2===H2CO3
无
Ca(OH)2+CO2===H2O+CaCO3↓
剧毒
无
考点3 二氧化碳和一氧化碳的性质
物质 一氧化碳 二氧化碳
化
学
性
质 可燃性
还原性
与水反应
与石灰水反应
毒性
碳和碳的化合物知识框架
碳和碳的化合物
2.可燃性
3.还原性
1 不能燃烧也不能支持燃烧
2.与水反应
3.与石灰水反应
4.与灼热的碳反应
1.可燃性
2.还原性
3.毒性
2.煅烧
CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
化学性质:
1、稳定性:常温下,碳的化学性质不活泼
标出C、CO、CO2、CaCO3、H2CO3 这五种物质的转换过程,并写出相应的化学方程式。
构建知识网络
构建知识网络
1.下列物质的性质与所对应的用途没有直接关系的是( )
?
A.石墨能导电﹣可作电极
?
B.二氧化碳用于灭火﹣能与水反应
?
C.活性炭用于净水﹣吸附性
D.金刚石用于裁玻璃﹣硬度大
?
课堂演练:
B
????????????????????????????????????? ???????????????????? ???????????????????????
2.下列有关二氧化碳的实验中,只能证明二氧化碳物理性质的是( )
课堂演练:
B
3.用化学方法鉴别二氧化碳和一氧化碳:
①分别点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
②分别倒入澄清石灰水,变浑浊的是二氧化碳,不变的是一氧化碳。
③分别滴入紫色的石蕊试液,变红的是二氧化碳,不变的是一氧化碳。
④分别通过灼热的氧化铜,使氧化铜黑色变为红色的是一氧化碳,另一种是二氧化碳。
课堂演练:
4.如果要除去CO2中少量的CO,应该采用的方法是 ( )
A.把混合气体点燃
B. 把混合气体通过灼热的氧化铜
C.把混合气体通过澄清石灰水
D. 把混合气体从一个容器倾倒到另一个容器
B
课堂演练:
课堂演练:
5. A、B、C、D、E五种物质,它们之间有下列转换关系:
A
D
B
E
C
E
(1)写出物质的名称 : A B C
D E
(2)实验室制二氧化碳的化学方程式
+氧化铜
石灰水
+水
+A
高温
煅烧
co2
CaCO3
H2CO3
c
CO
c
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
课堂演练:
复习 碳和碳的氧化物
学科:化学
年级:九年级
版本:人民教育出版社
现在给大家提供C、H、O、Ca四种元素,请大家以最快的速度说出它们能组成哪些物质?
课前热身:
1、能熟练表达碳单质、二氧化碳和一氧化碳的性质、用途等。会熟练书写相关反应的化学方程式。
2、会用比较法对碳及其化合物的性质进行复习归纳,并能建构他们的相互转换关系。
目标要求:
复习方法 :比较学习法
建构归纳法
考点1 碳单质的物理性质和用途
金刚石 石墨
色、形、态 透明、 体形状的固体
色的有金属光泽、不透明的 状固体
硬度 天然存在的最 的物质
最 的矿物之一
导电性 导电 导电
主要用途 做钻石、制玻璃刀
做铅笔芯、电极、高温润滑剂
考点1 碳单质的物理性质和用途
金刚石 石墨
色、形、态 无色透明、正八面体形状的固体
深灰色的有金属光泽、不透明的细鳞片状固体
硬度 天然存在的最硬的物质
最软的矿物之一
导电性 不导电 易导电
主要用途 做钻石、制玻璃刀
做铅笔芯、电极、高温润滑剂
金刚石、石墨都是由碳元素组成的单质,为什么它们的物理性质差异那么大呢?
思考:
碳原子的排列方式不同
决定
决定
用墨书写或绘画
作
可燃性
还原性
化学性质
(O2不充足)
(O2充足)
考点2 碳单质的化学性质
化学性质 用途
单质碳 常温
高温
用墨书写或绘画
作燃料
冶炼金属
可燃性
还原性
化学性质不活泼
考点2 碳单质的化学性质
化学性质 用途
单质碳 常温
高温
色 味 体,固体为
色 味 体
比空气
比空气
溶于水
溶于水
能用 法
或 法收集
只能用 法收集
考点3 二氧化碳和一氧化碳的性质
CO2 CO
物理性质 颜色状态
密度
溶解性
收集方法
无色无味气体,固体为干冰
无色无味气体
比空气大
比空气略小
能溶于水
难溶于水
能用向上排空气法或排水法收集
只能用排水法收集
考点3 二氧化碳和一氧化碳的性质
CO2 CO
物理性质 颜色状态
密度
溶解性
收集方法
既不 也
不支持
无
无
无
无
考点3 二氧化碳和一氧化碳的性质
物质 一氧化碳 二氧化碳
化
学
性
质 可燃性
还原性
与水反应
与石灰水反应
毒性
既不燃烧也
不支持燃烧
无
无
H2O+CO2===H2CO3
无
Ca(OH)2+CO2===H2O+CaCO3↓
剧毒
无
考点3 二氧化碳和一氧化碳的性质
物质 一氧化碳 二氧化碳
化
学
性
质 可燃性
还原性
与水反应
与石灰水反应
毒性
碳和碳的化合物知识框架
碳和碳的化合物
2.可燃性
3.还原性
1 不能燃烧也不能支持燃烧
2.与水反应
3.与石灰水反应
4.与灼热的碳反应
1.可燃性
2.还原性
3.毒性
2.煅烧
CO2+H2O=H2CO3
CO2+Ca(OH)2=CaCO3↓+H2O
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
化学性质:
1、稳定性:常温下,碳的化学性质不活泼
标出C、CO、CO2、CaCO3、H2CO3 这五种物质的转换过程,并写出相应的化学方程式。
构建知识网络
构建知识网络
1.下列物质的性质与所对应的用途没有直接关系的是( )
?
A.石墨能导电﹣可作电极
?
B.二氧化碳用于灭火﹣能与水反应
?
C.活性炭用于净水﹣吸附性
D.金刚石用于裁玻璃﹣硬度大
?
课堂演练:
B
????????????????????????????????????? ???????????????????? ???????????????????????
2.下列有关二氧化碳的实验中,只能证明二氧化碳物理性质的是( )
课堂演练:
B
3.用化学方法鉴别二氧化碳和一氧化碳:
①分别点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
②分别倒入澄清石灰水,变浑浊的是二氧化碳,不变的是一氧化碳。
③分别滴入紫色的石蕊试液,变红的是二氧化碳,不变的是一氧化碳。
④分别通过灼热的氧化铜,使氧化铜黑色变为红色的是一氧化碳,另一种是二氧化碳。
课堂演练:
4.如果要除去CO2中少量的CO,应该采用的方法是 ( )
A.把混合气体点燃
B. 把混合气体通过灼热的氧化铜
C.把混合气体通过澄清石灰水
D. 把混合气体从一个容器倾倒到另一个容器
B
课堂演练:
课堂演练:
5. A、B、C、D、E五种物质,它们之间有下列转换关系:
A
D
B
E
C
E
(1)写出物质的名称 : A B C
D E
(2)实验室制二氧化碳的化学方程式
+氧化铜
石灰水
+水
+A
高温
煅烧
co2
CaCO3
H2CO3
c
CO
c
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
课堂演练:
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
