高一化学必修2第二章第二节 化学能和电能 课件 (共17张)
文档属性
| 名称 | 高一化学必修2第二章第二节 化学能和电能 课件 (共17张) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-30 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
化学能与电能
化学能与电能的转化
热能 机械能
原电池
化学能
燃烧 蒸汽 发电机
电能
【实验2-4】将锌片和铜片用带有电流表的导线连接,
插入到稀H2SO4中,观察现象。
现象:铜上有气泡,锌溶解,
电流表的指针发生偏转
结论:导线中有电流
1、原电池:把化学能转变为电能的装置.
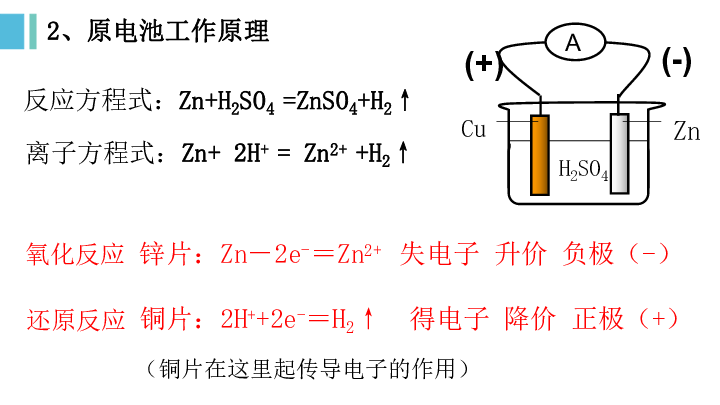
铜片:2H++2e-=H2↑ 得电子 降价 正极(+)
2、原电池工作原理
锌片:Zn-2e-=Zn2+ 失电子 升价 负极(-)
Cu
Zn
A
(+)
(-)
氧化反应
还原反应
H2SO4
反应方程式:Zn+H2SO4 =ZnSO4+H2↑
(铜片在这里起传导电子的作用)
离子方程式:Zn+ 2H+ = Zn2+ +H2↑
2、原电池工作原理
Cu
Zn
A
(+)
(-)
e-
电子移动方向
H+
SO42-
外电路:
内电路:阴离子移向负极
阳离子移向正极
负升失氧 锌片(-):Zn-2e-=Zn2+
正降得还 铜片(+):2H++2e-=H2↑
电流由正极流向负极
电子由负极流向正极
3、原电池构成条件
①两个电极(活泼性不同)
负极:较活泼的金属
正极:较不活泼的金属、或可以导电的非金属(石墨)
②电极在电解质溶液中构成闭合回路
③能自发地发生氧化还原反应
练习2:下列装置哪些可以形成原电池( )
A
A
A
A
A
A
A
Zn Cu
Fe C(石墨)
Zn Cu
Zn Zn
Fe 陶瓷
Fe Cu
Si C(石墨)
稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C D
Zn Cu
A
稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G H
ABC
4、判断原电池正、负极的方法
(1)两极材料
一般活泼的金属为负极
活泼性较弱金属或能导电的非金属为正极
(2)电流或电子流动
电流从正极流向负极,电子从负极流向正极
(3)根据原电池两极发生的变化来判断
?负极发生氧化反应,质量减少
?正极质量增加或有气泡
(4)溶液中离子移动方向
阳离子移向正极,阴离子移向负极
(5)原电池原理的应用
①制作化学电源
②加快反应速率:例如,实验室制H2时,由于锌太纯, 反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀,钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
小结
1、原电池:将化学能转化为电能的装置
2、工作原理:
负极:升失氧 正极:降得还
3、原电池构成条件
4、正、负极判断:通常活泼的为负极、较不活泼为正极
5、原电池的应用
如:判断金属活动性强弱、加快化学反应速率等
练习
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,
X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
C
请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,
负极 。
3、电极反应式 :
负极:
正极:
1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不
活泼的其他金属
拓 展:
Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu
第二节 化学能与电能
第二课时:发展中的电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
(1)干电池结构及电极反应原理
锌锰干电池构造
工作原理
负极:Zn-2e- ==Zn2+
正极:2NH4+ +2e- == 2NH3↑+H2↑
总反应:
Zn +2NH4+ ==Zn2++2NH3↑+H2↑
特点:
a:一次性电池,不可逆
b:用KOH代替NH4Cl能提高 性能,延长寿命
(2)充电电池(又称二次电池)
铅蓄电池
负极:Pb+SO42- -2e- ==PbSO4
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
正极:PbO2+4H++SO42-+2e-==PbSO4+2H2O
电池总反应式:
放电
充电
锂离子电池
(3)燃料电池
氢氧燃料电池
?电解质溶液为30%的KOH溶液.
正极: O2+ 4e + 2H2O === 4OH-
负极: 2H2–4e +4OH-=== 4H2O
总反应式: 2H2+O2==2H2O
?酸性氢氧燃料电池
正极: O2+ 4e+4H+ ===2H2O
负极: 2H2–4e ===4H+
总反应式: 2H2+O2==2H2O
燃料作电池负极,通过反应把化学能转化为电能
对比燃烧,提高了转化率,
比传统发电减少污染
写出甲烷燃料电池(电解质溶液为氢氧
化钾溶液)的电极反应式及总方程式:
正极:2O2 + 8e- + 4H2O === 8OH-
负极:CH4 + 10OH- -8e === CO32-+7H2O
总反应:CH4+2O2+2OH- === CO32-+3H2O
化学能与电能
化学能与电能的转化
热能 机械能
原电池
化学能
燃烧 蒸汽 发电机
电能
【实验2-4】将锌片和铜片用带有电流表的导线连接,
插入到稀H2SO4中,观察现象。
现象:铜上有气泡,锌溶解,
电流表的指针发生偏转
结论:导线中有电流
1、原电池:把化学能转变为电能的装置.
铜片:2H++2e-=H2↑ 得电子 降价 正极(+)
2、原电池工作原理
锌片:Zn-2e-=Zn2+ 失电子 升价 负极(-)
Cu
Zn
A
(+)
(-)
氧化反应
还原反应
H2SO4
反应方程式:Zn+H2SO4 =ZnSO4+H2↑
(铜片在这里起传导电子的作用)
离子方程式:Zn+ 2H+ = Zn2+ +H2↑
2、原电池工作原理
Cu
Zn
A
(+)
(-)
e-
电子移动方向
H+
SO42-
外电路:
内电路:阴离子移向负极
阳离子移向正极
负升失氧 锌片(-):Zn-2e-=Zn2+
正降得还 铜片(+):2H++2e-=H2↑
电流由正极流向负极
电子由负极流向正极
3、原电池构成条件
①两个电极(活泼性不同)
负极:较活泼的金属
正极:较不活泼的金属、或可以导电的非金属(石墨)
②电极在电解质溶液中构成闭合回路
③能自发地发生氧化还原反应
练习2:下列装置哪些可以形成原电池( )
A
A
A
A
A
A
A
Zn Cu
Fe C(石墨)
Zn Cu
Zn Zn
Fe 陶瓷
Fe Cu
Si C(石墨)
稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C D
Zn Cu
A
稀H2SO4 CuSO4溶液 酒精 稀H2SO4
E F G H
ABC
4、判断原电池正、负极的方法
(1)两极材料
一般活泼的金属为负极
活泼性较弱金属或能导电的非金属为正极
(2)电流或电子流动
电流从正极流向负极,电子从负极流向正极
(3)根据原电池两极发生的变化来判断
?负极发生氧化反应,质量减少
?正极质量增加或有气泡
(4)溶液中离子移动方向
阳离子移向正极,阴离子移向负极
(5)原电池原理的应用
①制作化学电源
②加快反应速率:例如,实验室制H2时,由于锌太纯, 反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀,钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
小结
1、原电池:将化学能转化为电能的装置
2、工作原理:
负极:升失氧 正极:降得还
3、原电池构成条件
4、正、负极判断:通常活泼的为负极、较不活泼为正极
5、原电池的应用
如:判断金属活动性强弱、加快化学反应速率等
练习
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,
X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
(A)X>Y>Z (B)X>Z>Y
(C)Y>X>Z (D)Y>Z>X
C
请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。
1、电解液: 。
2、电极材料:
正极 ,
负极 。
3、电极反应式 :
负极:
正极:
1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不
活泼的其他金属
拓 展:
Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu
第二节 化学能与电能
第二课时:发展中的电源
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
(1)干电池结构及电极反应原理
锌锰干电池构造
工作原理
负极:Zn-2e- ==Zn2+
正极:2NH4+ +2e- == 2NH3↑+H2↑
总反应:
Zn +2NH4+ ==Zn2++2NH3↑+H2↑
特点:
a:一次性电池,不可逆
b:用KOH代替NH4Cl能提高 性能,延长寿命
(2)充电电池(又称二次电池)
铅蓄电池
负极:Pb+SO42- -2e- ==PbSO4
Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
正极:PbO2+4H++SO42-+2e-==PbSO4+2H2O
电池总反应式:
放电
充电
锂离子电池
(3)燃料电池
氢氧燃料电池
?电解质溶液为30%的KOH溶液.
正极: O2+ 4e + 2H2O === 4OH-
负极: 2H2–4e +4OH-=== 4H2O
总反应式: 2H2+O2==2H2O
?酸性氢氧燃料电池
正极: O2+ 4e+4H+ ===2H2O
负极: 2H2–4e ===4H+
总反应式: 2H2+O2==2H2O
燃料作电池负极,通过反应把化学能转化为电能
对比燃烧,提高了转化率,
比传统发电减少污染
写出甲烷燃料电池(电解质溶液为氢氧
化钾溶液)的电极反应式及总方程式:
正极:2O2 + 8e- + 4H2O === 8OH-
负极:CH4 + 10OH- -8e === CO32-+7H2O
总反应:CH4+2O2+2OH- === CO32-+3H2O
