人教版高中化学人教版必修二课件--3.3.1 乙醇(共32张ppt)
文档属性
| 名称 | 人教版高中化学人教版必修二课件--3.3.1 乙醇(共32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-30 00:00:00 | ||
图片预览








文档简介
(共32张PPT)
明月几时有?
把酒问青天
乙醇
生活中两种常见的有机物
!
中国具有悠久的酒文化,请说出一些有关酒的著名诗句、谚语:
感知生活
抽刀断水水更流,举杯消愁愁更愁。
劝君更尽一杯酒,西出阳关无故人。
酒后吐真言! 酒香不怕巷子深!
酒逢知己千杯少,话不投机半句多。
酒不醉人人自醉,色不迷人人自迷!
美酒穿肠过,我佛留心中
为什么有的人“千杯万盏皆不醉”,而有的人则“沉醉不知归路,熟睡不解残酒” ?
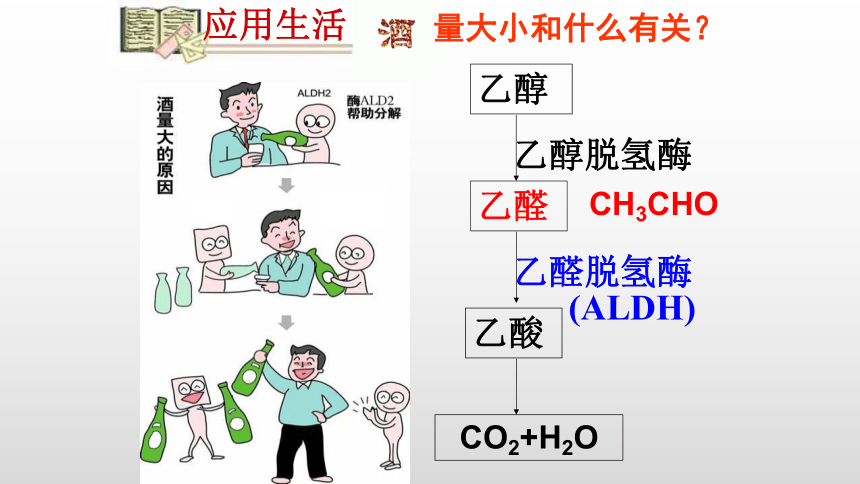
量大小和什么有关
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2+H2O
CH3CHO
乙醛脱氢酶
(ALDH)
应用生活
量大小和什么有关?
人饮酒后,酒精经过胃和肠的吸收,通过血液送到肝脏和其它组织中。酒精的代谢主要是在肝脏内进行的。乙醛对人体的刺激作用比乙醇要强几百倍,乙醛的积蓄会引起脸红、心跳、头晕、呕吐等症状。但是一个人体内的ALDH的多少是先天性的,与遗传因素有关,不能通过多喝酒而逐渐增多,所以也不能通过经常饮酒的“锻炼”而把酒量练大。
人的酒量不是练出来的
无色透明
特殊香味
液体
比水小
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发
酒精度56度
气 味:
颜 色:
溶解性:
密 度:
挥发性:
状 态:
乙醇的物理性质
感知生活
结合生活经验,谈谈你对酒精的认识
【理论探究】
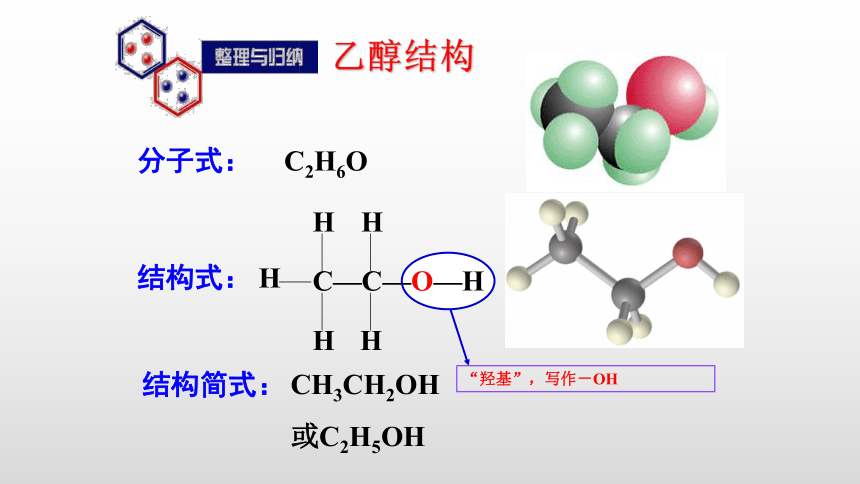
初中时我们已经学习过乙醇的分子式为 ,请同学们根据已学知识来推断出乙醇的结构式。
C2H6O
乙烯和水在一定条件下发生加成反应生成乙醇
CH2=CH2+H2O CH3CH2OH
一定条件
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
“羟基”,写作-OH
分子式:
乙醇结构
C2H6O
结构简式:
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物。
像这样烃分子中的H原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
乙醇分子结构
C—C—O—H
H
H
H
H
H
C—C—H
H
H
H
H
H
CH3CH2Cl
CH2Cl2
CH3COOH
烃的衍生物:
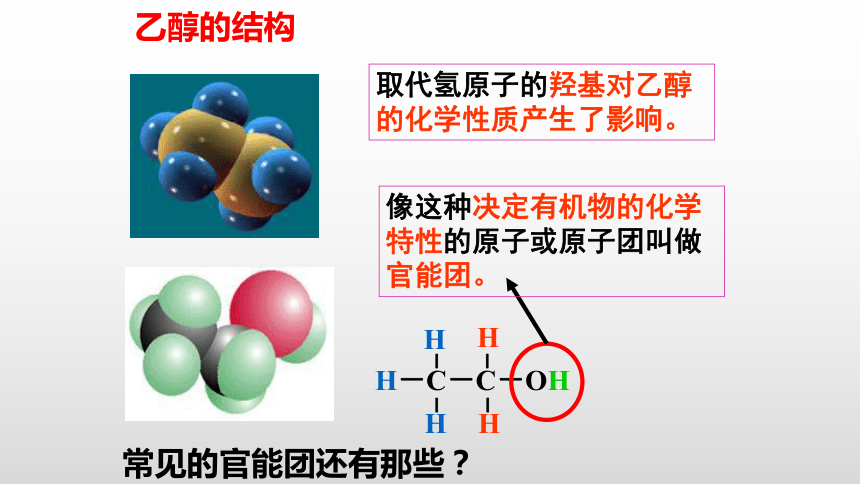
乙醇的结构
取代氢原子的羟基对乙醇的化学性质产生了影响。
H-C-C-OH
-
H
-
-
-
H
H
H
像这种决定有机物的化学特性的原子或原子团叫做官能团。
常见的官能团还有那些?
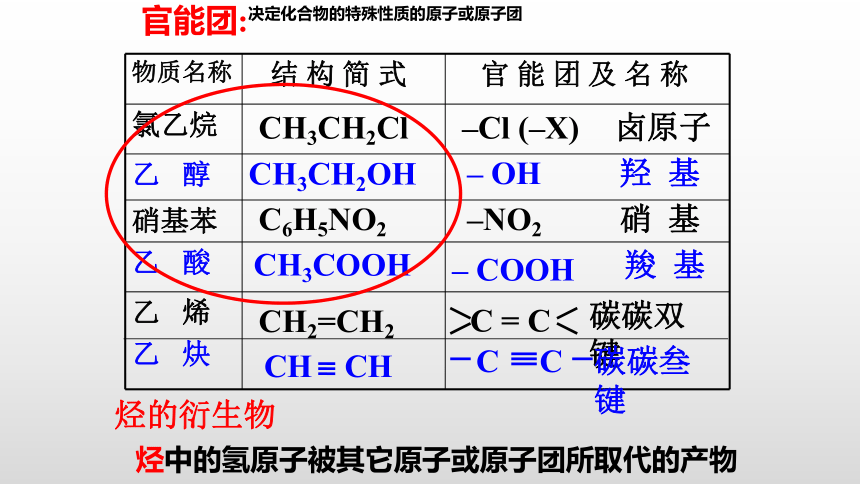
物质名称 结 构 简 式 官 能 团 及 名 称
氯乙烷
乙 醇
硝基苯
乙 酸
乙 烯
乙 炔
CH3CH2Cl
–Cl (–X)
卤原子
CH3CH2OH
– OH
羟 基
C6H5NO2
–NO2
硝 基
CH3COOH
– COOH
羧 基
CH2=CH2
CH CH
C = C
C C
碳碳双键
碳碳叁键
烃的衍生物
烃中的氢原子被其它原子或原子团所取代的产物
官能团:
决定化合物的特殊性质的原子或原子团
回顾:Na的保存
Na保存在煤油或石蜡油中
(煤油、石蜡油均属于液态烃类混合物)
Na不与烃发生反应
Na能否与乙醇发生反应??
C—C—O—H
H
H
H
H
H
C—C—H
H
H
H
H
H
乙醇与Na反应也产生H2
[实验3-2]乙醇与金属钠的反应
现象: 试管中有气体生成,可以燃烧,烧杯内壁出现水滴,石灰水不变浑浊。
说明乙醇分子中有类似于水的结构:
C—C—O—H
H
H
H
H
H
H—O—H
练习:P76第3题
回顾:
钠与水反应的化学方程式?
试写出钠与乙醇反应的化学方程式。
2HOH + 2Na = 2NaOH + H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
H—C —C—O—H
H H
H H
①处O—H键断开
①
1、羟基决定乙醇能和钠反应生成H2
2mol—OH 1mol H2
结论:
官能团
练习:P76第2题
H―O―H
【对比思考、探究】
乙 醇 水 煤 油
结构式 C-H 、O-H
含C11~C16 的烃 (只含C-C、C-H)
结论2.水与钠反应比乙醇与钠反应剧烈,说明水中的
O—H比乙醇中的O-H键更______(容易/难)断裂。
H2O中的H原子更加 。(活泼/不活泼)
容易
结论1.乙醇与钠发生反应断_____(C-H/O-H ),说明O-H比C-H更加 。(活泼/不活泼)
活泼
活泼
O-H
(三) 乙醇的化学性质
1、乙醇与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
[练习]其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2 ,请写出镁与乙醇反应的化学方程式。
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
(置换反应)
2CO2 +3H2O
C2H5OH + 3 O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
2、乙醇的氧化反应(1)— 乙醇燃烧
[知识拓展]
乙醇燃烧产物清洁,无污染,所以乙醇除了用于食品加工业以外另一重要用途就是作燃料使用。
各地汽车成“酒鬼” ?
(彻底氧化)
null
高温焊接银器、铜器时,表面会生成黑色的氧化物,师傅说,可以先把铜、银器具,趁热蘸一下酒精,铜银会光亮如初!你能解释原因吗?
乙醇催化氧化
探究 ·活动
---- 乙醇的催化氧化
(2)点燃酒精灯,拿一根洁净10~15cm长的铜丝,下端绕成螺旋状,在酒精灯的外焰上灼烧。
(3)待铜丝变黑后,把灼热的铜丝放入盛有乙醇的试管中。
(4)重复上述步骤2-3次,观察铜丝变化并闻液体的气味。
乙醇的性质
(1)取3mL-5mL乙醇的试管中,闻气味。
乙醇的催化氧化
1、在酒精灯上加热时铜丝由红色变黑,插入乙醇后铜丝又由黑变红色。
2、试管中液体有刺激性气味。
铜丝
红
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
分析:发生反应 2Cu+O2=2CuO
分析:生成新的物质—乙醛
CuO+CH3CH2OH Cu +CH3CHO+H2O
催化剂
现象及原因探究
中间产物
Cu
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
乙醛
2Cu+O2 2CuO
催化剂
乙 醛
2.乙醇的催化氧化
CuO+ CH3CH2OH Cu+ CH3CHO+ H2O
2
2
2
2
2
Cu或Ag
醇催氧化过程:
去H氧化规律:去掉—OH上的H和—OH所在的碳原子上H
null
你能解释原因了吗?
乙醇催化氧化的应用
CH3CH2OH CH3COOH
酸性高锰酸钾溶液或
酸性重铬酸溶液
紫色的酸性高锰酸钾溶液褪色
酸性重铬酸溶液由橙色变为绿色,判定司机饮酒超标。
3.被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
K2Cr2O7 + C2H5OH +H2SO4 ━Cr2(SO4)3 +CH3COOH +K2SO4+H2O
(橙色) (绿色)
K2Cr2O7
Cr2(SO4)3
(橙色)
(绿色)
注意:喝酒莫开车,
开车莫喝酒!
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
思考与交流
针对下图所示乙醇分子结构,乙醇与金属钠反应时, ___键断裂;乙醇在铜催化下与氧气反应时,________键断裂。
H H
︳ ︳
H-C-C-O-H
︳ ︳3
H H
←
↓
↓
↓
1,3
1
4
2 1
羟基(-OH)与乙醇的化学性质密切相关。
1.乙醇+钠—H2(置换)
2.乙醇的氧化反应(还原性)
(1).燃烧——CO2+H2O
(2).催化氧化——乙醛
(3).被高锰酸钾或重铬酸钾氧化成——乙酸
乙醇的性质
决定
体现
体现
结构 性质 用途
决定
喝酒的利弊
酗酒
过量
适量
助消化
活血,散寒,除疲劳
损伤肝脏
损伤大脑
猝死
致癌
乙醇的应用
课后习题
1、2、3、4
作业:8
明月几时有?
把酒问青天
乙醇
生活中两种常见的有机物
!
中国具有悠久的酒文化,请说出一些有关酒的著名诗句、谚语:
感知生活
抽刀断水水更流,举杯消愁愁更愁。
劝君更尽一杯酒,西出阳关无故人。
酒后吐真言! 酒香不怕巷子深!
酒逢知己千杯少,话不投机半句多。
酒不醉人人自醉,色不迷人人自迷!
美酒穿肠过,我佛留心中
为什么有的人“千杯万盏皆不醉”,而有的人则“沉醉不知归路,熟睡不解残酒” ?
量大小和什么有关
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2+H2O
CH3CHO
乙醛脱氢酶
(ALDH)
应用生活
量大小和什么有关?
人饮酒后,酒精经过胃和肠的吸收,通过血液送到肝脏和其它组织中。酒精的代谢主要是在肝脏内进行的。乙醛对人体的刺激作用比乙醇要强几百倍,乙醛的积蓄会引起脸红、心跳、头晕、呕吐等症状。但是一个人体内的ALDH的多少是先天性的,与遗传因素有关,不能通过多喝酒而逐渐增多,所以也不能通过经常饮酒的“锻炼”而把酒量练大。
人的酒量不是练出来的
无色透明
特殊香味
液体
比水小
跟水以任意比互溶
能够溶解多种无机物和有机物
易挥发
酒精度56度
气 味:
颜 色:
溶解性:
密 度:
挥发性:
状 态:
乙醇的物理性质
感知生活
结合生活经验,谈谈你对酒精的认识
【理论探究】
初中时我们已经学习过乙醇的分子式为 ,请同学们根据已学知识来推断出乙醇的结构式。
C2H6O
乙烯和水在一定条件下发生加成反应生成乙醇
CH2=CH2+H2O CH3CH2OH
一定条件
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
“羟基”,写作-OH
分子式:
乙醇结构
C2H6O
结构简式:
乙醇分子可以看作是乙烷分子里的一个氢原子被羟基所取代的产物。
像这样烃分子中的H原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
乙醇分子结构
C—C—O—H
H
H
H
H
H
C—C—H
H
H
H
H
H
CH3CH2Cl
CH2Cl2
CH3COOH
烃的衍生物:
乙醇的结构
取代氢原子的羟基对乙醇的化学性质产生了影响。
H-C-C-OH
-
H
-
-
-
H
H
H
像这种决定有机物的化学特性的原子或原子团叫做官能团。
常见的官能团还有那些?
物质名称 结 构 简 式 官 能 团 及 名 称
氯乙烷
乙 醇
硝基苯
乙 酸
乙 烯
乙 炔
CH3CH2Cl
–Cl (–X)
卤原子
CH3CH2OH
– OH
羟 基
C6H5NO2
–NO2
硝 基
CH3COOH
– COOH
羧 基
CH2=CH2
CH CH
C = C
C C
碳碳双键
碳碳叁键
烃的衍生物
烃中的氢原子被其它原子或原子团所取代的产物
官能团:
决定化合物的特殊性质的原子或原子团
回顾:Na的保存
Na保存在煤油或石蜡油中
(煤油、石蜡油均属于液态烃类混合物)
Na不与烃发生反应
Na能否与乙醇发生反应??
C—C—O—H
H
H
H
H
H
C—C—H
H
H
H
H
H
乙醇与Na反应也产生H2
[实验3-2]乙醇与金属钠的反应
现象: 试管中有气体生成,可以燃烧,烧杯内壁出现水滴,石灰水不变浑浊。
说明乙醇分子中有类似于水的结构:
C—C—O—H
H
H
H
H
H
H—O—H
练习:P76第3题
回顾:
钠与水反应的化学方程式?
试写出钠与乙醇反应的化学方程式。
2HOH + 2Na = 2NaOH + H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
H—C —C—O—H
H H
H H
①处O—H键断开
①
1、羟基决定乙醇能和钠反应生成H2
2mol—OH 1mol H2
结论:
官能团
练习:P76第2题
H―O―H
【对比思考、探究】
乙 醇 水 煤 油
结构式 C-H 、O-H
含C11~C16 的烃 (只含C-C、C-H)
结论2.水与钠反应比乙醇与钠反应剧烈,说明水中的
O—H比乙醇中的O-H键更______(容易/难)断裂。
H2O中的H原子更加 。(活泼/不活泼)
容易
结论1.乙醇与钠发生反应断_____(C-H/O-H ),说明O-H比C-H更加 。(活泼/不活泼)
活泼
活泼
O-H
(三) 乙醇的化学性质
1、乙醇与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
[练习]其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2 ,请写出镁与乙醇反应的化学方程式。
H—C —C—O—H ,
H H
H H
①处O—H
键断开
①
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
乙醇镁
(置换反应)
2CO2 +3H2O
C2H5OH + 3 O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
2、乙醇的氧化反应(1)— 乙醇燃烧
[知识拓展]
乙醇燃烧产物清洁,无污染,所以乙醇除了用于食品加工业以外另一重要用途就是作燃料使用。
各地汽车成“酒鬼” ?
(彻底氧化)
null
高温焊接银器、铜器时,表面会生成黑色的氧化物,师傅说,可以先把铜、银器具,趁热蘸一下酒精,铜银会光亮如初!你能解释原因吗?
乙醇催化氧化
探究 ·活动
---- 乙醇的催化氧化
(2)点燃酒精灯,拿一根洁净10~15cm长的铜丝,下端绕成螺旋状,在酒精灯的外焰上灼烧。
(3)待铜丝变黑后,把灼热的铜丝放入盛有乙醇的试管中。
(4)重复上述步骤2-3次,观察铜丝变化并闻液体的气味。
乙醇的性质
(1)取3mL-5mL乙醇的试管中,闻气味。
乙醇的催化氧化
1、在酒精灯上加热时铜丝由红色变黑,插入乙醇后铜丝又由黑变红色。
2、试管中液体有刺激性气味。
铜丝
红
Δ
变黑
有刺激性气味
插入乙醇溶液中
又变红
Cu
Δ
CuO
乙醛CH3CHO
插入乙醇溶液中
Cu
分析:发生反应 2Cu+O2=2CuO
分析:生成新的物质—乙醛
CuO+CH3CH2OH Cu +CH3CHO+H2O
催化剂
现象及原因探究
中间产物
Cu
2CH3CH2OH+O2 2CH3CHO+2H2O
乙醛
乙醛
2Cu+O2 2CuO
催化剂
乙 醛
2.乙醇的催化氧化
CuO+ CH3CH2OH Cu+ CH3CHO+ H2O
2
2
2
2
2
Cu或Ag
醇催氧化过程:
去H氧化规律:去掉—OH上的H和—OH所在的碳原子上H
null
你能解释原因了吗?
乙醇催化氧化的应用
CH3CH2OH CH3COOH
酸性高锰酸钾溶液或
酸性重铬酸溶液
紫色的酸性高锰酸钾溶液褪色
酸性重铬酸溶液由橙色变为绿色,判定司机饮酒超标。
3.被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
K2Cr2O7 + C2H5OH +H2SO4 ━Cr2(SO4)3 +CH3COOH +K2SO4+H2O
(橙色) (绿色)
K2Cr2O7
Cr2(SO4)3
(橙色)
(绿色)
注意:喝酒莫开车,
开车莫喝酒!
世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。
思考与交流
针对下图所示乙醇分子结构,乙醇与金属钠反应时, ___键断裂;乙醇在铜催化下与氧气反应时,________键断裂。
H H
︳ ︳
H-C-C-O-H
︳ ︳3
H H
←
↓
↓
↓
1,3
1
4
2 1
羟基(-OH)与乙醇的化学性质密切相关。
1.乙醇+钠—H2(置换)
2.乙醇的氧化反应(还原性)
(1).燃烧——CO2+H2O
(2).催化氧化——乙醛
(3).被高锰酸钾或重铬酸钾氧化成——乙酸
乙醇的性质
决定
体现
体现
结构 性质 用途
决定
喝酒的利弊
酗酒
过量
适量
助消化
活血,散寒,除疲劳
损伤肝脏
损伤大脑
猝死
致癌
乙醇的应用
课后习题
1、2、3、4
作业:8
