高一化学人教版化学必修二1.2元素周期律 课件 (共38张ppt)
文档属性
| 名称 | 高一化学人教版化学必修二1.2元素周期律 课件 (共38张ppt) | 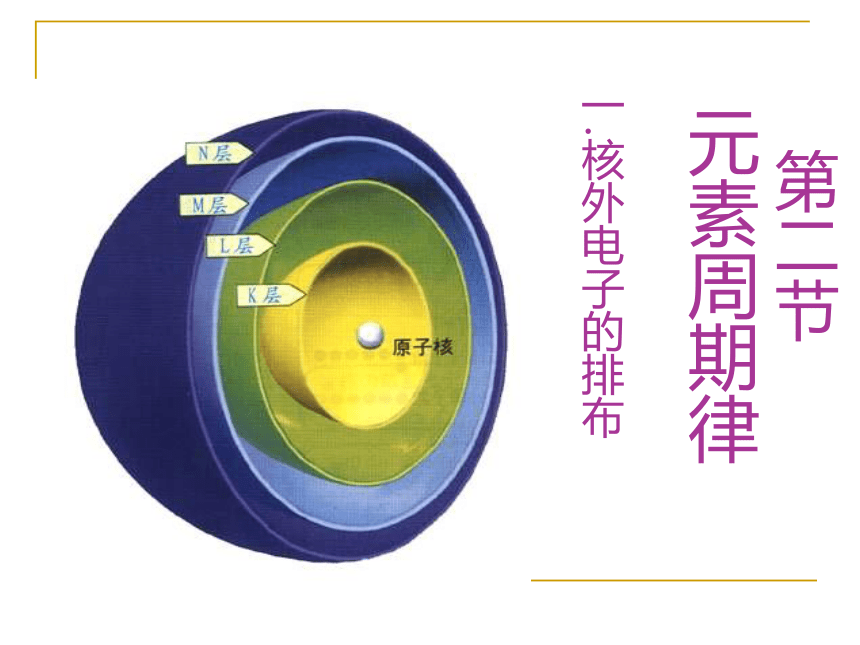 | |
| 格式 | zip | ||
| 文件大小 | 440.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-30 21:56:37 | ||
图片预览











文档简介
课件38张PPT。 第二节
元素周期律
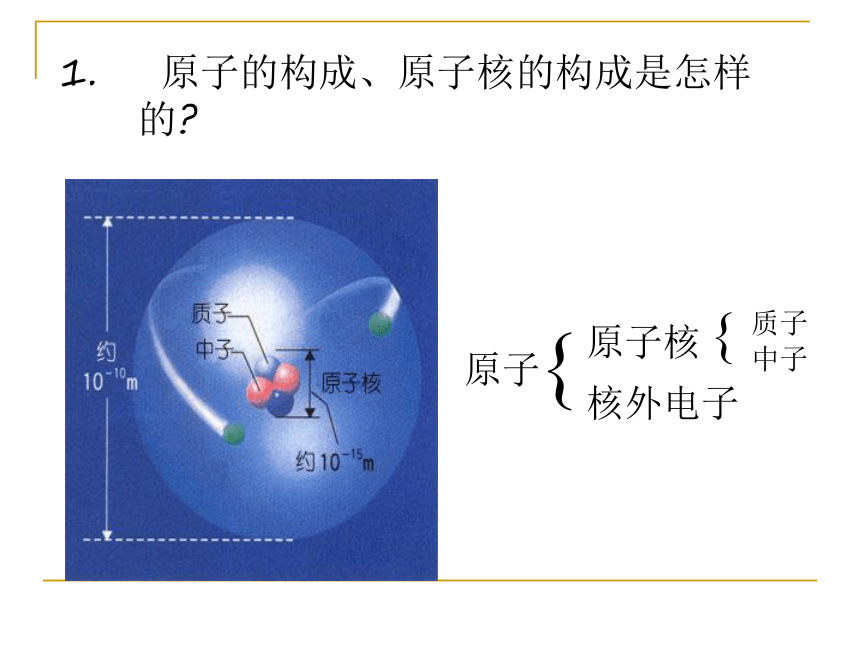
一.核外电子的排布1. 原子的构成、原子核的构成是怎样的?2. 质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电 在含有多个电子的原子里,电子的能量是不同的。有些电子能量较低,在离核较近的区域里运动;有些电子能量较高,在离核较远的区域里运动。
问题:在多个电子的原子里,电子是如 何运动的? 科学上把能量不同的电子的运动区域称为电子层。把能量最低、离核最近的电子,称其运动在第一电子层上;能量稍高、运动在离核稍远的电子,称其运动在第二电子层上;有里向外,依次类推,叫三、四、五、六、七层。 也可把它们依次叫K、L、M、N、O、P、Q层。
电子层数(n):
n=1,2, 3,4,5,6,7
K,L,M,N,O,P,Q
n越大,电子离核越远,其能量也越高
⑶核外电子是分层排布的。
⑷电子一般总是尽先排布在能量最低的电子层里,即最先排布K层;当K层排满后,再排布L层;当L层排满后,再排布M层;……
那么,每个电子层最多可以排布多少个电子?
首先研究一下1-20号元素原子电子层排布的情况(观察课本12页至13页的表格)找出规律)?第二步:研究稀有气体的核外电子排布?稀有气体元素原子电子层排布 从表中可看出,K层、L层、M层最多能排布的电子数目?
??K-2,L-8,M-188个(氦原子是2个)最外层电子数最多有几个? 试推断各电子层最多能容纳的电子数和电子层数之间有什么关系??次外层不超过多少个?倒数第三层呢?原子核外电子的排布规律:
各电子层最多容纳的电子数是2n2(n表示电子层);
最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数目不超过18个,倒数第三层不超过32个;
核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。注:以上规律是相互联系的,不能孤立地机械地套用根据原子的核电荷数和电子层的排布规律,画出原子结构图:
请指出元素符号原子核核内质子电子层层内电子数1、判断下列示意图是否正确?为什么?
A、 B、
C、 D、
2、根据核外电子排布规律,画出下列元素原子的结构示意图。
(1)3Li、11Na、19K、37Rb、55Cs
(2)9F、17Cl、35Br、53I
3、某元素的原子核外有3个电子层,最外层有5个电子,该原子核内的质子数为( )
A、14 B、15 C、16 D、17
4、某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是( )
A、Li B、Si C、Al D、KBB5、与OH-具有相同质子数和电子数的微粒是( )
A、F- B、NH3 C、H2O D、Na+
6、 C-NMR(核磁共振)可以用于含碳化合物的结构分析, C表示的碳原子( )
A、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,原子序数为6,核内有7个质子
D、质量数为13,原子序数为6,核内有7个中子
AD7、下列四组物质中,不具有相同核外电子总数的两种分子是( )
A、H2O2和CH3OH B、HNO2和HClO
C、H2O和CH4 D、H2S和F2
8、两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有( )
A、1对 B、2对 C、3对 D、4对
BB本课小结:原子核外电子运动的特征:
运动速度快、没有确定的轨道,可用电子云形象地表示
原子核外电子排布:
电子层的划分
核外电子的排布规律各电子层最多容纳的电子数是2n2个(n表示电子层);
最外层电子数不超过8个(K层是最外层,最多不超过2个);次外层电子数目不超过18个,倒数第三层不超过32个;
核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布(即排满K层,排满L层才排M层)第二节 元素周期律 (第2课时)第二节:元素周期律小结
1、随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。(由1-8)
2、随着原子序数的递增,元素原子半径呈现周期性变化。
3、着原子序数的递增,元素的化合价呈周期性变化(+1- +7,-4 —-1)。
4、元素的金属性,指元素的原子失去电子的能力;元素的非金属性,指元素的原子得到电子的能力。
金属性强(弱)——单质与水反应或酸反应生成氢气 容易(难),氢氧化物的碱性强(弱)。
非金属性强(弱)——单质与氢气易(难)反应,生成的氢化物稳定(不稳定),氧化物的水化物酸性强(弱)。(1)金属元素(2)非金属元素1.最高价氧化物及其水化物的化学式、非金属气态氢化物的化学式的通式总结如下(R表示元素符号) 最高价氧化物 R2O RO R2O3 RO2 R2O5 RO3 R2 最高价氧化物的水化物 ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4 气态氢化物 RH4 RH3 H2R HR 注:由于C、N的原子半径小故最高价氧化物的水化物的化学式分别H2CO3和HNO3 3、气态氢化物及最高价氧化物的水化物化学式的写法1.? 判断元素金属性,非金属性强弱的方法
金属性:
(1)单质与水或酸的反应产生H2的难易,越易,金属性越强
(2)氧化物的水化物碱性强弱,碱性越强,金属性越强
(3)单质的还原性(或离子的氧化性)
(4)置换反应,活泼金属置换不活泼金属
非金属性:
(1)与氢气反应生成气态氢化物难易(或气态氢化 物的稳定性强弱),与氢气反应越容易(气态氢化物稳定性越强)非金属性越强,
(2)最高价氧化物的水化物酸性强弱,酸性越强,非金属性越 强
(3)单质的氧化性(或离子还原性),单质氧化性越强(或离子还原性越强)非金属性越强
(4)置换反应,活泼非金属置换不活泼非金属
典型例题 1、下列叙述中肯定A金属比B金属的活泼性强的是(???? ????? )
(A)A原子的最外层电子数比B原子的最外层电子数少
(B)A原子的电子层数比B原子的电子层数多
(C)1molA从酸中置换出H+生成的H2比1molB从酸中置换出H+生成的H2多
(D)常温时,A能从水中置换出氢,而B不能D元素周期律第三课时同一周期元素金属性和非金属变化非金属性逐渐增强,金属性逐渐减弱非金属性逐渐减弱,金属性逐渐增强元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强返回子菜单化合价a.原子半径c.氧化、还原性b.离子半径f.金属、非金属性d.阳离子氧化性e.阴离子还原性1、同周期元素的性质变化规律(第三周期)h.最高氧化物R对应水化物酸性、碱性g.气态氢化物稳定性(递增)(递减)2、同主族的元素的性质(第ⅠA、ⅦA族)a.原子半径c.氧化、还原性b.离子半径f.金属、非金属性d.阳离子氧化性e.阴离子还原性h.最高氧化物R对应水化物酸性、碱性g.气态氢化物稳定性(递增)(递减)金 属 最 强金属与非金属分界线附近的元素既表现出一定的金属性也表现出一定的非金属性。周期序数等于主族序数的元素具有两性.
Al(OH)3+H+ = Al(OH)3+OH- = .Al 2O3+H+ = Al 2O3 +OH- = .B特殊知识点找元素之最最活泼金属 、最活泼非金属
最轻的金属 、最轻的非金属
最高熔沸点是 、最低熔沸点是
最稳定的气态氢化物 ,含H%最大的是
最强酸 、最强碱
地壳中含量最多的金属和非金属找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhAl O氟里昂的发现与元素周期表1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟里昂,简称F12)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。氟里昂的发现与元素周期表在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。氟里昂的发现与元素周期表米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。
80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。返回子菜单例1(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式表示为
A. XY B. XY2 C. XY3 D. X2Y3
A. 例2(97)铍的原子序数为4,下列叙述正确的是 A.铍的原子半径大于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8 C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气A.C比较微粒的半径大小1、同周期元素的原子或离子2、同主族元素的原子或离子3、相同电子层结构的离子4、同一元素的原子与离子Na、Mg、AlCl-、S2-、P3-F- 、Cl-、Br-、I-Li、Na、K、RbO2-、F- 、Na+、Mg2+、Al3+Cl 、Cl-、 Mg2+、Mg、
元素周期律
一.核外电子的排布1. 原子的构成、原子核的构成是怎样的?2. 质子、中子、电子的电性和电量怎样?1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电 在含有多个电子的原子里,电子的能量是不同的。有些电子能量较低,在离核较近的区域里运动;有些电子能量较高,在离核较远的区域里运动。
问题:在多个电子的原子里,电子是如 何运动的? 科学上把能量不同的电子的运动区域称为电子层。把能量最低、离核最近的电子,称其运动在第一电子层上;能量稍高、运动在离核稍远的电子,称其运动在第二电子层上;有里向外,依次类推,叫三、四、五、六、七层。 也可把它们依次叫K、L、M、N、O、P、Q层。
电子层数(n):
n=1,2, 3,4,5,6,7
K,L,M,N,O,P,Q
n越大,电子离核越远,其能量也越高
⑶核外电子是分层排布的。
⑷电子一般总是尽先排布在能量最低的电子层里,即最先排布K层;当K层排满后,再排布L层;当L层排满后,再排布M层;……
那么,每个电子层最多可以排布多少个电子?
首先研究一下1-20号元素原子电子层排布的情况(观察课本12页至13页的表格)找出规律)?第二步:研究稀有气体的核外电子排布?稀有气体元素原子电子层排布 从表中可看出,K层、L层、M层最多能排布的电子数目?
??K-2,L-8,M-188个(氦原子是2个)最外层电子数最多有几个? 试推断各电子层最多能容纳的电子数和电子层数之间有什么关系??次外层不超过多少个?倒数第三层呢?原子核外电子的排布规律:
各电子层最多容纳的电子数是2n2(n表示电子层);
最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数目不超过18个,倒数第三层不超过32个;
核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。注:以上规律是相互联系的,不能孤立地机械地套用根据原子的核电荷数和电子层的排布规律,画出原子结构图:
请指出元素符号原子核核内质子电子层层内电子数1、判断下列示意图是否正确?为什么?
A、 B、
C、 D、
2、根据核外电子排布规律,画出下列元素原子的结构示意图。
(1)3Li、11Na、19K、37Rb、55Cs
(2)9F、17Cl、35Br、53I
3、某元素的原子核外有3个电子层,最外层有5个电子,该原子核内的质子数为( )
A、14 B、15 C、16 D、17
4、某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是( )
A、Li B、Si C、Al D、KBB5、与OH-具有相同质子数和电子数的微粒是( )
A、F- B、NH3 C、H2O D、Na+
6、 C-NMR(核磁共振)可以用于含碳化合物的结构分析, C表示的碳原子( )
A、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,原子序数为6,核内有7个质子
D、质量数为13,原子序数为6,核内有7个中子
AD7、下列四组物质中,不具有相同核外电子总数的两种分子是( )
A、H2O2和CH3OH B、HNO2和HClO
C、H2O和CH4 D、H2S和F2
8、两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有( )
A、1对 B、2对 C、3对 D、4对
BB本课小结:原子核外电子运动的特征:
运动速度快、没有确定的轨道,可用电子云形象地表示
原子核外电子排布:
电子层的划分
核外电子的排布规律各电子层最多容纳的电子数是2n2个(n表示电子层);
最外层电子数不超过8个(K层是最外层,最多不超过2个);次外层电子数目不超过18个,倒数第三层不超过32个;
核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布(即排满K层,排满L层才排M层)第二节 元素周期律 (第2课时)第二节:元素周期律小结
1、随着原子序数的递增,元素原子的最外层电子排布呈现周期性变化。(由1-8)
2、随着原子序数的递增,元素原子半径呈现周期性变化。
3、着原子序数的递增,元素的化合价呈周期性变化(+1- +7,-4 —-1)。
4、元素的金属性,指元素的原子失去电子的能力;元素的非金属性,指元素的原子得到电子的能力。
金属性强(弱)——单质与水反应或酸反应生成氢气 容易(难),氢氧化物的碱性强(弱)。
非金属性强(弱)——单质与氢气易(难)反应,生成的氢化物稳定(不稳定),氧化物的水化物酸性强(弱)。(1)金属元素(2)非金属元素1.最高价氧化物及其水化物的化学式、非金属气态氢化物的化学式的通式总结如下(R表示元素符号) 最高价氧化物 R2O RO R2O3 RO2 R2O5 RO3 R2 最高价氧化物的水化物 ROH R(OH)2 R(OH)3 H4RO4 H3RO4 H2RO4 HRO4 气态氢化物 RH4 RH3 H2R HR 注:由于C、N的原子半径小故最高价氧化物的水化物的化学式分别H2CO3和HNO3 3、气态氢化物及最高价氧化物的水化物化学式的写法1.? 判断元素金属性,非金属性强弱的方法
金属性:
(1)单质与水或酸的反应产生H2的难易,越易,金属性越强
(2)氧化物的水化物碱性强弱,碱性越强,金属性越强
(3)单质的还原性(或离子的氧化性)
(4)置换反应,活泼金属置换不活泼金属
非金属性:
(1)与氢气反应生成气态氢化物难易(或气态氢化 物的稳定性强弱),与氢气反应越容易(气态氢化物稳定性越强)非金属性越强,
(2)最高价氧化物的水化物酸性强弱,酸性越强,非金属性越 强
(3)单质的氧化性(或离子还原性),单质氧化性越强(或离子还原性越强)非金属性越强
(4)置换反应,活泼非金属置换不活泼非金属
典型例题 1、下列叙述中肯定A金属比B金属的活泼性强的是(???? ????? )
(A)A原子的最外层电子数比B原子的最外层电子数少
(B)A原子的电子层数比B原子的电子层数多
(C)1molA从酸中置换出H+生成的H2比1molB从酸中置换出H+生成的H2多
(D)常温时,A能从水中置换出氢,而B不能D元素周期律第三课时同一周期元素金属性和非金属变化非金属性逐渐增强,金属性逐渐减弱非金属性逐渐减弱,金属性逐渐增强元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强返回子菜单化合价a.原子半径c.氧化、还原性b.离子半径f.金属、非金属性d.阳离子氧化性e.阴离子还原性1、同周期元素的性质变化规律(第三周期)h.最高氧化物R对应水化物酸性、碱性g.气态氢化物稳定性(递增)(递减)2、同主族的元素的性质(第ⅠA、ⅦA族)a.原子半径c.氧化、还原性b.离子半径f.金属、非金属性d.阳离子氧化性e.阴离子还原性h.最高氧化物R对应水化物酸性、碱性g.气态氢化物稳定性(递增)(递减)金 属 最 强金属与非金属分界线附近的元素既表现出一定的金属性也表现出一定的非金属性。周期序数等于主族序数的元素具有两性.
Al(OH)3+H+ = Al(OH)3+OH- = .Al 2O3+H+ = Al 2O3 +OH- = .B特殊知识点找元素之最最活泼金属 、最活泼非金属
最轻的金属 、最轻的非金属
最高熔沸点是 、最低熔沸点是
最稳定的气态氢化物 ,含H%最大的是
最强酸 、最强碱
地壳中含量最多的金属和非金属找半导体:在“折线”附近 Si Ge Ga
找农药: 在磷附近 P As S Cl F
找催化剂、耐高温、耐腐蚀材料:
过渡元素 Fe Ni Pt Pd RhAl O氟里昂的发现与元素周期表1930年美国化学家托马斯·米奇利成功地获得了一种新型的致冷剂——CCl2F2(即氟里昂,简称F12)。这完全得益于元素周期表的指导。在1930年前,一些气体如氨,二氧化硫,氯乙烷和氯甲烷等,被相继用作致冷剂。但是,这些致冷剂不是有毒就是易燃,很不安全。为了寻找无毒不易燃烧的致冷剂,米奇利根据元素周期表研究,分析单质及化合物易燃性和毒性的递变规律。氟里昂的发现与元素周期表在第三周期中,单质的易燃性是Na>Mg>Al,在第二周期中,CH4比NH3易燃,NH3双比H2O易燃,再比较氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元素周期表中右上角的氟元素的化合物可能是理想的元素,不易燃的致冷剂。氟里昂的发现与元素周期表米奇利还分析了其它的一些规律,最终,一种全新的致冷剂CCl2F2终于应运而生了。
80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害人类的健康的气候,逐步将被淘汰。人们又将在元素周期表的指导下去寻找新一代的致冷剂。返回子菜单例1(98)X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式表示为
A. XY B. XY2 C. XY3 D. X2Y3
A. 例2(97)铍的原子序数为4,下列叙述正确的是 A.铍的原子半径大于硼的原子半径 B.氯化铍分子中铍原子的最外层电子数是8 C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气A.C比较微粒的半径大小1、同周期元素的原子或离子2、同主族元素的原子或离子3、相同电子层结构的离子4、同一元素的原子与离子Na、Mg、AlCl-、S2-、P3-F- 、Cl-、Br-、I-Li、Na、K、RbO2-、F- 、Na+、Mg2+、Al3+Cl 、Cl-、 Mg2+、Mg、
