人教版高中化学必修2-第一节《化学能与热能》课件(41张PPT)
文档属性
| 名称 | 人教版高中化学必修2-第一节《化学能与热能》课件(41张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-30 22:18:42 | ||
图片预览









文档简介
(共41张PPT)
化学能与热能
化学必修2 第二章
美味的重庆火锅
怎么这么好吃?
前提是
熟的!
热量
燃烧
热能
化学能
化学能的特点:
不同的物质的化学能不同
同一物质,量不同储存的化学能不同
不能直接测定
所有物质都储存有化学能
化学能—储存在物质内部的一种能量形式,当物质发生化学反应时,它转化成其它形式的能量,如热能、电能、机械能等
化学能
热能
实验
感知化学能向热能的转化
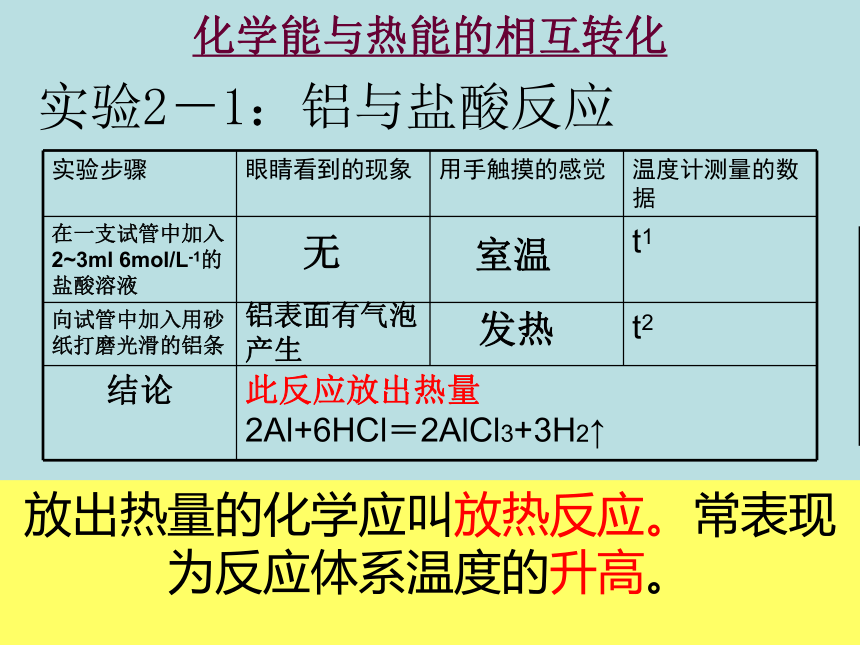
化学能与热能的相互转化
实验2-1:铝与盐酸反应
放出热量的化学应叫放热反应。常表现为反应体系温度的升高。
无
铝表面有气泡产生
发热
此反应放出热量
室温
2Al+6HCl=2AlCl3+3H2↑
实验步骤 眼睛看到的现象 用手触摸的感觉 温度计测量的数据
在一支试管中加入2~3ml 6mol/L-1的 盐酸溶液 t1
向试管中加入用砂纸打磨光滑的铝条 t2
结论
是不是所有的化学反应
都是放热的?
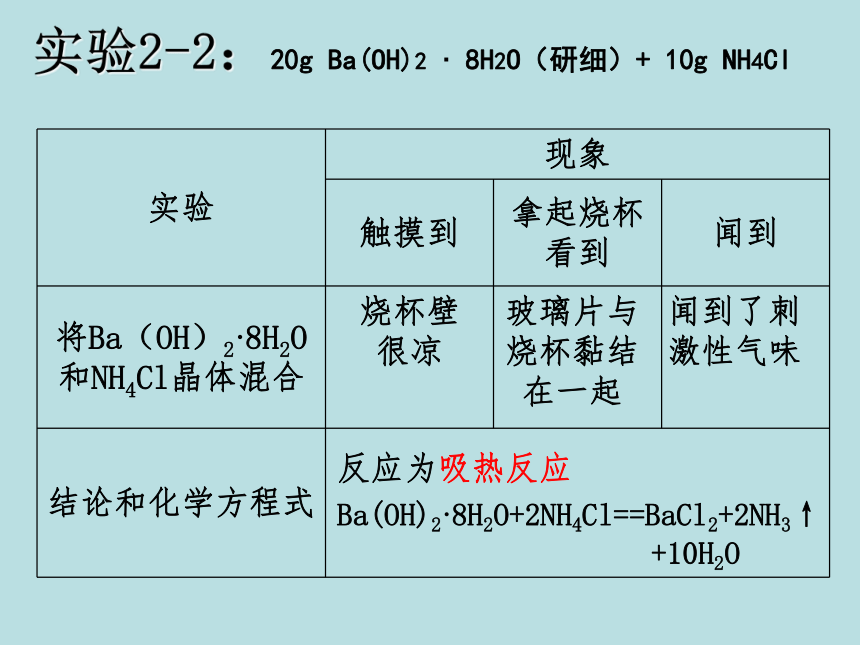
实验2-2:20g Ba(OH)2 · 8H2O(研细)+ 10g NH4Cl
烧杯壁
很凉
玻璃片与烧杯黏结在一起
闻到了刺激性气味
反应为吸热反应
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑
+10H2O
实验 现象
触摸到 拿起烧杯看到 闻到
将Ba(OH)2·8H2O和NH4Cl晶体混合
结论和化学方程式
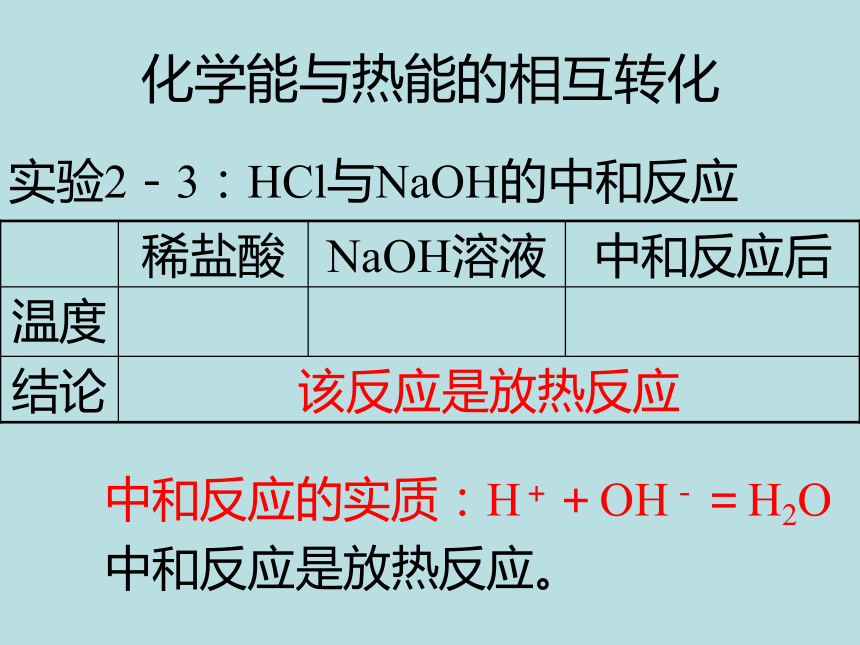
化学能与热能的相互转化
实验2-3:HCl与NaOH的中和反应
该反应是放热反应
结论
温度
中和反应后
NaOH溶液
稀盐酸
中和反应的实质:H++OH-=H2O
中和反应是放热反应。
以上三个实验共同说明
化学反应既有吸热反应,又有放热反应
吸热反应:吸收能量的化学反应
放热反应:放出能量的化学反应
化学反应总是伴随着能量的变化
造成化学反应吸热或放热的原因是什么?
思考
物质中的原子之间通过
化学键相结合
化学键是相邻原子间
强烈的相互作用
断键——吸热
成键——放热
H2+Cl2反应生成HCl
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
吸收的总能量=679 kJ/mol
放出的总能量=2×431 kJ/mol
= 862 kJ/mol
E1
E2
<
放出能量
>
从微观(化学键)角度
吸收的总能量>放出的总能量时,为吸热反应
吸收的总能量<放出的总键能时,为放热反应
物质在化学反应中能量变化的主要原因
化学键的形成和断裂
从宏观(物质的能量)的角度
结论:
一个化学反应的结果是吸热还是放热,决定于反应物总能量与生成物总能量的相对大小。
放热反应
吸热反应
物质本身的能量在化学反应能量变化中起什么作用?
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
放出2×431 kJ/mol
= 862 kJ/mol
E反应物
E生成物
Q吸收
Q放出
自然界两条基本守恒定律
能量越高,越不稳定
知识总结
二、化学反应能量变化主要原因:
化学键的断裂和形成
一、化学反应的基本特征:
有新物质的生成
总是伴随着能量的变化,并且是同步发生的
三、化学反应吸热还是放热决定因素:
宏观:反应物的总能量与生成物的总能量的相对大小
放热反应
燃料的燃烧
中 和 反 应
金 属 与 酸
物质的缓慢氧化
吸热反应
Ba(OH)2.8H2O+NH4Cl
C+CO2
C+H2O
H2+CuO
CaCO3高温分解
人类利用能源的三个阶段
柴草时期
中国古代制陶图
化石能源时期
多能源结构时期
键能
断裂1mol化学键吸所收的能量
键能越大
物质越稳定
键能越小
物质越不稳定
热能
定义——物体内大量分子做无规则运动具有的能叫热能,能量的一种形式,可以和机械能、电能、化学能等其它形式的能相互转化。
特点——物体的温度越高,热能越大;
物体吸收热量,热能增大;
物体放出热量,热能减小。
练习.
在反应H2 + Cl2 =2HCl中,已知H-H
键能为436kJ,Cl-Cl键能为243kJ,
H-Cl键能为431kJ,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收183 kJ热量 D.放出183 kJ热量
BD
生物体中的能量转化
人体内发生的氧化还原反应
与体外的燃烧本质相同,都是放热反应。只是二者条件不同(前者在体温条件和酶的催化作用下发生的),且前者更加合理有效。
科学视野
One Q吸收+E反应物=Q放出+ E生成物
Two |Q吸收-Q放出|=|E反应物-E反应物|
E1Q放出,表现为吸热反应。即: E1E1>E2时,Q吸收E2,放热反应
能量守恒定律:在反应前后体系总能量不变
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
吸收能量
放热反应
吸热反应
从宏观(物质的能量)的角度
结论:
一个化学反应的结果是吸热还是放热,决定于反应物总能量与生成物总能量的相对大小。
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
吸收能量
放热反应
吸热反应
从宏观(物质的能量)的角度
结论:
一个化学反应的结果是吸热还是放热,决定于反应物总能量与生成物总能量的相对大小。
放热反应
从物质总能量的角度分析
吸热反应
从物质总能量的角度分析
△E = △Q
=183 kJ/mol
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
放出2×431 kJ/mol
= 862 kJ/mol
E反应物
E生成物
Q吸收
Q放出
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
吸收的总能量=679 kJ/mol
放出的总能量=2×431 kJ/mol
= 862 kJ/mol
E1
E2
<
放出能量
>
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
放出2×431 kJ/mol
= 862 kJ/mol
E反应物
E生成物
Q吸收
Q放出
化学能与热能
化学必修2 第二章
美味的重庆火锅
怎么这么好吃?
前提是
熟的!
热量
燃烧
热能
化学能
化学能的特点:
不同的物质的化学能不同
同一物质,量不同储存的化学能不同
不能直接测定
所有物质都储存有化学能
化学能—储存在物质内部的一种能量形式,当物质发生化学反应时,它转化成其它形式的能量,如热能、电能、机械能等
化学能
热能
实验
感知化学能向热能的转化
化学能与热能的相互转化
实验2-1:铝与盐酸反应
放出热量的化学应叫放热反应。常表现为反应体系温度的升高。
无
铝表面有气泡产生
发热
此反应放出热量
室温
2Al+6HCl=2AlCl3+3H2↑
实验步骤 眼睛看到的现象 用手触摸的感觉 温度计测量的数据
在一支试管中加入2~3ml 6mol/L-1的 盐酸溶液 t1
向试管中加入用砂纸打磨光滑的铝条 t2
结论
是不是所有的化学反应
都是放热的?
实验2-2:20g Ba(OH)2 · 8H2O(研细)+ 10g NH4Cl
烧杯壁
很凉
玻璃片与烧杯黏结在一起
闻到了刺激性气味
反应为吸热反应
Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑
+10H2O
实验 现象
触摸到 拿起烧杯看到 闻到
将Ba(OH)2·8H2O和NH4Cl晶体混合
结论和化学方程式
化学能与热能的相互转化
实验2-3:HCl与NaOH的中和反应
该反应是放热反应
结论
温度
中和反应后
NaOH溶液
稀盐酸
中和反应的实质:H++OH-=H2O
中和反应是放热反应。
以上三个实验共同说明
化学反应既有吸热反应,又有放热反应
吸热反应:吸收能量的化学反应
放热反应:放出能量的化学反应
化学反应总是伴随着能量的变化
造成化学反应吸热或放热的原因是什么?
思考
物质中的原子之间通过
化学键相结合
化学键是相邻原子间
强烈的相互作用
断键——吸热
成键——放热
H2+Cl2反应生成HCl
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
吸收的总能量=679 kJ/mol
放出的总能量=2×431 kJ/mol
= 862 kJ/mol
E1
E2
<
放出能量
>
从微观(化学键)角度
吸收的总能量>放出的总能量时,为吸热反应
吸收的总能量<放出的总键能时,为放热反应
物质在化学反应中能量变化的主要原因
化学键的形成和断裂
从宏观(物质的能量)的角度
结论:
一个化学反应的结果是吸热还是放热,决定于反应物总能量与生成物总能量的相对大小。
放热反应
吸热反应
物质本身的能量在化学反应能量变化中起什么作用?
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
放出2×431 kJ/mol
= 862 kJ/mol
E反应物
E生成物
Q吸收
Q放出
自然界两条基本守恒定律
能量越高,越不稳定
知识总结
二、化学反应能量变化主要原因:
化学键的断裂和形成
一、化学反应的基本特征:
有新物质的生成
总是伴随着能量的变化,并且是同步发生的
三、化学反应吸热还是放热决定因素:
宏观:反应物的总能量与生成物的总能量的相对大小
放热反应
燃料的燃烧
中 和 反 应
金 属 与 酸
物质的缓慢氧化
吸热反应
Ba(OH)2.8H2O+NH4Cl
C+CO2
C+H2O
H2+CuO
CaCO3高温分解
人类利用能源的三个阶段
柴草时期
中国古代制陶图
化石能源时期
多能源结构时期
键能
断裂1mol化学键吸所收的能量
键能越大
物质越稳定
键能越小
物质越不稳定
热能
定义——物体内大量分子做无规则运动具有的能叫热能,能量的一种形式,可以和机械能、电能、化学能等其它形式的能相互转化。
特点——物体的温度越高,热能越大;
物体吸收热量,热能增大;
物体放出热量,热能减小。
练习.
在反应H2 + Cl2 =2HCl中,已知H-H
键能为436kJ,Cl-Cl键能为243kJ,
H-Cl键能为431kJ,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收183 kJ热量 D.放出183 kJ热量
BD
生物体中的能量转化
人体内发生的氧化还原反应
与体外的燃烧本质相同,都是放热反应。只是二者条件不同(前者在体温条件和酶的催化作用下发生的),且前者更加合理有效。
科学视野
One Q吸收+E反应物=Q放出+ E生成物
Two |Q吸收-Q放出|=|E反应物-E反应物|
E1
能量守恒定律:在反应前后体系总能量不变
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
吸收能量
放热反应
吸热反应
从宏观(物质的能量)的角度
结论:
一个化学反应的结果是吸热还是放热,决定于反应物总能量与生成物总能量的相对大小。
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
吸收能量
放热反应
吸热反应
从宏观(物质的能量)的角度
结论:
一个化学反应的结果是吸热还是放热,决定于反应物总能量与生成物总能量的相对大小。
放热反应
从物质总能量的角度分析
吸热反应
从物质总能量的角度分析
△E = △Q
=183 kJ/mol
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
放出2×431 kJ/mol
= 862 kJ/mol
E反应物
E生成物
Q吸收
Q放出
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
吸收的总能量=679 kJ/mol
放出的总能量=2×431 kJ/mol
= 862 kJ/mol
E1
E2
<
放出能量
>
吸收436 kJ/mol (H2)
吸收243 kJ/mol (Cl2)
放出2×431 kJ/mol
= 862 kJ/mol
E反应物
E生成物
Q吸收
Q放出
