新人教版九年级下册《9.3 溶液的浓度》2020年同步练习卷(含解析)
文档属性
| 名称 | 新人教版九年级下册《9.3 溶液的浓度》2020年同步练习卷(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 169.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 22:41:54 | ||
图片预览


文档简介
新人教版九年级下册《9.3 溶液的浓度》2020年同步练习卷
一、单选题。
1.实验室用37%的浓盐酸(密度1.19g/cm3)配制一定溶质质量分数的稀盐酸,不需要的仪器是( )
A.量筒 B.托盘天平 C.烧杯 D.玻璃棒
2.t℃时,澄清的饱和蔗糖溶液加入一些蔗糖变浑浊,再加入一定量的水,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液 B.溶质的质量变小
C.蔗糖的溶解度不变 D.喝起来更甜了
3.室温下,把100g 10%的硝酸钾溶液中溶质质量分数增加到20%,可以采用的方法是( )
A.蒸发掉45g水
B.蒸发掉50g水
C.加入10g硝酸钾
D.加入100g 10%硝酸钾溶液
4.对“10%的食盐溶液”含义的解释错误的是( )
A.100g水中溶解了10g食盐
B.将10g食盐溶解于90g水中所得的溶液
C.100g食盐溶液溶解有10g食盐
D.将食盐与水按1:9的质量比配成的溶液
5.将溶质质量分数为10%的某溶液100g分别作如下处理:①蒸发掉10g水且无晶体析出;②加入10g同样的溶液;③加入10g同种溶质,使之全部溶解;④加入10g水,搅拌使其混合均匀.经四种方法处理过的溶液中,溶质质量分数由大到小的顺序为( )
A.④>③>②>① B.③>①>②>④ C.①>③>②>④ D.③>②>①>④
6.一定溶质质量分数为10%的食盐水蒸发掉100g水后,溶质质量分数增大一倍,则原溶液中溶质质量为( )
A.10g B.20g C.16g D.8g
7.医疗上常用溶质的质量分数约为0.9%的生理盐水给病人补充体液,现用45g溶质质量分数为10%的氯化钠溶液来配制这种生理盐水,需加水的质量约为( )
A.405g B.450g C.455g D.500g
8.一杯饱和氯化钠溶液长期敞口放置会析出晶体,下列说法正确的是( )
A.溶质减少
B.溶解度减小
C.浓度减小
D.饱和溶液变成不饱和溶液
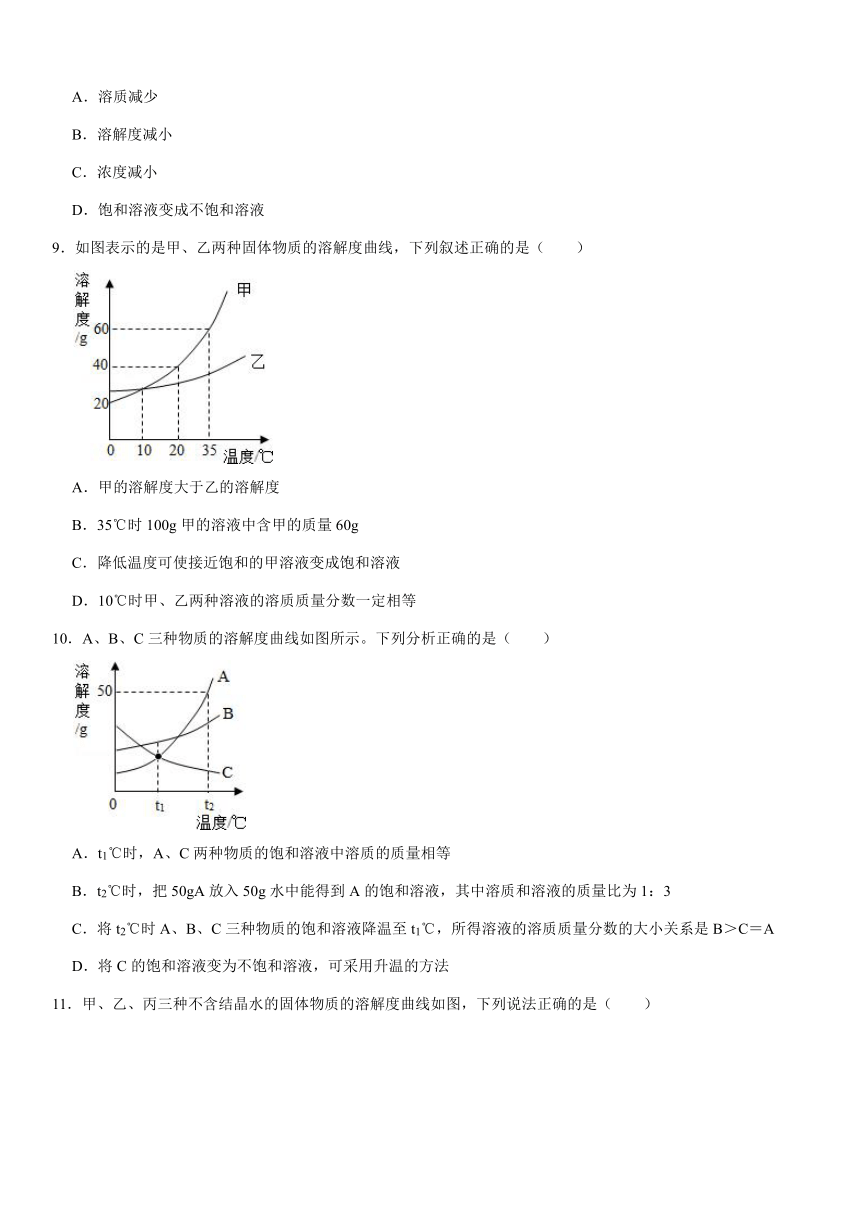
9.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10℃时甲、乙两种溶液的溶质质量分数一定相等
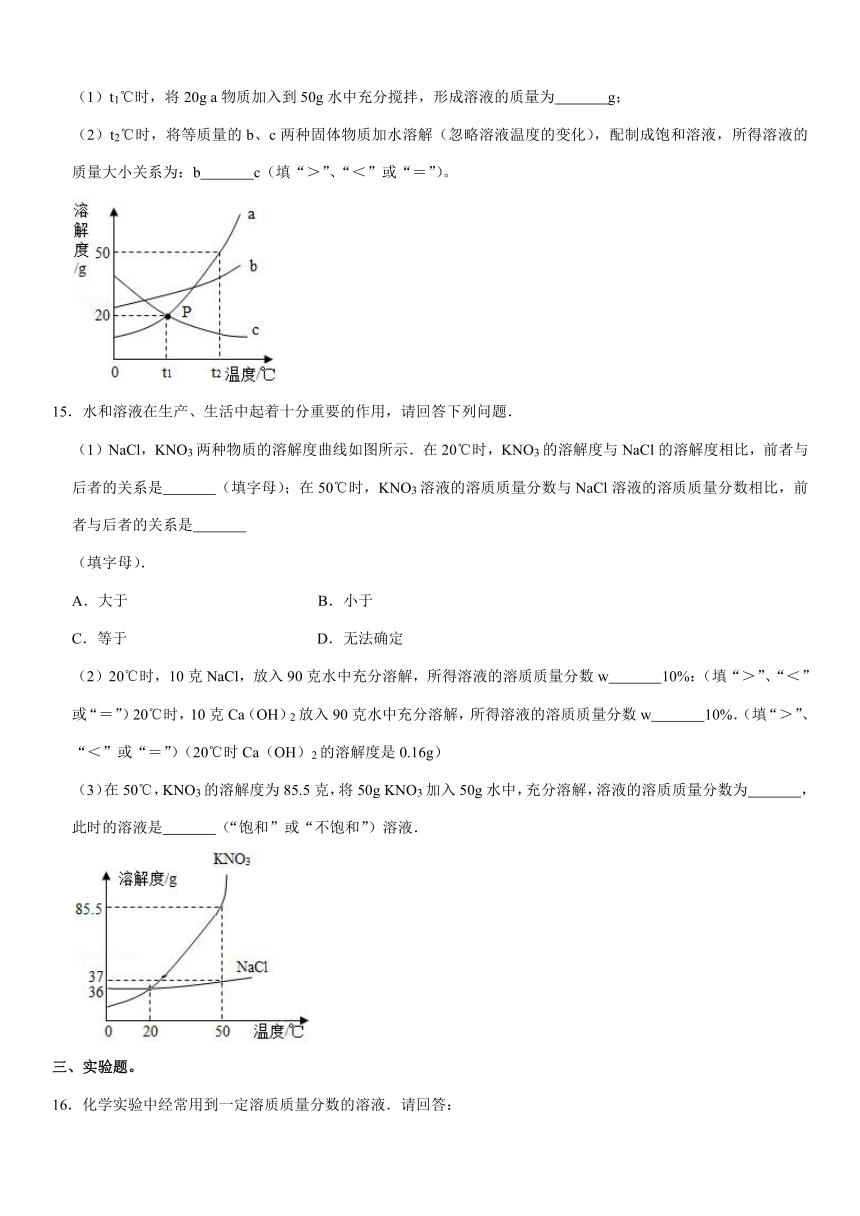
10.A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是( )
A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3
C.将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D.将C的饱和溶液变为不饱和溶液,可采用升温的方法
11.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图,下列说法正确的是( )
A.t1℃时,三种物质的溶解度:乙>甲>丙
B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是80g
C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D.分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
12.按下列方法配制的溶液,其溶质质量分数为5%的是( )
A.称取5.0g生石灰,放入95mL水中,充分搅拌
B.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
C.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
二、填空题。
13.硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是 。
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是 的溶液。
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的 (填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数 (填“变大”、“不变”或“变小”)。
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 。
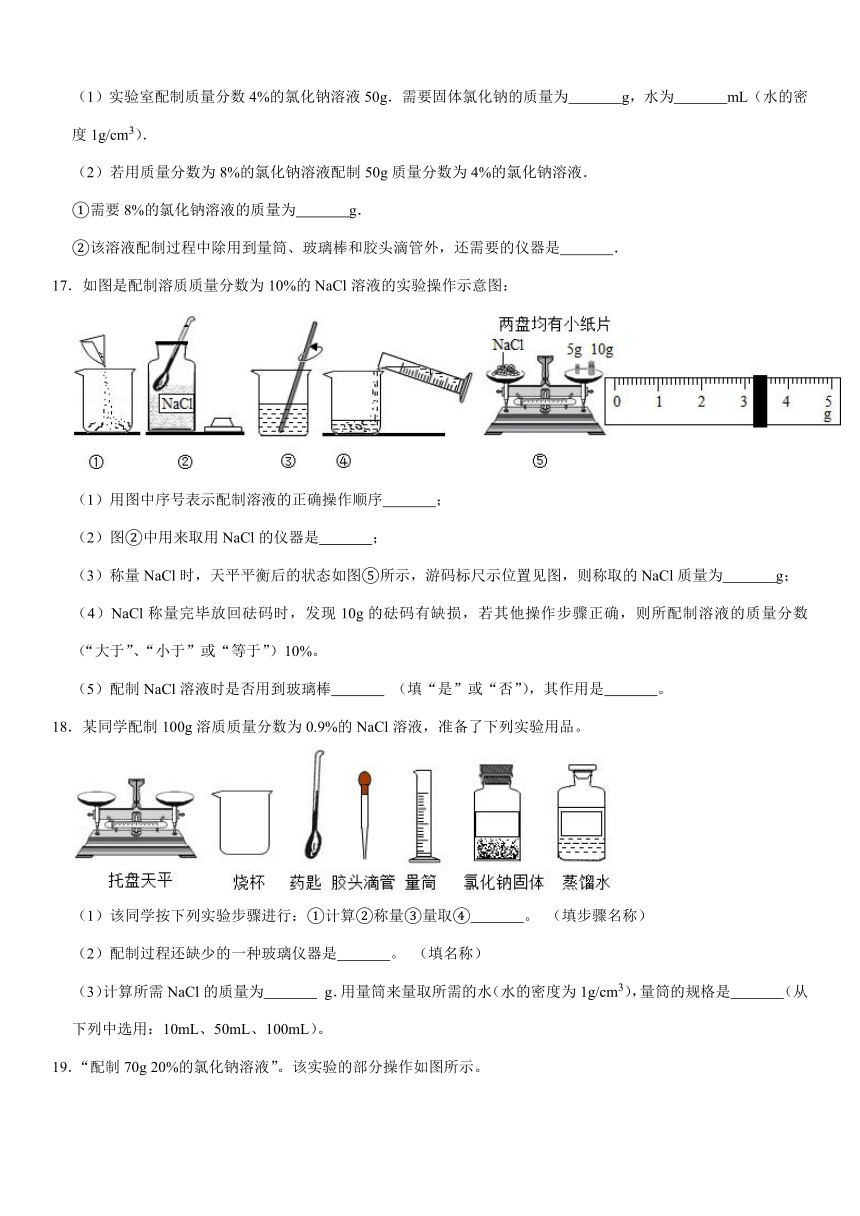
14.如图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)t1℃时,将20g a物质加入到50g水中充分搅拌,形成溶液的质量为 g;
(2)t2℃时,将等质量的b、c两种固体物质加水溶解(忽略溶液温度的变化),配制成饱和溶液,所得溶液的质量大小关系为:b c(填“>”、“<”或“=”)。
15.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题.
(1)NaCl,KNO3两种物质的溶解度曲线如图所示.在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是 (填字母);在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是
(填字母).
A.大于 B.小于
C.等于 D.无法确定
(2)20℃时,10克NaCl,放入90克水中充分溶解,所得溶液的溶质质量分数w 10%:(填“>”、“<”或“=”)20℃时,10克Ca(OH)2放入90克水中充分溶解,所得溶液的溶质质量分数w 10%.(填“>”、“<”或“=”)(20℃时Ca(OH)2的溶解度是0.16g)
(3)在50℃,KNO3的溶解度为85.5克,将50g KNO3加入50g水中,充分溶解,溶液的溶质质量分数为 ,此时的溶液是 (“饱和”或“不饱和”)溶液.
三、实验题。
16.化学实验中经常用到一定溶质质量分数的溶液.请回答:
(1)实验室配制质量分数4%的氯化钠溶液50g.需要固体氯化钠的质量为 g,水为 mL(水的密度1g/cm3).
(2)若用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液.
①需要8%的氯化钠溶液的质量为 g.
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的仪器是 .
17.如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用图中序号表示配制溶液的正确操作顺序 ;
(2)图②中用来取用NaCl的仪器是 ;
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示位置见图,则称取的NaCl质量为 g;
(4)NaCl称量完毕放回砝码时,发现10g的砝码有缺损,若其他操作步骤正确,则所配制溶液的质量分数 (“大于”、“小于”或“等于”)10%。
(5)配制NaCl溶液时是否用到玻璃棒 (填“是”或“否”),其作用是 。
18.某同学配制100g溶质质量分数为0.9%的NaCl溶液,准备了下列实验用品。
(1)该同学按下列实验步骤进行:①计算②称量③量取④ 。 (填步骤名称)
(2)配制过程还缺少的一种玻璃仪器是 。 (填名称)
(3)计算所需NaCl的质量为 g.用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是 (从下列中选用:10mL、50mL、100mL)。
19.“配制70g 20%的氯化钠溶液”。该实验的部分操作如图所示。
(1)需要称取氯化钠的质量是 g,称量时A出现了右盘低的现象,接下来的操作应该是 (填序号)。
①左边的平衡螺丝向左调;②右边的平衡螺丝向右调;
③右盘中减少砝码;④左盘中增加食盐。
(2)量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数 (填“偏大”或“偏小”)。
(3)C中用玻璃棒搅拌的作用是 。
(4)D中所贴标签,请在方框中写出你认为适合的内容。
20.如图是配制100g质量分数为5%的氯化钠溶液的操作示意图,据图回答:
(1)在上图所示配制溶液的过程中,正确的操作顺序是 (填字母),此次配制过程中,需要量取水
mL(水的密度1g/cm3)
(2)在步骤E的操作中,用量简量取水时,量简必须放平稳,视线要与量筒内液体凹液面的 处保持水平。
(3)现有50mL质量分数为98%的浓硫酸(密度为1.84g/cm3),要把该浓硫酸稀释为溶质的质量分数为20%的稀硫酸,则需要水的质量为 g(结果精确到0.1g)
21.配制一定溶质质量分数的氯化钠溶液常按以下操作步骤进行。请回答下列问题:
(1)配制100g溶质质量分数为5%的氯化钠溶液,所需氯化钠固体的质量为 g。
(2)用托盘天平称量所需氯化钠时,发现天平的指针偏向左盘,应进行的操作是 。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节游码 D.添加砝码
(3)在配制过程中,有关下列描述,会导致溶液浓度偏小的是 (填字母)。
A.称量好的NaCl固体倒入烧杯时,有少许洒出
B.量水的体积时,俯视度数
C.溶解NaCl固体的烧杯内壁有水珠
D.将5g NaCl固体完全溶解在100g水中
四、计算题。
22.无土栽培是一种农业高新技术,它可以显著提高农作物的产量和质量。某品种茄子的无土栽培营养液中含有5%的硝酸钾(KNO3)。
(1)KNO3中钾、氮、氧元素的质量比为 。
(2)要配制150kg该营养液,需要硝酸钾的质量为 kg。
(3)要使这I50kg营养液中硝酸钾的质量分数增大一倍。则需要加入多少千克硝酸钾?(写出计算过程,得数保留一位小数)
新人教版九年级下册《9.3 溶液的浓度》2020年同步练习卷
参考答案与试题解析
一、单选题。
1.【解答】解:
配制溶质质量分数一定的盐酸溶液的基本步骤:计算、量取、溶解、装瓶存放,量取用到量筒、胶头滴管,溶解时用到烧杯、玻璃棒。
故选:B。
2.【解答】解:A、温度一定时,饱和溶液加水稀释溶液会变成不饱和,故此选项错误。
B、该过程中溶质没有析出,溶质的质量不变,故此选项错误。
C、因为固体物质的溶解度只与温度有关,温度不变时溶质的溶解度不变,故此选项正确。
D、溶质不变溶剂变多溶液变稀,溶质的质量分数变小,喝起来不如原来甜了,故此选项错误。
故选:C。
3.【解答】解:设需要增加溶质的质量为x
×100%=20%
解之得 x=12.5g
设需要蒸发溶剂的质量为y
×100%=20%
解之得 y=50g
由溶液的均一性可知,加入100g 10%硝酸钾溶液后溶液中溶质质量分数仍未10%。
故选:B。
4.【解答】解:溶质质量分数为10%的食盐溶液即溶液中溶质和溶液的质量之比是10:100,或溶质和溶剂的质量之比为10:90。
A、10%的食盐溶液是指100g食盐溶液中溶解了10g食盐,而不是100g水中溶解了10g食盐,故A解释错误;
B、将10g食盐溶解在90g水中所得的溶液,溶质和溶液的质量比是10g:100g,即10:100;故B解释正确;
C、由A的分析可知:100g食盐溶液中溶解有10g食盐解释正确,故C解释正确;
D、10%的食盐溶液中食盐与水的质量比是10:90,即1:9,故D解释正确。
故选:A。
5.【解答】解:①蒸发掉10g水且无晶体析出,是溶液变浓,溶质质量分数=×100%=11.1%
②加入10g同样的溶液溶质质量分数不变仍为10%
③加入10g同种溶质,使之全部溶解,溶质质量分数=×100%=18.2%
④加入10g水,溶质质量分数小于10%
溶质质量分数由大到小的顺序为③>①>②>④
故选:B。
6.【解答】解:设原溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则(x﹣100g)×20%=x×10% x=200g。
原溶液中溶质的质量为200g×10%=20g。
故选:B。
7.【解答】解:根据加水前后溶质的质量不变列等式,设需要加水的质量为x
45g×10%=(45g+x)×0.9%
解之得 x=455g
故选:C。
8.【解答】解:A、饱和氯化钠露置于空气中,水分会不断蒸发减小,故A正确。
B、温度不变溶质的溶解度不变,故B错误。
C、析出溶质后溶液仍为这一温度下的饱和溶液,故溶质质量分数不变,故C错误。
D、析出溶质的溶液所剩溶液一定饱和,故D错误。
故选:A。
9.【解答】解:A、比较两种物质溶解度的大小,必须有温度的限制,故A错;
B、35℃时甲的溶解度是60g,即该温度下,100g水中最多溶解60g甲,所以35℃时160g甲的饱和溶液中含甲的质量60g,故B错;
C、降低温度时甲物质的溶解度减小,会析出晶体,所以溶液仍然是饱和溶液,故C正确;
D、10℃时甲、乙两种的溶解度相等,饱和溶液的溶质质量分数相等,没说明溶液是否饱和,不能比较溶质质量分数的大小,故D错。
故选:C。
10.【解答】解:A、t1℃时,A、C两种物质的饱和溶液的质量不能确定,所以溶质质量也不能确定,故A错误;
B、t2℃时,A物质的溶解度是50g,所以把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为:25g:75g=1:3,故B正确;
C、将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,t1℃时,B物质的溶解度大于A物质的溶解度,C物质的溶解度随温度的升高而减小,所以C物质降温后,没有晶体析出,所得溶液的溶质质量分数的大小关系是B>A>C,故C错误;
D、C物质的溶解度随温度的升高而减小,所以将C的饱和溶液变为不饱和溶液,可采用降温的方法,故D错误。
故选:B。
11.【解答】解:A、t1℃时,三种物质的溶解度:乙>甲=丙,不是乙>甲>丙;故选项错误;
B、20℃时,甲的溶解度是40g,因此将30g甲放入50g水中,充分搅拌,所得溶液的质量=20g+50g=70g,不是80g;故选项错误;
C、分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大不正确,因为没有证明等质量的饱和溶液;故选项错误;
D、分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙是正确的,因为甲和乙的质量分数不变,还是乙大于甲,而丙升温后有晶体析出,质量分数变小,故选项正确;
故选:D。
12.【解答】解:A、生石灰于水反应生成熟石灰,熟石灰微溶于水,故A错误;
B、5.0mL浓盐酸是溶液的体积不能得出溶质氯化氢的质量,故不能求得溶质质量分数,故B错误;
C、氯化钾能溶解于水,5.0g氯化钾,溶解在95mL.水中计算溶质质量分数为5g÷(5g+95g)=5%,故C正确
D、碳酸钙不溶于水,得不到溶液,故D错误;
故选:C。
二、填空题。
13.【解答】解:①由溶解度曲线可以看出,t1℃硝酸钾的溶解度小于氯化钾的溶解度;
②t2℃时,两物质的等质量饱和溶液降温至t1℃,硝酸钾的溶解度变化大,析出固体质量较大的是硝酸钾;
③由溶解度曲线可知,在t2℃时,氯化钾的溶解度是40g,即100g水中最多溶解40g的氯化钾,所以在该温度下,将50g氯化钾放入100g水中,并不能完全溶解,有10g氯化钾不能溶解,得到的溶液为该温度下的饱和溶液;在该温度下,10g水中最多溶解4g氯化钾就达到饱和状态,所以加入10g水后,充分搅拌所得溶液中仍有6g氯化钾没有溶解,溶液为该温度下的饱和溶液,所以溶液中溶质的质量分数不变;
④t1℃时,硝酸钾的溶解度为25,此温度下的饱和溶液中,溶质的质量分数为×100%=20%,硝酸钾的溶解度随温度的升高而增大,因此要配制溶质的质量分数为20%的硝酸钾溶液,温度不能低于t1℃;
故答案为:(1)氯化钾;
(2)硝酸钾;
(3)饱和; 不变;
(4)温度不低于t1°C。
14.【解答】解:(1)t1℃时,将20ga物质加入到50g水中充分搅拌,形成溶液的质量=10g+50g=60g;故答案为:60;
(2)t2℃时,将等质量的b、c两种固体物质加水溶解,配制成饱和溶液,所得溶液的质量大小关系为:b<c,因为该温度下,c需要的水比b多;故答案为:<;
15.【解答】解:(1)在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是硝酸钾小于氯化钠;在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是无法确定,因为没有说明溶液是否饱和;故答案为:B;D;
(2)20℃时,10克NaCl,放入90克水中充分溶解,所得溶液的溶质质量分数w==10%;20℃时,10克Ca(OH)2放入90克水中充分溶解,所得溶液的溶质质量分数w小于10%,因为10g氢氧化钙不能全部溶解;故答案为:=;<;
(3)在50℃,KNO3的溶解度为85.5克,将50g KNO3加入50g水中,充分溶解,溶液的溶质质量分数=≈46.1%;此时的溶液是饱和溶液,并且溶质有剩余;故答案为:46.1%、饱和;
三、实验题。
16.【解答】解:(1)实验室配制质量分数4%的氯化钠溶液50g,需要固体氯化钠的质量为50g×4%=2g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=50g﹣2g=48g;水的密度为1g/cm3,则48g合48cm3=48mL.
(2)①设需要8%的氯化钠溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则x×8%=50g×4% x=25g.
②用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液,配制步骤是计算、称量浓溶液和量取水、溶解,需要用到托盘天平、量筒、玻璃棒、胶头滴管、烧杯.
故答案为:(1)2;48;(2)①25;②托盘天平、烧杯.
17.【解答】解:(1)称量食盐的质量首先打开广口瓶塞,倒放在桌面上,将取得的食盐放在天平的左盘,然后将称得的食盐放到烧杯中,再将量取的水倒入烧杯中,用玻璃棒搅拌使之溶解,故正确的顺序为②⑤①④③;
(2)图②中用来取用NaCl的仪器是为药匙;
(3)食盐的质量=砝码+游码,据图可知,砝码的读数是15g,游码的读数是3.2g,故食盐的质量=15g+3.2g=18.2g;
(4)砝码缺少一角则称量的食盐的质量减小,溶质减少,则溶液变稀,溶质质量分数变小;
(5)溶解时用玻璃棒搅拌以加速溶解。
故答案为:(1)②⑤①④③;(2)药匙;(3)18.2g;(4)小于;(5)是;加速食盐溶解。
18.【解答】解:(1)配制100g溶质质量分数为0.9%的NaCl溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解。
(2)配制100g溶质质量分数为0.9%的NaCl溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,故配制过程还缺少的一种玻璃仪器是玻璃棒。
(3)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为0.9%的NaCl溶液,需氯化钠的质量=100g×0.9%=0.9g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣0.9g=99.1g(合99.1mL),应用规格为100mL的量筒量取水的体积。
故答案为:
(1)溶解;
(2)玻璃棒;
(3)0.9;100mL。
19.【解答】解:(1)氯化钠质量:70g×20%=14g;在称量中天平发生偏转时要么加药品,要么减药品,出现了右盘低的现象说明药品少了,应该增加食盐;故选D;
(2)仰视读数量取水时看到的读数偏小,但量取到的液体正好偏多,水多了,溶质质量分数就偏小;
(3)玻璃棒搅拌目的是加速氯化钠溶解;
(4)标签上应该注明的是溶液的溶质质量分数,如图:
故答案为:
(1)14; D;
(2)量筒;偏小;
(3)加速食盐溶解;
(4)
20.【解答】解:(1)配制100g质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,正确的操作顺序是ACBED。
溶质质量=溶液质量×溶质的质量分数,配制100g质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣5g=95(合95mL)。
(2)在步骤E的操作中,用量简量取水时,量简必须放平稳,视线要与量筒内液体凹液面的凹液面的最低处保持水平。
(3)设需要水的质量为x,50mL=50cm3,根据溶液稀释前后溶质的质量不变,
则1.84g/cm3×50cm3×98%=(1.84g/cm3×50cm3+x)×20% x=358.8g。
故答案为:
(1)ACBED;95;
(2)凹液面的最低;
(3)358.8。
21.【解答】解:(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;
(2)用托盘天平称量5g固体药品NaCl时,步骤是:调节天平平衡,在右盘上加砝码和拨动游码,然后向左边托盘添加药品直至天平平衡;称量过程中他发现指针偏左了,说明NaCl的质量大于砝码质量,应减少NaCl。
(3)A、称量好的NaCl固体倒入烧杯时,有少许洒出,溶质偏少,则使溶质质量分数偏小,故选项正确。
B、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项不正确。
C、溶解NaCl固体的烧杯内壁有水珠,多取了水,则使溶质质量分数偏小,故选项正确。
D、将5g NaCl固体完全溶解在100g水中,溶液质量大于100g,溶质质量分数偏小,故选项正确。
故答案为:(1)5,95,100;(2)B;(3)ACD。
四、计算题。
22.【解答】解:(1)KNO3中钾、氮、氧元素的质量比为39:14:(16×3)=39:14:48,故填:39:14:48;
(2)配制150kg该营养液,需要硝酸钾的质量=150kg×5%=7.5kg;故填:7.5;
(3)设需要加入硝酸钾的质量为x,则
x≈8.3kg
答:需要加入8.3kg的硝酸钾
一、单选题。
1.实验室用37%的浓盐酸(密度1.19g/cm3)配制一定溶质质量分数的稀盐酸,不需要的仪器是( )
A.量筒 B.托盘天平 C.烧杯 D.玻璃棒
2.t℃时,澄清的饱和蔗糖溶液加入一些蔗糖变浑浊,再加入一定量的水,下列有关该溶液的叙述正确的是( )
A.仍为饱和溶液 B.溶质的质量变小
C.蔗糖的溶解度不变 D.喝起来更甜了
3.室温下,把100g 10%的硝酸钾溶液中溶质质量分数增加到20%,可以采用的方法是( )
A.蒸发掉45g水
B.蒸发掉50g水
C.加入10g硝酸钾
D.加入100g 10%硝酸钾溶液
4.对“10%的食盐溶液”含义的解释错误的是( )
A.100g水中溶解了10g食盐
B.将10g食盐溶解于90g水中所得的溶液
C.100g食盐溶液溶解有10g食盐
D.将食盐与水按1:9的质量比配成的溶液
5.将溶质质量分数为10%的某溶液100g分别作如下处理:①蒸发掉10g水且无晶体析出;②加入10g同样的溶液;③加入10g同种溶质,使之全部溶解;④加入10g水,搅拌使其混合均匀.经四种方法处理过的溶液中,溶质质量分数由大到小的顺序为( )
A.④>③>②>① B.③>①>②>④ C.①>③>②>④ D.③>②>①>④
6.一定溶质质量分数为10%的食盐水蒸发掉100g水后,溶质质量分数增大一倍,则原溶液中溶质质量为( )
A.10g B.20g C.16g D.8g
7.医疗上常用溶质的质量分数约为0.9%的生理盐水给病人补充体液,现用45g溶质质量分数为10%的氯化钠溶液来配制这种生理盐水,需加水的质量约为( )
A.405g B.450g C.455g D.500g
8.一杯饱和氯化钠溶液长期敞口放置会析出晶体,下列说法正确的是( )
A.溶质减少
B.溶解度减小
C.浓度减小
D.饱和溶液变成不饱和溶液
9.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10℃时甲、乙两种溶液的溶质质量分数一定相等
10.A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是( )
A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
B.t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3
C.将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D.将C的饱和溶液变为不饱和溶液,可采用升温的方法
11.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图,下列说法正确的是( )
A.t1℃时,三种物质的溶解度:乙>甲>丙
B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是80g
C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大
D.分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
12.按下列方法配制的溶液,其溶质质量分数为5%的是( )
A.称取5.0g生石灰,放入95mL水中,充分搅拌
B.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
C.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
二、填空题。
13.硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
①t1℃时,两物质中溶解度较大的是 。
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是 的溶液。
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的 (填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数 (填“变大”、“不变”或“变小”)。
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 。
14.如图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)t1℃时,将20g a物质加入到50g水中充分搅拌,形成溶液的质量为 g;
(2)t2℃时,将等质量的b、c两种固体物质加水溶解(忽略溶液温度的变化),配制成饱和溶液,所得溶液的质量大小关系为:b c(填“>”、“<”或“=”)。
15.水和溶液在生产、生活中起着十分重要的作用,请回答下列问题.
(1)NaCl,KNO3两种物质的溶解度曲线如图所示.在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是 (填字母);在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是
(填字母).
A.大于 B.小于
C.等于 D.无法确定
(2)20℃时,10克NaCl,放入90克水中充分溶解,所得溶液的溶质质量分数w 10%:(填“>”、“<”或“=”)20℃时,10克Ca(OH)2放入90克水中充分溶解,所得溶液的溶质质量分数w 10%.(填“>”、“<”或“=”)(20℃时Ca(OH)2的溶解度是0.16g)
(3)在50℃,KNO3的溶解度为85.5克,将50g KNO3加入50g水中,充分溶解,溶液的溶质质量分数为 ,此时的溶液是 (“饱和”或“不饱和”)溶液.
三、实验题。
16.化学实验中经常用到一定溶质质量分数的溶液.请回答:
(1)实验室配制质量分数4%的氯化钠溶液50g.需要固体氯化钠的质量为 g,水为 mL(水的密度1g/cm3).
(2)若用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液.
①需要8%的氯化钠溶液的质量为 g.
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的仪器是 .
17.如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用图中序号表示配制溶液的正确操作顺序 ;
(2)图②中用来取用NaCl的仪器是 ;
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示位置见图,则称取的NaCl质量为 g;
(4)NaCl称量完毕放回砝码时,发现10g的砝码有缺损,若其他操作步骤正确,则所配制溶液的质量分数 (“大于”、“小于”或“等于”)10%。
(5)配制NaCl溶液时是否用到玻璃棒 (填“是”或“否”),其作用是 。
18.某同学配制100g溶质质量分数为0.9%的NaCl溶液,准备了下列实验用品。
(1)该同学按下列实验步骤进行:①计算②称量③量取④ 。 (填步骤名称)
(2)配制过程还缺少的一种玻璃仪器是 。 (填名称)
(3)计算所需NaCl的质量为 g.用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是 (从下列中选用:10mL、50mL、100mL)。
19.“配制70g 20%的氯化钠溶液”。该实验的部分操作如图所示。
(1)需要称取氯化钠的质量是 g,称量时A出现了右盘低的现象,接下来的操作应该是 (填序号)。
①左边的平衡螺丝向左调;②右边的平衡螺丝向右调;
③右盘中减少砝码;④左盘中增加食盐。
(2)量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数 (填“偏大”或“偏小”)。
(3)C中用玻璃棒搅拌的作用是 。
(4)D中所贴标签,请在方框中写出你认为适合的内容。
20.如图是配制100g质量分数为5%的氯化钠溶液的操作示意图,据图回答:
(1)在上图所示配制溶液的过程中,正确的操作顺序是 (填字母),此次配制过程中,需要量取水
mL(水的密度1g/cm3)
(2)在步骤E的操作中,用量简量取水时,量简必须放平稳,视线要与量筒内液体凹液面的 处保持水平。
(3)现有50mL质量分数为98%的浓硫酸(密度为1.84g/cm3),要把该浓硫酸稀释为溶质的质量分数为20%的稀硫酸,则需要水的质量为 g(结果精确到0.1g)
21.配制一定溶质质量分数的氯化钠溶液常按以下操作步骤进行。请回答下列问题:
(1)配制100g溶质质量分数为5%的氯化钠溶液,所需氯化钠固体的质量为 g。
(2)用托盘天平称量所需氯化钠时,发现天平的指针偏向左盘,应进行的操作是 。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节游码 D.添加砝码
(3)在配制过程中,有关下列描述,会导致溶液浓度偏小的是 (填字母)。
A.称量好的NaCl固体倒入烧杯时,有少许洒出
B.量水的体积时,俯视度数
C.溶解NaCl固体的烧杯内壁有水珠
D.将5g NaCl固体完全溶解在100g水中
四、计算题。
22.无土栽培是一种农业高新技术,它可以显著提高农作物的产量和质量。某品种茄子的无土栽培营养液中含有5%的硝酸钾(KNO3)。
(1)KNO3中钾、氮、氧元素的质量比为 。
(2)要配制150kg该营养液,需要硝酸钾的质量为 kg。
(3)要使这I50kg营养液中硝酸钾的质量分数增大一倍。则需要加入多少千克硝酸钾?(写出计算过程,得数保留一位小数)
新人教版九年级下册《9.3 溶液的浓度》2020年同步练习卷
参考答案与试题解析
一、单选题。
1.【解答】解:
配制溶质质量分数一定的盐酸溶液的基本步骤:计算、量取、溶解、装瓶存放,量取用到量筒、胶头滴管,溶解时用到烧杯、玻璃棒。
故选:B。
2.【解答】解:A、温度一定时,饱和溶液加水稀释溶液会变成不饱和,故此选项错误。
B、该过程中溶质没有析出,溶质的质量不变,故此选项错误。
C、因为固体物质的溶解度只与温度有关,温度不变时溶质的溶解度不变,故此选项正确。
D、溶质不变溶剂变多溶液变稀,溶质的质量分数变小,喝起来不如原来甜了,故此选项错误。
故选:C。
3.【解答】解:设需要增加溶质的质量为x
×100%=20%
解之得 x=12.5g
设需要蒸发溶剂的质量为y
×100%=20%
解之得 y=50g
由溶液的均一性可知,加入100g 10%硝酸钾溶液后溶液中溶质质量分数仍未10%。
故选:B。
4.【解答】解:溶质质量分数为10%的食盐溶液即溶液中溶质和溶液的质量之比是10:100,或溶质和溶剂的质量之比为10:90。
A、10%的食盐溶液是指100g食盐溶液中溶解了10g食盐,而不是100g水中溶解了10g食盐,故A解释错误;
B、将10g食盐溶解在90g水中所得的溶液,溶质和溶液的质量比是10g:100g,即10:100;故B解释正确;
C、由A的分析可知:100g食盐溶液中溶解有10g食盐解释正确,故C解释正确;
D、10%的食盐溶液中食盐与水的质量比是10:90,即1:9,故D解释正确。
故选:A。
5.【解答】解:①蒸发掉10g水且无晶体析出,是溶液变浓,溶质质量分数=×100%=11.1%
②加入10g同样的溶液溶质质量分数不变仍为10%
③加入10g同种溶质,使之全部溶解,溶质质量分数=×100%=18.2%
④加入10g水,溶质质量分数小于10%
溶质质量分数由大到小的顺序为③>①>②>④
故选:B。
6.【解答】解:设原溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则(x﹣100g)×20%=x×10% x=200g。
原溶液中溶质的质量为200g×10%=20g。
故选:B。
7.【解答】解:根据加水前后溶质的质量不变列等式,设需要加水的质量为x
45g×10%=(45g+x)×0.9%
解之得 x=455g
故选:C。
8.【解答】解:A、饱和氯化钠露置于空气中,水分会不断蒸发减小,故A正确。
B、温度不变溶质的溶解度不变,故B错误。
C、析出溶质后溶液仍为这一温度下的饱和溶液,故溶质质量分数不变,故C错误。
D、析出溶质的溶液所剩溶液一定饱和,故D错误。
故选:A。
9.【解答】解:A、比较两种物质溶解度的大小,必须有温度的限制,故A错;
B、35℃时甲的溶解度是60g,即该温度下,100g水中最多溶解60g甲,所以35℃时160g甲的饱和溶液中含甲的质量60g,故B错;
C、降低温度时甲物质的溶解度减小,会析出晶体,所以溶液仍然是饱和溶液,故C正确;
D、10℃时甲、乙两种的溶解度相等,饱和溶液的溶质质量分数相等,没说明溶液是否饱和,不能比较溶质质量分数的大小,故D错。
故选:C。
10.【解答】解:A、t1℃时,A、C两种物质的饱和溶液的质量不能确定,所以溶质质量也不能确定,故A错误;
B、t2℃时,A物质的溶解度是50g,所以把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为:25g:75g=1:3,故B正确;
C、将t2℃时A、B、C三种物质的饱和溶液降温至t1℃,t1℃时,B物质的溶解度大于A物质的溶解度,C物质的溶解度随温度的升高而减小,所以C物质降温后,没有晶体析出,所得溶液的溶质质量分数的大小关系是B>A>C,故C错误;
D、C物质的溶解度随温度的升高而减小,所以将C的饱和溶液变为不饱和溶液,可采用降温的方法,故D错误。
故选:B。
11.【解答】解:A、t1℃时,三种物质的溶解度:乙>甲=丙,不是乙>甲>丙;故选项错误;
B、20℃时,甲的溶解度是40g,因此将30g甲放入50g水中,充分搅拌,所得溶液的质量=20g+50g=70g,不是80g;故选项错误;
C、分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大不正确,因为没有证明等质量的饱和溶液;故选项错误;
D、分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙是正确的,因为甲和乙的质量分数不变,还是乙大于甲,而丙升温后有晶体析出,质量分数变小,故选项正确;
故选:D。
12.【解答】解:A、生石灰于水反应生成熟石灰,熟石灰微溶于水,故A错误;
B、5.0mL浓盐酸是溶液的体积不能得出溶质氯化氢的质量,故不能求得溶质质量分数,故B错误;
C、氯化钾能溶解于水,5.0g氯化钾,溶解在95mL.水中计算溶质质量分数为5g÷(5g+95g)=5%,故C正确
D、碳酸钙不溶于水,得不到溶液,故D错误;
故选:C。
二、填空题。
13.【解答】解:①由溶解度曲线可以看出,t1℃硝酸钾的溶解度小于氯化钾的溶解度;
②t2℃时,两物质的等质量饱和溶液降温至t1℃,硝酸钾的溶解度变化大,析出固体质量较大的是硝酸钾;
③由溶解度曲线可知,在t2℃时,氯化钾的溶解度是40g,即100g水中最多溶解40g的氯化钾,所以在该温度下,将50g氯化钾放入100g水中,并不能完全溶解,有10g氯化钾不能溶解,得到的溶液为该温度下的饱和溶液;在该温度下,10g水中最多溶解4g氯化钾就达到饱和状态,所以加入10g水后,充分搅拌所得溶液中仍有6g氯化钾没有溶解,溶液为该温度下的饱和溶液,所以溶液中溶质的质量分数不变;
④t1℃时,硝酸钾的溶解度为25,此温度下的饱和溶液中,溶质的质量分数为×100%=20%,硝酸钾的溶解度随温度的升高而增大,因此要配制溶质的质量分数为20%的硝酸钾溶液,温度不能低于t1℃;
故答案为:(1)氯化钾;
(2)硝酸钾;
(3)饱和; 不变;
(4)温度不低于t1°C。
14.【解答】解:(1)t1℃时,将20ga物质加入到50g水中充分搅拌,形成溶液的质量=10g+50g=60g;故答案为:60;
(2)t2℃时,将等质量的b、c两种固体物质加水溶解,配制成饱和溶液,所得溶液的质量大小关系为:b<c,因为该温度下,c需要的水比b多;故答案为:<;
15.【解答】解:(1)在20℃时,KNO3的溶解度与NaCl的溶解度相比,前者与后者的关系是硝酸钾小于氯化钠;在50℃时,KNO3溶液的溶质质量分数与NaCl溶液的溶质质量分数相比,前者与后者的关系是无法确定,因为没有说明溶液是否饱和;故答案为:B;D;
(2)20℃时,10克NaCl,放入90克水中充分溶解,所得溶液的溶质质量分数w==10%;20℃时,10克Ca(OH)2放入90克水中充分溶解,所得溶液的溶质质量分数w小于10%,因为10g氢氧化钙不能全部溶解;故答案为:=;<;
(3)在50℃,KNO3的溶解度为85.5克,将50g KNO3加入50g水中,充分溶解,溶液的溶质质量分数=≈46.1%;此时的溶液是饱和溶液,并且溶质有剩余;故答案为:46.1%、饱和;
三、实验题。
16.【解答】解:(1)实验室配制质量分数4%的氯化钠溶液50g,需要固体氯化钠的质量为50g×4%=2g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=50g﹣2g=48g;水的密度为1g/cm3,则48g合48cm3=48mL.
(2)①设需要8%的氯化钠溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则x×8%=50g×4% x=25g.
②用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液,配制步骤是计算、称量浓溶液和量取水、溶解,需要用到托盘天平、量筒、玻璃棒、胶头滴管、烧杯.
故答案为:(1)2;48;(2)①25;②托盘天平、烧杯.
17.【解答】解:(1)称量食盐的质量首先打开广口瓶塞,倒放在桌面上,将取得的食盐放在天平的左盘,然后将称得的食盐放到烧杯中,再将量取的水倒入烧杯中,用玻璃棒搅拌使之溶解,故正确的顺序为②⑤①④③;
(2)图②中用来取用NaCl的仪器是为药匙;
(3)食盐的质量=砝码+游码,据图可知,砝码的读数是15g,游码的读数是3.2g,故食盐的质量=15g+3.2g=18.2g;
(4)砝码缺少一角则称量的食盐的质量减小,溶质减少,则溶液变稀,溶质质量分数变小;
(5)溶解时用玻璃棒搅拌以加速溶解。
故答案为:(1)②⑤①④③;(2)药匙;(3)18.2g;(4)小于;(5)是;加速食盐溶解。
18.【解答】解:(1)配制100g溶质质量分数为0.9%的NaCl溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,最后进行溶解。
(2)配制100g溶质质量分数为0.9%的NaCl溶液,首先计算配制溶液所需NaCl和水的质量,再称量所需的NaCl和量取水,在这些操作中需要的仪器:托盘天平、药匙、量筒、胶头滴管、烧杯和玻璃棒,故配制过程还缺少的一种玻璃仪器是玻璃棒。
(3)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为0.9%的NaCl溶液,需氯化钠的质量=100g×0.9%=0.9g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣0.9g=99.1g(合99.1mL),应用规格为100mL的量筒量取水的体积。
故答案为:
(1)溶解;
(2)玻璃棒;
(3)0.9;100mL。
19.【解答】解:(1)氯化钠质量:70g×20%=14g;在称量中天平发生偏转时要么加药品,要么减药品,出现了右盘低的现象说明药品少了,应该增加食盐;故选D;
(2)仰视读数量取水时看到的读数偏小,但量取到的液体正好偏多,水多了,溶质质量分数就偏小;
(3)玻璃棒搅拌目的是加速氯化钠溶解;
(4)标签上应该注明的是溶液的溶质质量分数,如图:
故答案为:
(1)14; D;
(2)量筒;偏小;
(3)加速食盐溶解;
(4)
20.【解答】解:(1)配制100g质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,正确的操作顺序是ACBED。
溶质质量=溶液质量×溶质的质量分数,配制100g质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣5g=95(合95mL)。
(2)在步骤E的操作中,用量简量取水时,量简必须放平稳,视线要与量筒内液体凹液面的凹液面的最低处保持水平。
(3)设需要水的质量为x,50mL=50cm3,根据溶液稀释前后溶质的质量不变,
则1.84g/cm3×50cm3×98%=(1.84g/cm3×50cm3+x)×20% x=358.8g。
故答案为:
(1)ACBED;95;
(2)凹液面的最低;
(3)358.8。
21.【解答】解:(1)溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;
(2)用托盘天平称量5g固体药品NaCl时,步骤是:调节天平平衡,在右盘上加砝码和拨动游码,然后向左边托盘添加药品直至天平平衡;称量过程中他发现指针偏左了,说明NaCl的质量大于砝码质量,应减少NaCl。
(3)A、称量好的NaCl固体倒入烧杯时,有少许洒出,溶质偏少,则使溶质质量分数偏小,故选项正确。
B、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项不正确。
C、溶解NaCl固体的烧杯内壁有水珠,多取了水,则使溶质质量分数偏小,故选项正确。
D、将5g NaCl固体完全溶解在100g水中,溶液质量大于100g,溶质质量分数偏小,故选项正确。
故答案为:(1)5,95,100;(2)B;(3)ACD。
四、计算题。
22.【解答】解:(1)KNO3中钾、氮、氧元素的质量比为39:14:(16×3)=39:14:48,故填:39:14:48;
(2)配制150kg该营养液,需要硝酸钾的质量=150kg×5%=7.5kg;故填:7.5;
(3)设需要加入硝酸钾的质量为x,则
x≈8.3kg
答:需要加入8.3kg的硝酸钾
同课章节目录
