苏教化学必修2专题2第二单元 化学反应中的能量(共25张PPT)
文档属性
| 名称 | 苏教化学必修2专题2第二单元 化学反应中的能量(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 21:49:21 | ||
图片预览







文档简介
(共25张PPT)
第二单元 化学反应中的热量
高一年级第二学期 苏教版 高中化学 必修2
2006年9月5日,从北京开往拉萨的T27次列车,载着2000盒试销的“自热米饭”,沿着“天路”开往青藏高原。所谓“自熟米饭”,即不用明火和电力便可将冷饭加热,将生米煮成熟饭的一种快餐。
报导:
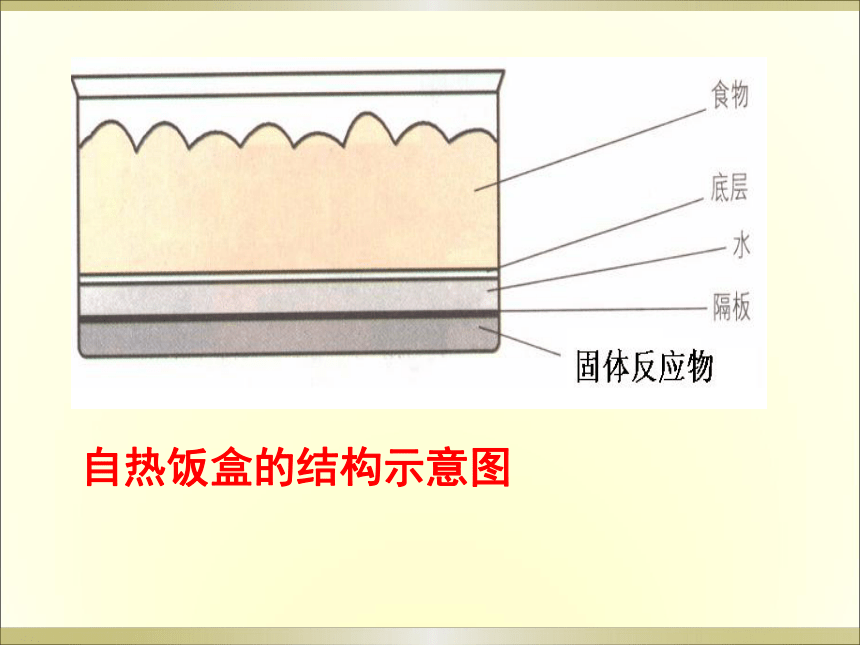
自热饭盒的结构示意图
镁条的燃烧
闪电时产生氮氧化物
*
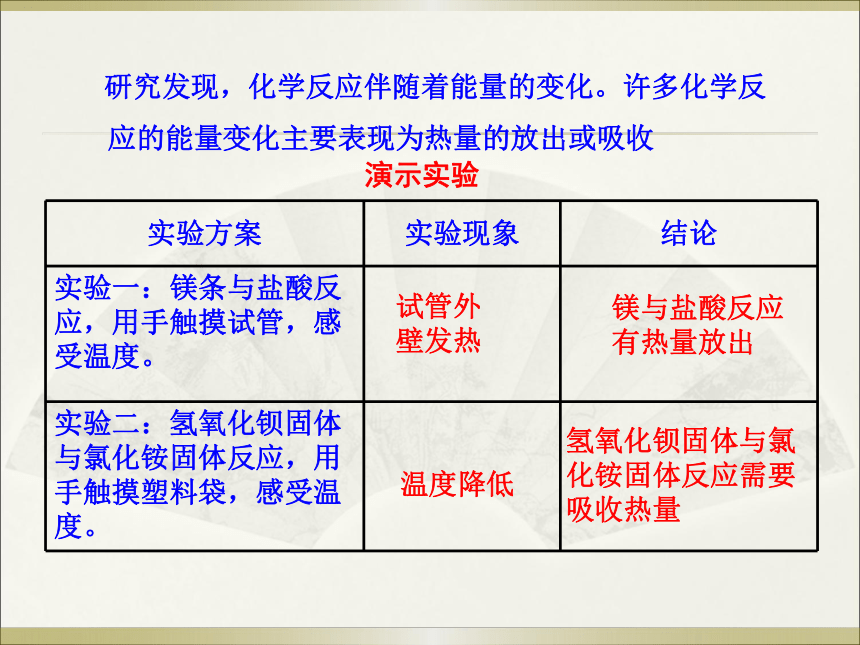
研究发现,化学反应伴随着能量的变化。许多化学反应的能量变化主要表现为热量的放出或吸收
试管外
壁发热
镁与盐酸反应
有热量放出
温度降低
氢氧化钡固体与氯化铵固体反应需要吸收热量
演示实验
实验方案 实验现象 结论
实验一:镁条与盐酸反应,用手触摸试管,感受温度。
实验二:氢氧化钡固体与氯化铵固体反应,用手触摸塑料袋,感受温度。
吸热反应:有吸收热量的化学反应。
一、放热反应与吸热反应
放热反应:有热量放出的化学反应。
交流与讨论:
课本35页
下列反应是放热反应?是吸热反应?
①镁条的燃烧
②高温煅烧石灰石
③氧化钙与水的反应
④盐酸与氢氧化钠的中和反应
*
常见的放热反应 吸热反应
(1)金属与酸的反应或金属与水的反应
(2)所有燃烧反应
(3)酸碱中和反应
(4)大多数化合反应
(5)铝热反应
(2)氢氧化钡、氢氧化钙与铵盐的反应
(3)特例:C(s) + CO2(g) == 2CO(g)
C(s) + H2O(g) ==CO(g) + H2(g) …
高温
(1)大多数分解反应
如:CaCO3(s) == CaO(s) +CO2(g)
高温
高温
疑问
为什么有的反应放出热量,而有的反应吸收热量?
从微观角度分析
反应的能量示意图
化学反应的实质是:旧键的断裂*新键的形成
原子的重新组合
吸收能量436.4kJ/mol
结论:1mol H2与1mol Cl2反应生成2mol HCl时,放出184.5kJ
的热量
吸收能量242.7kJ/mol
放出能量431.8×2kJ/mol
能量守恒
宏观角度
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量=反应物的总能量+吸收的热量
放热反应
吸热反应
放热反应
吸热反应
化学反应的过程,也可以看成是能量的“释放”或“贮存”的过程。
因为能量降低,所以用“-”表示
因为能量升高,所以用“+”表示
①2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ ? mol-1
②H2(g) + I2(s) = 2HI (g) △H = + 53 .0kJ ? mol-1
判断下列反应是放热反应还是吸热反应?
③ H2(g) + I2(s) = HI (g) △H = + 26.5kJ ? mol-1
疑问
如何表示反应中放出或者吸收的热量呢?
热化学方程式
热化学方程式
1.定义:表明反应所放出或吸收的热量多少的化学方程式,叫做热化学方程式。例如:
H2(g)+Cl2(g) ==== 2HCl(g);△H=-184.6 kJ/mol
①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1
课堂练习2:
③ C(s) + O2(g) = CO2 (g)
△H = + 393 .6kJ ? mol-1
判断下列热化学反应方程式书写是否正确?
×
×
×
课堂练习3:
H2(g)+1/2O2(g)=H2O(l) △H = a kJ/mol
根据:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol
你能推算a=?
H2O(l)=H2(g)+1/2O2(g) △H = b kJ/mol
想想:b=?
b=-a = +285.8
a =-285.8
1.下列反应中生成物的总能量高于反应物总能量的是
( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉和氧化铁粉末反应
D.氧化钙溶于水
A
2.关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.放热反应在常温下一定能发生
C.吸热反应在常温下不一定不能发生
D.反应物的总能量高于生成物的总能量时,发生放热反应
AB
*
3
3.下列热化学方程式书写正确的是( )
A.2SO2 + O2 ==== 2SO3 △H=-196.6 kJ/mol
B.H2(g)+O2(g) ==== H2O (g) △H=-241.8 kJ
C.2H2(g)+O2(g) ==== 2H2O(l) △H=-571.6 kJ/mol
D.C(s) + O2(g) ==== CO2(g) △H= + 393.5 kJ/mol
C
4.在101kPa时,2mol甲烷燃烧生成二氧化碳和液态水,放出1780kJ的热量,写出甲烷燃烧的热化学方程式
这节课你有什么收获?
1.能量转化的方式,特别是化学能与 热能的相互转化。
2.化学键的断裂和形成是化学反应中 能量变化的主要原因。
3.学会热化学方程式的书写,学会判
定放热反应和吸热反应。
第二单元 化学反应中的热量
高一年级第二学期 苏教版 高中化学 必修2
2006年9月5日,从北京开往拉萨的T27次列车,载着2000盒试销的“自热米饭”,沿着“天路”开往青藏高原。所谓“自熟米饭”,即不用明火和电力便可将冷饭加热,将生米煮成熟饭的一种快餐。
报导:
自热饭盒的结构示意图
镁条的燃烧
闪电时产生氮氧化物
*
研究发现,化学反应伴随着能量的变化。许多化学反应的能量变化主要表现为热量的放出或吸收
试管外
壁发热
镁与盐酸反应
有热量放出
温度降低
氢氧化钡固体与氯化铵固体反应需要吸收热量
演示实验
实验方案 实验现象 结论
实验一:镁条与盐酸反应,用手触摸试管,感受温度。
实验二:氢氧化钡固体与氯化铵固体反应,用手触摸塑料袋,感受温度。
吸热反应:有吸收热量的化学反应。
一、放热反应与吸热反应
放热反应:有热量放出的化学反应。
交流与讨论:
课本35页
下列反应是放热反应?是吸热反应?
①镁条的燃烧
②高温煅烧石灰石
③氧化钙与水的反应
④盐酸与氢氧化钠的中和反应
*
常见的放热反应 吸热反应
(1)金属与酸的反应或金属与水的反应
(2)所有燃烧反应
(3)酸碱中和反应
(4)大多数化合反应
(5)铝热反应
(2)氢氧化钡、氢氧化钙与铵盐的反应
(3)特例:C(s) + CO2(g) == 2CO(g)
C(s) + H2O(g) ==CO(g) + H2(g) …
高温
(1)大多数分解反应
如:CaCO3(s) == CaO(s) +CO2(g)
高温
高温
疑问
为什么有的反应放出热量,而有的反应吸收热量?
从微观角度分析
反应的能量示意图
化学反应的实质是:旧键的断裂*新键的形成
原子的重新组合
吸收能量436.4kJ/mol
结论:1mol H2与1mol Cl2反应生成2mol HCl时,放出184.5kJ
的热量
吸收能量242.7kJ/mol
放出能量431.8×2kJ/mol
能量守恒
宏观角度
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量=反应物的总能量+吸收的热量
放热反应
吸热反应
放热反应
吸热反应
化学反应的过程,也可以看成是能量的“释放”或“贮存”的过程。
因为能量降低,所以用“-”表示
因为能量升高,所以用“+”表示
①2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ ? mol-1
②H2(g) + I2(s) = 2HI (g) △H = + 53 .0kJ ? mol-1
判断下列反应是放热反应还是吸热反应?
③ H2(g) + I2(s) = HI (g) △H = + 26.5kJ ? mol-1
疑问
如何表示反应中放出或者吸收的热量呢?
热化学方程式
热化学方程式
1.定义:表明反应所放出或吸收的热量多少的化学方程式,叫做热化学方程式。例如:
H2(g)+Cl2(g) ==== 2HCl(g);△H=-184.6 kJ/mol
①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1
课堂练习2:
③ C(s) + O2(g) = CO2 (g)
△H = + 393 .6kJ ? mol-1
判断下列热化学反应方程式书写是否正确?
×
×
×
课堂练习3:
H2(g)+1/2O2(g)=H2O(l) △H = a kJ/mol
根据:2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ/mol
你能推算a=?
H2O(l)=H2(g)+1/2O2(g) △H = b kJ/mol
想想:b=?
b=-a = +285.8
a =-285.8
1.下列反应中生成物的总能量高于反应物总能量的是
( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉和氧化铁粉末反应
D.氧化钙溶于水
A
2.关于吸热反应和放热反应,下列说法错误的是( )
A.需要加热才能进行的化学反应一定是吸热反应
B.放热反应在常温下一定能发生
C.吸热反应在常温下不一定不能发生
D.反应物的总能量高于生成物的总能量时,发生放热反应
AB
*
3
3.下列热化学方程式书写正确的是( )
A.2SO2 + O2 ==== 2SO3 △H=-196.6 kJ/mol
B.H2(g)+O2(g) ==== H2O (g) △H=-241.8 kJ
C.2H2(g)+O2(g) ==== 2H2O(l) △H=-571.6 kJ/mol
D.C(s) + O2(g) ==== CO2(g) △H= + 393.5 kJ/mol
C
4.在101kPa时,2mol甲烷燃烧生成二氧化碳和液态水,放出1780kJ的热量,写出甲烷燃烧的热化学方程式
这节课你有什么收获?
1.能量转化的方式,特别是化学能与 热能的相互转化。
2.化学键的断裂和形成是化学反应中 能量变化的主要原因。
3.学会热化学方程式的书写,学会判
定放热反应和吸热反应。
