苏教化学必修2专题3第一单元 化石燃料与有机化合物(共20张PPT)
文档属性
| 名称 | 苏教化学必修2专题3第一单元 化石燃料与有机化合物(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 254.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 00:00:00 | ||
图片预览







文档简介
(共20张PPT)
观察思考,回答问题
同学们:我们观察到铜丝____色,在酒精
灯外焰上加热,会看到铜丝变为__色,
再把变色的铜丝放进无水乙醇中会看
到____________________________。
黑
黑色的铜丝又变成红色
红
写出上述有关的化学反应方程式:
1、______________________
2、______________________
3、铜在实验中起到了___作用
4、在实验中生成了一种有___气
味的物质:_________。
2Cu+O2=2CuO
CH3CH2OH+CuO=CH3CHO+Cu+H2O
催化剂
刺激性
CH3CHO
第一节:乙醛、醛类的性质
学习目标:
1、了解乙醛的组成、结构特点
2、探究乙醛的主要化学性质
3、掌握甲醛的结构,了解甲醛在日常生活中应用,以及对人体健康的危害。
本节课的知识线索是:熟练书写甲醛、乙醛的分子式、结构式---了解物理性质----探究化学性质---查阅用途
主题一、甲醛、乙醛的结构特点和物理性质
1、甲醛和乙醛的结构特点
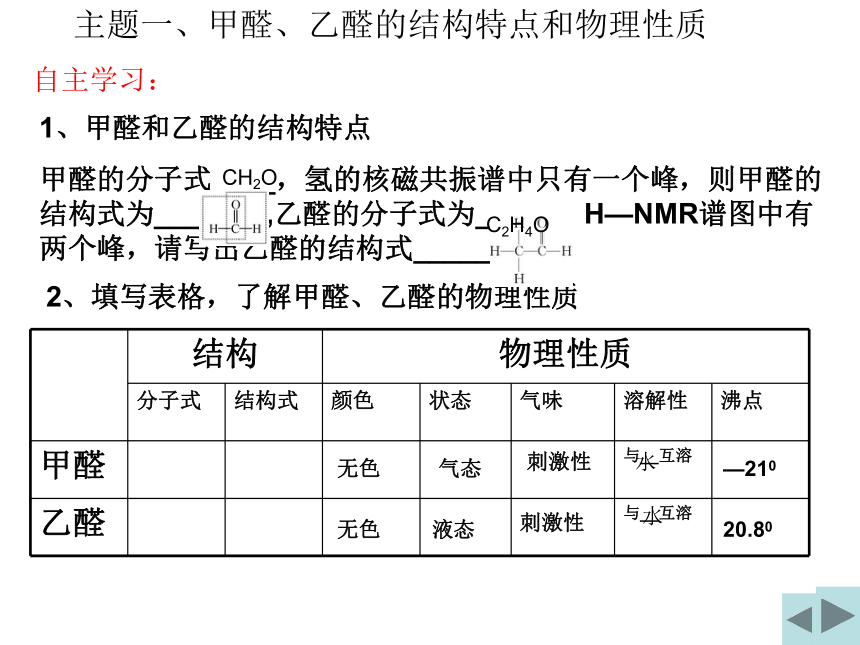
甲醛的分子式____,氢的核磁共振谱中只有一个峰,则甲醛的结构式为_______,乙醛的分子式为_____,H—NMR谱图中有两个峰,请写出乙醛的结构式_________。
2、填写表格,了解甲醛、乙醛的物理性质
自主学习:
无色
无色
液态
气态
刺激性
刺激性
水
水
—210
20.80
CH2O
C2H4O
结构 物理性质
分子式 结构式 颜色 状态 气味 溶解性 沸点
甲醛 与__互溶
乙醛 与__互溶
思考探究:
1、甲醛和乙醛分子结构中都含有的官能团的结构式:_____书写结构简式时必须能够体现物质的结构特点,醛基的结构简式为________,而不要写成
—COH或CHO---。
2、由乙烯的平面结构可知,双键及与双键相连的原子都在同一平面上,推测甲醛的空间构型为________,乙醛最多有几个原子在同一平面上?____
3、请写出C4H8O的属于醛类的同分异构体
________________________________________
—CHO
平面型
5个
CH3CH2CH2CHO
CH3CH(CH3)CHO
主题二、乙醛的化学性质
1、氧化反应(得氧去氢是氧化)
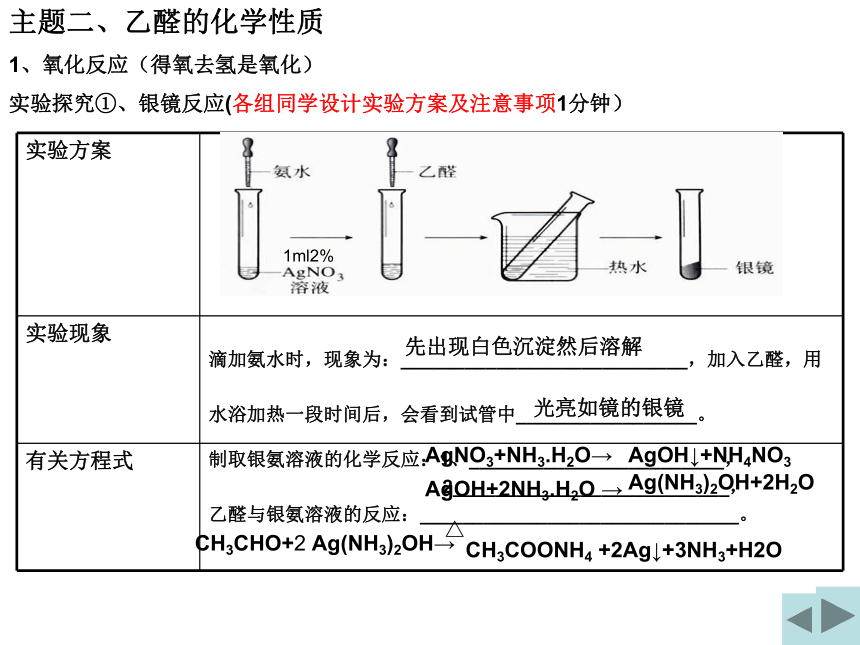
实验探究①、银镜反应(各组同学设计实验方案及注意事项1分钟)
先出现白色沉淀然后溶解
光亮如镜的银镜
AgNO3+NH3.H2O→
AgOH+2NH3.H2O →
1ml2%
AgOH↓+NH4NO3
Ag(NH3)2OH+2H2O
CH3COONH4 +2Ag↓+3NH3+H2O
实验方案
实验现象
滴加氨水时,现象为:___________________________,加入乙醛,用
水浴加热一段时间后,会看到试管中_________________。
有关方程式 制取银氨溶液的化学反应:1、________________________,
2__________________________,
乙醛与银氨溶液的反应:______________________________。
银镜反应
1、 配置银氨溶液:取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
注意:银镜反应要求在碱性环境下进行,
但氨水不应过量太多
2、水浴加热形成银镜:在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
说明:1、碱性环境下,乙醛被氧化成乙酸后又与 NH3反应生成乙酸铵
2、1mol–CHO被氧化,就应有?molAg被还原
3、可用 ? 清洗试管内壁的银镜
注意:水浴加热时不可振荡和摇动试管
4、应用:检验醛基的存在,工业上用来制瓶胆和镜子
实验探究②、乙醛与新制的氢氧化铜反应
应用:葡萄糖分子中含有醛基,请你设计方案检验病人是否患糖尿病?
蓝色沉淀
砖红色沉淀
CuSO4+2NaOH=
操作步骤:
Cu(OH)2 ↓ +Na2SO4
Cu2O↓+CH3COONa+2H2O
实验方案
实验现象 a中溶液出现____________,滴入乙醛,加热沸腾后,c中溶液有______
出现。
有关方程式 a中_____________________。
c中_____________________。
③:乙醛的催化氧化
乙醛在有催化剂加热的条件下可以被氧气氧化成乙酸,反应的化学方程式为
_________________________________________
④乙醛可以燃烧,化学方程式为________________
2CH3CHO+5O2=4CO2+4H2O
催化氧化的断键:
2、还原反应(得氢去氧是还原)
有机物中的双键与氢气加成反应属于还原反应,
写出乙醛与H2发生还原反应的化学方程式
_____________________________________________
还原反应的断键部位:
思考探究
结合乙醛的性质思考并探究乙醛能否使酸性KMnO4溶液或溴水褪色?为什么?
能。银氨溶液、新制氢氧化铜悬浊液的氧化性是很弱的,乙醛能被弱氧化剂氧化,原因是乙醛具有较强的还原性。由此推知,乙醛也易被酸性KMnO4溶液、溴水等强氧化剂氧化,酸性KMnO4溶液、溴水因被还原而褪色。。
同学们:实践是检验真理的唯一标准。
课堂小结:
乙酸
氧化
乙醛
还原
氧化
乙醇
主题三、甲醛的化学性质和用途
自主学习(根据乙醛的性质知识迁移,学以致用)
1、写出甲醛的结构式,仔细观察并写出下列有关化学方程式:
甲醛与新制的银氨溶液反应
提示_____________________
_________________________
甲醛与新制的Cu(OH)2的反应的化学方程式
_____________________________
与足量银氨溶液反应:
HCHO+4[Ag(NH3)2]OH→ (NH4)2CO3+4Ag↓+6NH3+2H2O
甲醛与H2的还原反应方程式:
_______________________________________
2、甲醛的用途
甲醛俗称____,35%--45%的甲醛水溶液俗称______,具有杀菌、消毒、防腐能力。
甲醛常与苯酚合成高分子化合物酚醛树脂,在盐酸作催化剂的条件下,可以合成线型酚醛树脂,有关化学方程式为:
_____________________________________
HCHO+H2→CH3OH
蚁醛
福尔马林溶液
同学们:由于我家的楼房新装修,用了许多建筑材料,包括合成木板、胶、漆等,使得我与甲醛亲密地接触了好长一段时间,深深地领教了甲醛本领,同学们课下时查阅资料讨论如何处理甲醛污染,得出好方法记得告诉我!
电话:13722410365
专题四:典型例题
【典例1】(2010·十堰高二检测)某同学做乙醛的性质实验时,取1 mol/L的CuSO4溶液和0.5 mol/L的NaOH溶液各1 mL,在一支洁净的试管内混合后,向其中又加入0.5 mL 40%的乙醛,加热煮沸,结果未出现红色沉淀。实验失败的原因可能是 ( )
A.反应温度不够高
B.加入NaOH溶液的量不够
C.加入乙醛太多
D.加入CuSO4溶液的量不够
B
典例2.居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料释放出的一种刺激性气味气体,该气体是 ( )
A.甲烷 B.氨气 C.甲醛 D.二氧化硫
典例3.(2010·十堰高二检测)下列各组物质中,用分液漏斗可以将其分开的是( )
A.甲苯和苯酚 B.乙醇和乙醛
C.硝基苯和水 D.乙酸和乙酸乙酯
C
C
典例4.丙烯醛结构简式为CH2=CH—CHO,下列关于它的叙述不正确的是( )
A.能发生银镜反应,表现氧化性
B.能使溴水或酸性KMnO4溶液褪色
C.在一定条件下能被氧气氧化
D.在一定条件下与H2反应生成1-丙醇
课堂检测:完成课堂检测题
A
同学们
观察思考,回答问题
同学们:我们观察到铜丝____色,在酒精
灯外焰上加热,会看到铜丝变为__色,
再把变色的铜丝放进无水乙醇中会看
到____________________________。
黑
黑色的铜丝又变成红色
红
写出上述有关的化学反应方程式:
1、______________________
2、______________________
3、铜在实验中起到了___作用
4、在实验中生成了一种有___气
味的物质:_________。
2Cu+O2=2CuO
CH3CH2OH+CuO=CH3CHO+Cu+H2O
催化剂
刺激性
CH3CHO
第一节:乙醛、醛类的性质
学习目标:
1、了解乙醛的组成、结构特点
2、探究乙醛的主要化学性质
3、掌握甲醛的结构,了解甲醛在日常生活中应用,以及对人体健康的危害。
本节课的知识线索是:熟练书写甲醛、乙醛的分子式、结构式---了解物理性质----探究化学性质---查阅用途
主题一、甲醛、乙醛的结构特点和物理性质
1、甲醛和乙醛的结构特点
甲醛的分子式____,氢的核磁共振谱中只有一个峰,则甲醛的结构式为_______,乙醛的分子式为_____,H—NMR谱图中有两个峰,请写出乙醛的结构式_________。
2、填写表格,了解甲醛、乙醛的物理性质
自主学习:
无色
无色
液态
气态
刺激性
刺激性
水
水
—210
20.80
CH2O
C2H4O
结构 物理性质
分子式 结构式 颜色 状态 气味 溶解性 沸点
甲醛 与__互溶
乙醛 与__互溶
思考探究:
1、甲醛和乙醛分子结构中都含有的官能团的结构式:_____书写结构简式时必须能够体现物质的结构特点,醛基的结构简式为________,而不要写成
—COH或CHO---。
2、由乙烯的平面结构可知,双键及与双键相连的原子都在同一平面上,推测甲醛的空间构型为________,乙醛最多有几个原子在同一平面上?____
3、请写出C4H8O的属于醛类的同分异构体
________________________________________
—CHO
平面型
5个
CH3CH2CH2CHO
CH3CH(CH3)CHO
主题二、乙醛的化学性质
1、氧化反应(得氧去氢是氧化)
实验探究①、银镜反应(各组同学设计实验方案及注意事项1分钟)
先出现白色沉淀然后溶解
光亮如镜的银镜
AgNO3+NH3.H2O→
AgOH+2NH3.H2O →
1ml2%
AgOH↓+NH4NO3
Ag(NH3)2OH+2H2O
CH3COONH4 +2Ag↓+3NH3+H2O
实验方案
实验现象
滴加氨水时,现象为:___________________________,加入乙醛,用
水浴加热一段时间后,会看到试管中_________________。
有关方程式 制取银氨溶液的化学反应:1、________________________,
2__________________________,
乙醛与银氨溶液的反应:______________________________。
银镜反应
1、 配置银氨溶液:取一洁净试管,加入2ml2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解。
注意:银镜反应要求在碱性环境下进行,
但氨水不应过量太多
2、水浴加热形成银镜:在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管放在热水浴中静置。
说明:1、碱性环境下,乙醛被氧化成乙酸后又与 NH3反应生成乙酸铵
2、1mol–CHO被氧化,就应有?molAg被还原
3、可用 ? 清洗试管内壁的银镜
注意:水浴加热时不可振荡和摇动试管
4、应用:检验醛基的存在,工业上用来制瓶胆和镜子
实验探究②、乙醛与新制的氢氧化铜反应
应用:葡萄糖分子中含有醛基,请你设计方案检验病人是否患糖尿病?
蓝色沉淀
砖红色沉淀
CuSO4+2NaOH=
操作步骤:
Cu(OH)2 ↓ +Na2SO4
Cu2O↓+CH3COONa+2H2O
实验方案
实验现象 a中溶液出现____________,滴入乙醛,加热沸腾后,c中溶液有______
出现。
有关方程式 a中_____________________。
c中_____________________。
③:乙醛的催化氧化
乙醛在有催化剂加热的条件下可以被氧气氧化成乙酸,反应的化学方程式为
_________________________________________
④乙醛可以燃烧,化学方程式为________________
2CH3CHO+5O2=4CO2+4H2O
催化氧化的断键:
2、还原反应(得氢去氧是还原)
有机物中的双键与氢气加成反应属于还原反应,
写出乙醛与H2发生还原反应的化学方程式
_____________________________________________
还原反应的断键部位:
思考探究
结合乙醛的性质思考并探究乙醛能否使酸性KMnO4溶液或溴水褪色?为什么?
能。银氨溶液、新制氢氧化铜悬浊液的氧化性是很弱的,乙醛能被弱氧化剂氧化,原因是乙醛具有较强的还原性。由此推知,乙醛也易被酸性KMnO4溶液、溴水等强氧化剂氧化,酸性KMnO4溶液、溴水因被还原而褪色。。
同学们:实践是检验真理的唯一标准。
课堂小结:
乙酸
氧化
乙醛
还原
氧化
乙醇
主题三、甲醛的化学性质和用途
自主学习(根据乙醛的性质知识迁移,学以致用)
1、写出甲醛的结构式,仔细观察并写出下列有关化学方程式:
甲醛与新制的银氨溶液反应
提示_____________________
_________________________
甲醛与新制的Cu(OH)2的反应的化学方程式
_____________________________
与足量银氨溶液反应:
HCHO+4[Ag(NH3)2]OH→ (NH4)2CO3+4Ag↓+6NH3+2H2O
甲醛与H2的还原反应方程式:
_______________________________________
2、甲醛的用途
甲醛俗称____,35%--45%的甲醛水溶液俗称______,具有杀菌、消毒、防腐能力。
甲醛常与苯酚合成高分子化合物酚醛树脂,在盐酸作催化剂的条件下,可以合成线型酚醛树脂,有关化学方程式为:
_____________________________________
HCHO+H2→CH3OH
蚁醛
福尔马林溶液
同学们:由于我家的楼房新装修,用了许多建筑材料,包括合成木板、胶、漆等,使得我与甲醛亲密地接触了好长一段时间,深深地领教了甲醛本领,同学们课下时查阅资料讨论如何处理甲醛污染,得出好方法记得告诉我!
电话:13722410365
专题四:典型例题
【典例1】(2010·十堰高二检测)某同学做乙醛的性质实验时,取1 mol/L的CuSO4溶液和0.5 mol/L的NaOH溶液各1 mL,在一支洁净的试管内混合后,向其中又加入0.5 mL 40%的乙醛,加热煮沸,结果未出现红色沉淀。实验失败的原因可能是 ( )
A.反应温度不够高
B.加入NaOH溶液的量不够
C.加入乙醛太多
D.加入CuSO4溶液的量不够
B
典例2.居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料释放出的一种刺激性气味气体,该气体是 ( )
A.甲烷 B.氨气 C.甲醛 D.二氧化硫
典例3.(2010·十堰高二检测)下列各组物质中,用分液漏斗可以将其分开的是( )
A.甲苯和苯酚 B.乙醇和乙醛
C.硝基苯和水 D.乙酸和乙酸乙酯
C
C
典例4.丙烯醛结构简式为CH2=CH—CHO,下列关于它的叙述不正确的是( )
A.能发生银镜反应,表现氧化性
B.能使溴水或酸性KMnO4溶液褪色
C.在一定条件下能被氧气氧化
D.在一定条件下与H2反应生成1-丙醇
课堂检测:完成课堂检测题
A
同学们
