苏教化学必修2专题2第二单元 化学反应中的能量(共26张PPT)
文档属性
| 名称 | 苏教化学必修2专题2第二单元 化学反应中的能量(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 503.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 21:58:04 | ||
图片预览






文档简介
(共28张PPT)
化学变化中除有新物质生成外,必然伴随有能量(热能、光能、电能)的变化。
利用化学反应:一是制取物质
二是利用反应中的能量
化学反应中的能量变化通常表现为热量的变化。
第二单元 化学反应中的热量
思考:请同学们列举你了解的在生活中应用到
的化学反应中的能量
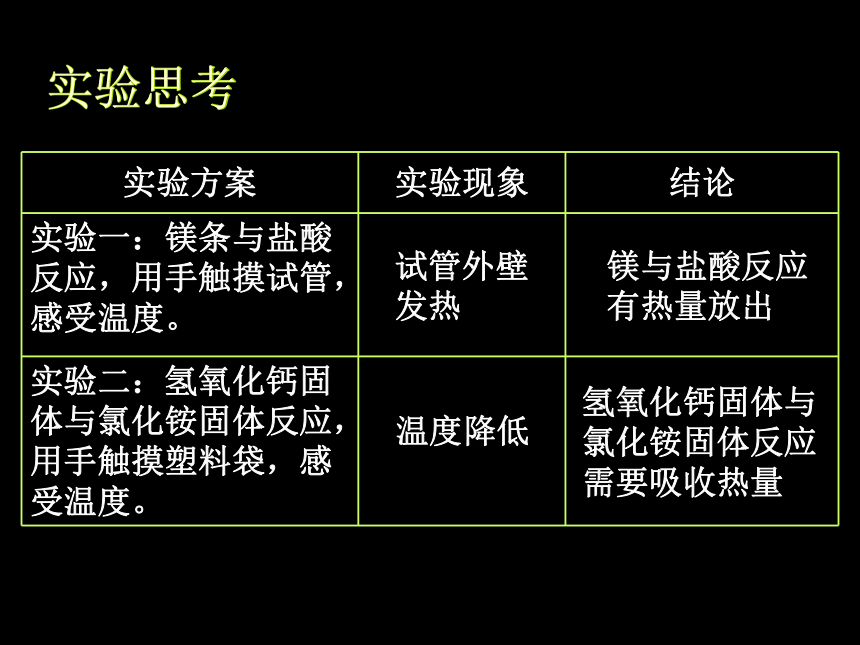
实验思考
试管外壁
发热
镁与盐酸反应
有热量放出
温度降低
氢氧化钙固体与
氯化铵固体反应
需要吸收热量
实验思考
实验方案 实验现象 结论
实验一:镁条与盐酸反应,用手触摸试管,感受温度。
实验二:氢氧化钙固体与氯化铵固体反应,用手触摸塑料袋,感受温度。
放热反应:有热量放出的化学反应
吸热反应:吸收热量的化学反应
1.放热反应和吸热反应
一、化学反应中的热量变化
第二单元 化学反应中的热量
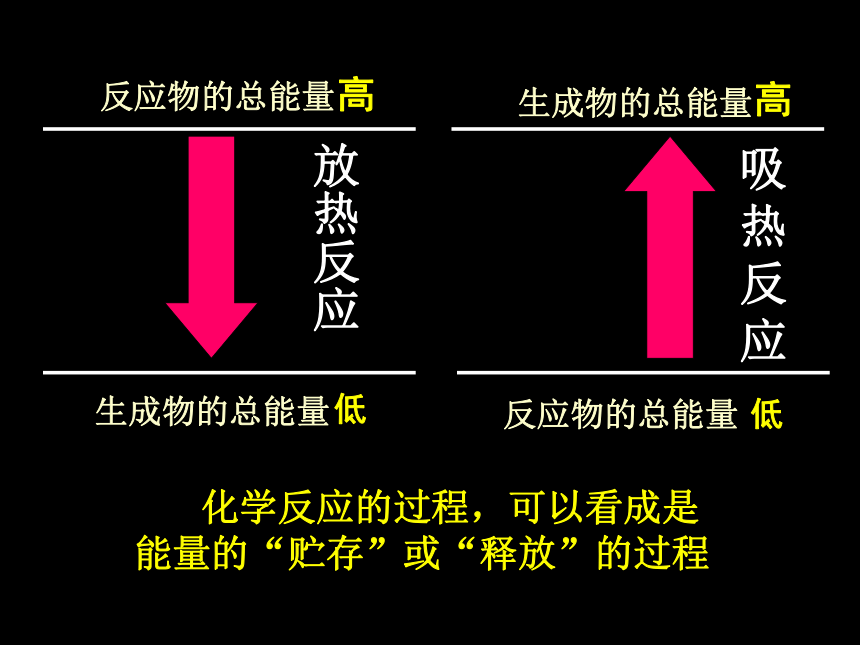
反应物的总能量
生成物的总能量
放热反应
生成物的总能量
反应物的总能量
吸热反应
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
高
低
高
低
如果反应物所具有的总能量大于生成物所具有的总能量,在发生化学反应时放出热量,规定△H符号为“-”或 △H<0
2.化学反应中能量变化的本质原因
如果反应物所具有的总能量小于生成物所具有的总能量,在发生化学反应时吸收热量,规定△H符号为“+”或 △H>0
第二单元 化学反应中的热量
一、化学反应中的热量变化
反应热△H :在化学反应过程中放出或吸收的热量。
3.常见的放热反应和吸热反应
第二单元 化学反应中的热量
一、化学反应中的热量变化
放热反应
燃料的燃烧
中和反应
金属与酸
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2·8H2O+NH4Cl
大多数能自发进行
的化学反应。
持续高温或加热的反应、
放热反应的逆反应。
1、判断下列是放热反应还是吸热反应:
1) 镁条的燃烧
2) 浓硫酸的稀释
3) 高温下木炭与二氧化碳反应生成一氧化碳
4) 氧化钙与水的反应
5) 高温煅烧石灰石
6) 炸药爆炸
7) NaOH 和 NH4Cl的反应
问题解决:
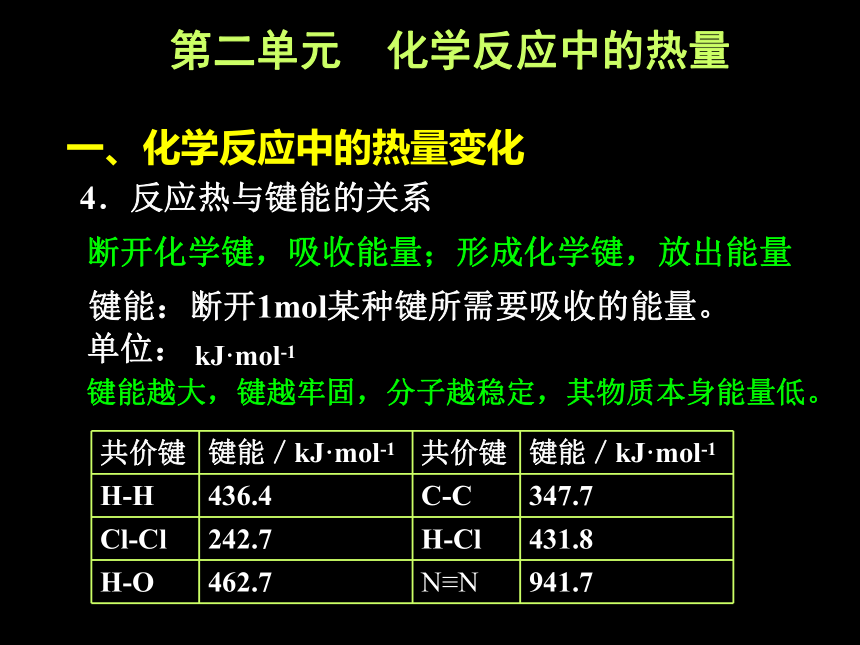
4.反应热与键能的关系
断开化学键,吸收能量;形成化学键,放出能量
一、化学反应中的热量变化
第二单元 化学反应中的热量
键能:断开1mol某种键所需要吸收的能量。
键能越大,键越牢固,分子越稳定,其物质本身能量低。
单位:
kJ·mol-1
共价键 键能/kJ·mol-1 共价键 键能/kJ·mol-1
H-H 436.4 C-C 347.7
Cl-Cl 242.7 H-Cl 431.8
H-O 462.7 N≡N 941.7
H2 + Cl2 =2HCl
旧键断裂
+
+
新键形成
吸收能量
放出能量
反应过程中共吸收能量
=436.4kJ+242.7kJ=679.1kJ
反应过程中共放出能量=2×431.8kJ=863.6kJ
则反应最终放出能量863.6kJ-679.1kJ=184.5kJ
则△H= -184.5kJ·mol-1
共价键 键能/kJ·mol-1 共价键 键能/kJ·mol-1
H-H 436.4 Cl-Cl 242.7
H-Cl 431.8
已知拆开1molH-H键需消耗436kJ能量、拆开1molO=O键需消耗496kJ能量、形成1molH-O键需释放463kJ能量。从化学键的角度分析反应:2H2+O2=2H2O的热效应。
1368
1852
484
生成物的总键能
反成物的总键能
△H的绝对值
=反应物的总键能-生成物的总键能
反应热△H
1、下列说法正确的是
A. 需加热才能发生的反应一定是吸热反应
B. 放热的反应在常温下一定易进行
C. 反应是放热还是吸热是由反应物和生成物所具
有的能量的相对大小决定的
D. 吸热反应在一定条件下也进行
随堂练习
2、下列各图中,表示反应是吸热反应的图是
随堂练习
3、已知破坏各1mol N≡N键、H—H键和N—H键分别需吸收的能量为946kJ、436kJ、391kJ。计算1molN2(g)和3molH2(g)完全转化为NH3(g)的反应热的理论值为 。
随堂练习
4、(1)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应过程可看成___________________
___________________________。
(2)中和反应都是______热反应,其实质是___________________________________________
__________ 。
放
贮存在物质内部的能量转化为热量释放出来
放
酸电离出来的H+与碱电离出来的OH-结合生成了弱电解质
随堂练习
5、如右图所示,把试管放入盛有25℃时
饱和石灰水的烧杯中,试管中开始放
入几小块镁片,再用滴管滴入5mL盐
酸于试管中.试回答下列问题:
(1)实验中观察到的现象是_________
______________________________.
(2)产生上述现象的原因___________________________________________.
(3)写出有关反应的离子方程式________________________.
(4)由实验推知,MgCl2溶液和H2的总能量_________ (填“大于、“小于”、“等于”)镁片和盐酸的总能量.
随堂练习
H2(g) + Cl2(g)=2HCl(g) △H = - 184.6kJ·mol-1
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式
2H2(g) + O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
2H2(g) + O2(g)= 2H2O(l) △H=-571.6 kJ·mol-1
结论:同种物质聚集状态不同,能量不同
2H2(g) + O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
H2(g) +1/2O2(g)= H2O(l) △H=-285.8 kJ·mol-1
结论:
△H 的值与化学计量数成正比
化学计量数只表示物质的量,可用分数
第二单元 化学反应中的热量
3. 书写热化学方程式注意事项:
(a)要标明其聚集状态。
(b)放热时△H为负,吸热时为正
(c)各物质前的化学计量数不表示分子个数,只
表示物质的量,因此可为分数。
(d)对于相同物质的反应,当化学计量数不同时,
其△H 也不同,即△H 的值与计量数成正比。
第二单元 化学反应中的热量
二、热化学方程式
H2(g) +1/2O2(g)= H2O(g) △H=-241.8 kJ·mol-1
2. 含义:表示1mol气态氢气与1/2 mol气态氧气
反应生成1mol水蒸气,放出241.8kJ的热量。
下列热化学方程式书写正确的是
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
C
问题解决:
在相同条件下,比较下列热化学方程式
问题解决:
Q1= Q2
Q3 < Q4
2Q5 < Q6
[ 例1 ] 25oC ,1.01×105Pa下,1g 硫粉在氧气
中充分燃烧放出 9.36kJ热量,写出硫
燃烧的热化学方程式。
1g 硫粉在氧气中充分燃烧放出 9. 36kJ 热量
32g ×9.36kJ /g = 299.52 kJ
1 mol 硫粉在氧气中充分燃烧放出热量为:
S (s) + O2 (g) = SO2 (g) △H =-299.52 kJ ?mol-1
S + O2 = SO2
3. 有关热化学方程式的计算
二、热化学方程式
第二单元 化学反应中的热量
[ 练习1 ] 250C,1.01×105Pa下,4g CO在氧气中燃
烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学
方程式。
2CO (g) + O2 (g) = 2CO2 (g) △H =- 134.4 kJ ? mol-1
2CO + O2 = 2CO2
2×28g
Q
9.6kJ
4 g
解: 设2mol CO 燃烧放出的热量为 Q
2×28g : 4g = Q : 9.6 kJ
Q =134.4 kJ
放热
① 现今用的燃料是什么?主要是什么?
② 燃料充分燃烧的条件有哪些?
③ 燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④ 导致酸雨的主要原因之一是什么?
⑤ 怎样高效、清洁地利用煤炭?
⑥ 怎样提高固体和液体燃料的燃烧效率?
三、燃料的充分燃烧
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面
煤中所含硫在燃烧时会生成SO2
要有适当过量的空气
燃料与空气要有足够大的接触面积
高效清洁利用煤炭的重要途径
将焦炭在高温下与水蒸气反应,则得到CO和H2
练习:简要说明使煤炉中的煤充分燃烧所应采取的措施。
打开炉门
在煤饼上打孔或将煤做成煤块
燃烧时要有足够多的空气
燃料与空气要有足够大的接触面
16.6%
2.1%
5.1%
76.2%
我国化石燃料和水电能源消耗构成图
化学变化中除有新物质生成外,必然伴随有能量(热能、光能、电能)的变化。
利用化学反应:一是制取物质
二是利用反应中的能量
化学反应中的能量变化通常表现为热量的变化。
第二单元 化学反应中的热量
思考:请同学们列举你了解的在生活中应用到
的化学反应中的能量
实验思考
试管外壁
发热
镁与盐酸反应
有热量放出
温度降低
氢氧化钙固体与
氯化铵固体反应
需要吸收热量
实验思考
实验方案 实验现象 结论
实验一:镁条与盐酸反应,用手触摸试管,感受温度。
实验二:氢氧化钙固体与氯化铵固体反应,用手触摸塑料袋,感受温度。
放热反应:有热量放出的化学反应
吸热反应:吸收热量的化学反应
1.放热反应和吸热反应
一、化学反应中的热量变化
第二单元 化学反应中的热量
反应物的总能量
生成物的总能量
放热反应
生成物的总能量
反应物的总能量
吸热反应
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
高
低
高
低
如果反应物所具有的总能量大于生成物所具有的总能量,在发生化学反应时放出热量,规定△H符号为“-”或 △H<0
2.化学反应中能量变化的本质原因
如果反应物所具有的总能量小于生成物所具有的总能量,在发生化学反应时吸收热量,规定△H符号为“+”或 △H>0
第二单元 化学反应中的热量
一、化学反应中的热量变化
反应热△H :在化学反应过程中放出或吸收的热量。
3.常见的放热反应和吸热反应
第二单元 化学反应中的热量
一、化学反应中的热量变化
放热反应
燃料的燃烧
中和反应
金属与酸
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2·8H2O+NH4Cl
大多数能自发进行
的化学反应。
持续高温或加热的反应、
放热反应的逆反应。
1、判断下列是放热反应还是吸热反应:
1) 镁条的燃烧
2) 浓硫酸的稀释
3) 高温下木炭与二氧化碳反应生成一氧化碳
4) 氧化钙与水的反应
5) 高温煅烧石灰石
6) 炸药爆炸
7) NaOH 和 NH4Cl的反应
问题解决:
4.反应热与键能的关系
断开化学键,吸收能量;形成化学键,放出能量
一、化学反应中的热量变化
第二单元 化学反应中的热量
键能:断开1mol某种键所需要吸收的能量。
键能越大,键越牢固,分子越稳定,其物质本身能量低。
单位:
kJ·mol-1
共价键 键能/kJ·mol-1 共价键 键能/kJ·mol-1
H-H 436.4 C-C 347.7
Cl-Cl 242.7 H-Cl 431.8
H-O 462.7 N≡N 941.7
H2 + Cl2 =2HCl
旧键断裂
+
+
新键形成
吸收能量
放出能量
反应过程中共吸收能量
=436.4kJ+242.7kJ=679.1kJ
反应过程中共放出能量=2×431.8kJ=863.6kJ
则反应最终放出能量863.6kJ-679.1kJ=184.5kJ
则△H= -184.5kJ·mol-1
共价键 键能/kJ·mol-1 共价键 键能/kJ·mol-1
H-H 436.4 Cl-Cl 242.7
H-Cl 431.8
已知拆开1molH-H键需消耗436kJ能量、拆开1molO=O键需消耗496kJ能量、形成1molH-O键需释放463kJ能量。从化学键的角度分析反应:2H2+O2=2H2O的热效应。
1368
1852
484
生成物的总键能
反成物的总键能
△H的绝对值
=反应物的总键能-生成物的总键能
反应热△H
1、下列说法正确的是
A. 需加热才能发生的反应一定是吸热反应
B. 放热的反应在常温下一定易进行
C. 反应是放热还是吸热是由反应物和生成物所具
有的能量的相对大小决定的
D. 吸热反应在一定条件下也进行
随堂练习
2、下列各图中,表示反应是吸热反应的图是
随堂练习
3、已知破坏各1mol N≡N键、H—H键和N—H键分别需吸收的能量为946kJ、436kJ、391kJ。计算1molN2(g)和3molH2(g)完全转化为NH3(g)的反应热的理论值为 。
随堂练习
4、(1)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应过程可看成___________________
___________________________。
(2)中和反应都是______热反应,其实质是___________________________________________
__________ 。
放
贮存在物质内部的能量转化为热量释放出来
放
酸电离出来的H+与碱电离出来的OH-结合生成了弱电解质
随堂练习
5、如右图所示,把试管放入盛有25℃时
饱和石灰水的烧杯中,试管中开始放
入几小块镁片,再用滴管滴入5mL盐
酸于试管中.试回答下列问题:
(1)实验中观察到的现象是_________
______________________________.
(2)产生上述现象的原因___________________________________________.
(3)写出有关反应的离子方程式________________________.
(4)由实验推知,MgCl2溶液和H2的总能量_________ (填“大于、“小于”、“等于”)镁片和盐酸的总能量.
随堂练习
H2(g) + Cl2(g)=2HCl(g) △H = - 184.6kJ·mol-1
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式
2H2(g) + O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
2H2(g) + O2(g)= 2H2O(l) △H=-571.6 kJ·mol-1
结论:同种物质聚集状态不同,能量不同
2H2(g) + O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
H2(g) +1/2O2(g)= H2O(l) △H=-285.8 kJ·mol-1
结论:
△H 的值与化学计量数成正比
化学计量数只表示物质的量,可用分数
第二单元 化学反应中的热量
3. 书写热化学方程式注意事项:
(a)要标明其聚集状态。
(b)放热时△H为负,吸热时为正
(c)各物质前的化学计量数不表示分子个数,只
表示物质的量,因此可为分数。
(d)对于相同物质的反应,当化学计量数不同时,
其△H 也不同,即△H 的值与计量数成正比。
第二单元 化学反应中的热量
二、热化学方程式
H2(g) +1/2O2(g)= H2O(g) △H=-241.8 kJ·mol-1
2. 含义:表示1mol气态氢气与1/2 mol气态氧气
反应生成1mol水蒸气,放出241.8kJ的热量。
下列热化学方程式书写正确的是
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
C
问题解决:
在相同条件下,比较下列热化学方程式
问题解决:
Q1= Q2
Q3 < Q4
2Q5 < Q6
[ 例1 ] 25oC ,1.01×105Pa下,1g 硫粉在氧气
中充分燃烧放出 9.36kJ热量,写出硫
燃烧的热化学方程式。
1g 硫粉在氧气中充分燃烧放出 9. 36kJ 热量
32g ×9.36kJ /g = 299.52 kJ
1 mol 硫粉在氧气中充分燃烧放出热量为:
S (s) + O2 (g) = SO2 (g) △H =-299.52 kJ ?mol-1
S + O2 = SO2
3. 有关热化学方程式的计算
二、热化学方程式
第二单元 化学反应中的热量
[ 练习1 ] 250C,1.01×105Pa下,4g CO在氧气中燃
烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学
方程式。
2CO (g) + O2 (g) = 2CO2 (g) △H =- 134.4 kJ ? mol-1
2CO + O2 = 2CO2
2×28g
Q
9.6kJ
4 g
解: 设2mol CO 燃烧放出的热量为 Q
2×28g : 4g = Q : 9.6 kJ
Q =134.4 kJ
放热
① 现今用的燃料是什么?主要是什么?
② 燃料充分燃烧的条件有哪些?
③ 燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④ 导致酸雨的主要原因之一是什么?
⑤ 怎样高效、清洁地利用煤炭?
⑥ 怎样提高固体和液体燃料的燃烧效率?
三、燃料的充分燃烧
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面
煤中所含硫在燃烧时会生成SO2
要有适当过量的空气
燃料与空气要有足够大的接触面积
高效清洁利用煤炭的重要途径
将焦炭在高温下与水蒸气反应,则得到CO和H2
练习:简要说明使煤炉中的煤充分燃烧所应采取的措施。
打开炉门
在煤饼上打孔或将煤做成煤块
燃烧时要有足够多的空气
燃料与空气要有足够大的接触面
16.6%
2.1%
5.1%
76.2%
我国化石燃料和水电能源消耗构成图
