2020-2021人教版高中化学必修二第二章2-1化学能与热能课件(共21张ppt)
文档属性
| 名称 | 2020-2021人教版高中化学必修二第二章2-1化学能与热能课件(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 22:02:12 | ||
图片预览








文档简介
(共21张PPT)
同步导练/RJ·必修②
化学
经典品质/超越梦想
第2章 化学反应与能量
第一节 化学能与热能
2-1-1化学键与化学反应中能量变化的关系
化学键:
复习提问:
化学变化的特征
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
利用化学反应:一是制取物质、二是利用反应中的能量
煤、石油和天然气等化石燃料或它们的制品的燃烧所产生的热能从何而来?与化学物质及化学反应有什么关系?石灰石经高温煅烧生成生石灰,高温提供的热能在分解反应中起什么作用?
问题探究:
阅读:学与问
断裂化学键的过程,吸收能量 or 放出能量?
结论:在化学反应过程中,
破坏旧化学键(断裂)需要吸收能量来克服原子间的相互作用;
形成新化学键时,又释放一定的能量。
H2
1molH2的共价键断裂
吸收436kJ能量
1/2molO2的共价键断裂
1/2O2
吸收249kJ能量
2H
O
形成1molH2O的共价键
释放930kJ能量
H2O
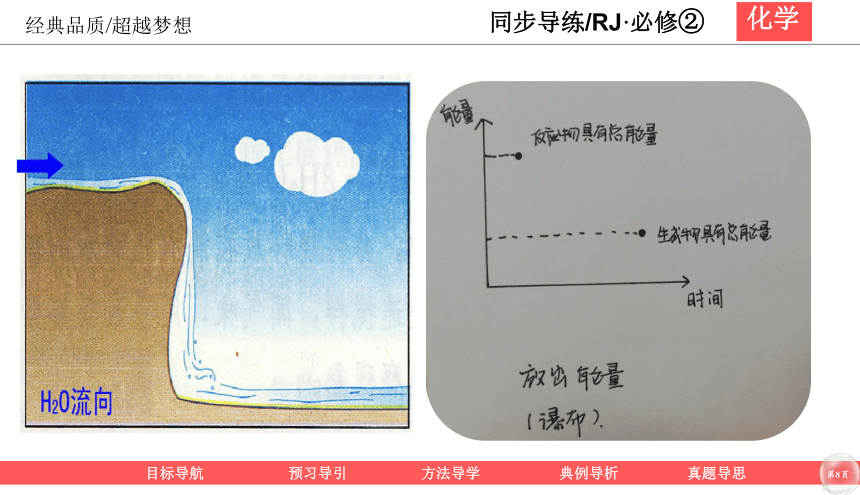
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放出能量
吸收能量
E(反应物)>E(生成物)——放出能量
E(反应物)<E(生成物)——吸收能量
2-1-2化学能与热能的相互转化
问题:吸收能量 和 释放能量 的反应中,反应物本身所具有的能量和生成物本身所具有的能量之间的大小关系分别如何?
吸热反应:反应物
生成物
+ 能量
放热反应:反应物
生成物
+ 能量
计算一下:
吸热反应 or 放热反应?
拆开1 mol某键所需的能量叫键能。
单位:kJ/mol。
键能:
小结:
1、化学反应的特点是有新物质生成,新物质和反应物总能量不同
2、反应中要遵循能量守恒。
3、反应物与生成物的能量差若以热能形式表现即为放热和吸热。如果二者能量比较接近则放热和吸热不明显。
实验2-1
1.铝和盐酸反应。 ( )
2.
3.盐酸和氢氧化钠反应。 ( )
1、物质发生化学反应的同时还伴随着能量的变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
总结:
12g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?
请你思考:
同步导练/RJ·必修②
化学
经典品质/超越梦想
第2章 化学反应与能量
第一节 化学能与热能
2-1-1化学键与化学反应中能量变化的关系
化学键:
复习提问:
化学变化的特征
化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。
利用化学反应:一是制取物质、二是利用反应中的能量
煤、石油和天然气等化石燃料或它们的制品的燃烧所产生的热能从何而来?与化学物质及化学反应有什么关系?石灰石经高温煅烧生成生石灰,高温提供的热能在分解反应中起什么作用?
问题探究:
阅读:学与问
断裂化学键的过程,吸收能量 or 放出能量?
结论:在化学反应过程中,
破坏旧化学键(断裂)需要吸收能量来克服原子间的相互作用;
形成新化学键时,又释放一定的能量。
H2
1molH2的共价键断裂
吸收436kJ能量
1/2molO2的共价键断裂
1/2O2
吸收249kJ能量
2H
O
形成1molH2O的共价键
释放930kJ能量
H2O
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放出能量
吸收能量
E(反应物)>E(生成物)——放出能量
E(反应物)<E(生成物)——吸收能量
2-1-2化学能与热能的相互转化
问题:吸收能量 和 释放能量 的反应中,反应物本身所具有的能量和生成物本身所具有的能量之间的大小关系分别如何?
吸热反应:反应物
生成物
+ 能量
放热反应:反应物
生成物
+ 能量
计算一下:
吸热反应 or 放热反应?
拆开1 mol某键所需的能量叫键能。
单位:kJ/mol。
键能:
小结:
1、化学反应的特点是有新物质生成,新物质和反应物总能量不同
2、反应中要遵循能量守恒。
3、反应物与生成物的能量差若以热能形式表现即为放热和吸热。如果二者能量比较接近则放热和吸热不明显。
实验2-1
1.铝和盐酸反应。 ( )
2.
3.盐酸和氢氧化钠反应。 ( )
1、物质发生化学反应的同时还伴随着能量的变化。
2、化学键的断裂和形成是化学反应中能量变化的主要原因。
3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。
总结:
12g石墨与O2反应生成CO2放出393.51KJ热量; 12g金刚石与O2反应生成CO2放出395.41KJ热量,试比较,石墨与金刚石哪个稳定?
请你思考:
