2020-2021人教版高中化学必修二第二章2-3-2 化学反应限度 课件(共34张ppt)
文档属性
| 名称 | 2020-2021人教版高中化学必修二第二章2-3-2 化学反应限度 课件(共34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-03-31 22:03:05 | ||
图片预览











文档简介
(共34张PPT)
同步导练/RJ·必修②
化学
经典品质/超越梦想
第2章 化学反应与能量
第三节 化学反应的速率和限度
第一课时 化学反应的限度
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
典型的可逆反应还有:
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
一 可逆反应
在同一条件下, 既可以向正反应方向进行同时又可以向逆反应方向进行的反应。
1 概念:
正反应:反应物→生成物
逆反应:生成物→反应物
2 特征:
②反应物、生成物共同存在;
①正、逆反应发生的条件相同;
③可逆反应有一定的限度。
3 限度表示:
1) 反应物转化率(α)
2) 产物产率
已转化量
起始总量
100%
实际产量
理论产量
100%
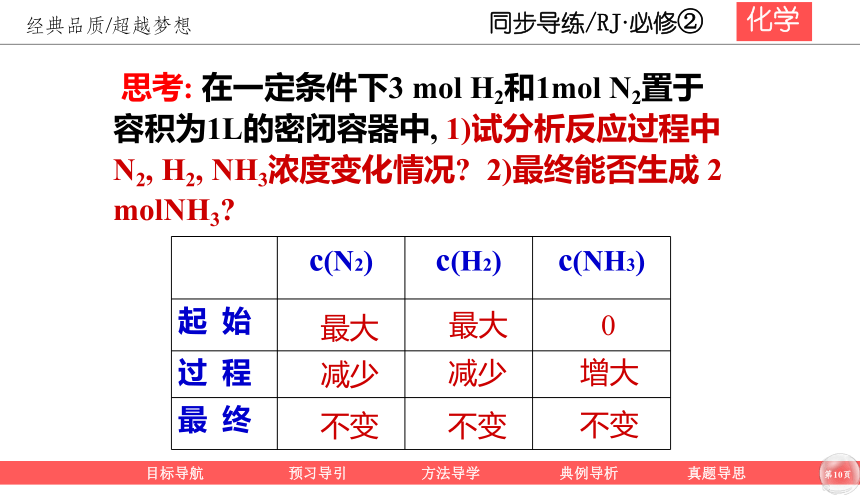
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
最大
减少
不变
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
最大
最大
减少
减少
不变
不变
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
最大
最大
0
减少
减少
增大
不变
不变
不变
H2(g) + I2 (g) 2HI(g)
正向反应
逆向反应
对于以上反应,请分析:
(1)当反应刚开始时,反应物和生成物的浓
度哪个大?
(2)当反应刚开始时,正反应与逆反应哪个
反应速率大?
(3)随着反应的进行,反应物和生成物浓度
如何变化?
(4)随着反应的进行,v(正)与v(逆)怎样变化?
在密闭容器中加入1molH2和1mol I2发生反应
H2(g) + I2 (g) 2HI(g)
正向反应
逆向反应
请继续分析:
(5)反应进行到什么时候会“停止”?
当正反应速率与逆反应速率相等时
(6)此时,反应物和生成物浓度如何变化?
反应物和生成物浓度均不再改变
(7)给这个状态命名
平衡状态
(8)反应真的停止了吗?
NO
处于动态平衡
反应速率
υ(正)
υ(逆)
t1
时间(t)
0
(1) 0~t1: υ(正)>υ(逆)
(2) t1~ : υ(正)=υ(逆)
(平衡状态)
交流与讨论: 反应过程中正逆反应速率变化
1 概念: 在一定条件下, 可逆反应进行到一定程度时, 正反应速率和逆反应速率相等, 反应物和生成物的浓度保持不变的状态。
1) 平衡状态时, 可逆反应进行到最大程度
二 化学平衡状态
注意:
2) 催化剂只能改变反应速率, 不能改变限度
2 化学平衡状态的特征
适用范围: 可逆反应
内在本质: υ(正)=υ(逆)
外在标志: 反应物和生成物各组分 的浓度、各组分的含量保持不变
1) 逆:
2) 等:
3) 动:
4) 定:
υ(正)=υ(逆)>0
动态平衡:
5) 变:
条件改变, 原平衡被破坏, 在新的条件下建立新的平衡
3 判断化学平衡状态的方法
①υ正(A)=υ逆(A)
正逆
速率
关系
(1)
平衡
②pυ正(A)=mυ逆(C)
平衡
③pυ逆(A)=mυ逆(C)
不一定
3 判断化学平衡状态的方法
①各物质的浓度一定
体系
各组
分量
关系
(2)
平衡
②各物质的质量(分数)一定
平衡
③各气体的体积(分数)一定
不一定
平衡
④n(总), m(总), V(总)一定
3 判断化学平衡状态的方法
压
强
(3)
平衡
不一定
② 总压一定
① 总压一定
(4)
平衡
不一定
① 一定
② 一定
3 判断化学平衡状态的方法
体系温度一定时
平衡
(5)温度
体系密度一定时
不一定
(6)密度
体系颜色一定时
平衡
(7)颜色
A. C生成的速率与分解的速率相等
B. A、B、C的浓度不再发生变化
C. 单位时间内、生成a mol A同时生成
3a mol B
D. A、B、C的分子数之比为1:3:2
1.在一定温度下, 可逆反应A+3B 2C
达到平衡状态的标志是( )
化学平衡状态的判断练习
A. C生成的速率与分解的速率相等
B. A、B、C的浓度不再发生变化
C. 单位时间内、生成a mol A同时生成
3a mol B
D. A、B、C的分子数之比为1:3:2
A. B
1.在一定温度下, 可逆反应A+3B 2C
达到平衡状态的标志是( )
化学平衡状态的判断练习
2. 对于一定条件下的可逆反应 N2(g)+3H2(g)
2NH3(g) 能说明反应已达到平衡状态
的是 ( )
A. 体积分数φNH3%=φN2%
B. c(NH3)保持不变
C. 反应体系的压强不变
D. c(NH3):c(N2):c(H2)=2:1:3
2. 对于一定条件下的可逆反应 N2(g)+3H2(g)
2NH3(g) 能说明反应已达到平衡状态
的是 ( )
A. 体积分数φNH3%=φN2%
B. c(NH3)保持不变
C. 反应体系的压强不变
D. c(NH3):c(N2):c(H2)=2:1:3
B C
3. 一定温度下, 反应A2(g)+B2(g) 2AB(g)
达到平衡状态的标志是( )
A. 单位时间生成1 molA2同时生成1 molAB
B. 容器内的总压强不随时间变化
C. 单位时间生成2 molAB同时生成1 molB2
D. 单位时间生成1 molA2同时生成1 molB2
3. 一定温度下, 反应A2(g)+B2(g) 2AB(g)
达到平衡状态的标志是( )
A. 单位时间生成1 molA2同时生成1 molAB
B. 容器内的总压强不随时间变化
C. 单位时间生成2 molAB同时生成1 molB2
D. 单位时间生成1 molA2同时生成1 molB2
C
例: 某温度时, 将1mol NO2分解:
2NO2 2NO+O2, 并达到平衡,
此时NO的体积分数为 40%, 求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。
关于化学平衡的简单计算
三 化学平衡计算(三行法)
求 1) α ; 2) ρ ; 3) φ ; 4)
化学平衡计算的一般步骤: “三步曲”
1.写出有关平衡的化学方程式
2.找出各物质的 起始量 转化量 平衡量
3. 根据已知条件列式:
⑴各组分的含量
⑵名组分百分含量
⑶平衡混合物的平均量
⑷反应物的转化率及产物的产率等.
㈢.有关化学平衡的计算
例1.在一定温度下,发生如下反应:N2+3H2 2NH3,起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,平衡时生成NH3的物质的量是2.4 mol。已知容器的容积为5.0 L,试求: (1)H2的转化率。(2)平衡时混合气体中N2的体积分数。
【解析】 N2 + 3H2 2NH3
起始量: 3.0 mol 6.0 mol 0 mol
转化量: 1.2 mol 3.6 mol 2.4 mol
平衡量: 1.8 mol 2.4 mol 2.4 mol
(1)H2的转化率= 。
(2)N2的体积分数=
三、化学反应条件的控制
在生产和生活中,人们希望促进有利的化
学反应抑制有害的化学反应,这就涉及到反
应条件的控制
下面以“提高煤的燃烧效率”为例
(1)将煤气化比固态煤燃烧速率更快且使煤
充分燃烧。
(4)将废气通过装有冷却水的管道,充分吸收
还可以使用助燃剂等
(2)空气不足,煤得不到充分燃烧;且污染环境。
空气过量,废气要带走能量,浪费能源。
(3)应选择保温性能好,提高炉膛温度的材料
归纳:提高煤的燃烧效率的措施
(1)尽可能使燃料充分燃烧,提高能量的转化率.关键是燃料与空气或氧气要尽可能充分地接触,且空气要适当过量。
(2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
提高燃料的燃烧效率实质上是从多方面控制燃烧反应的条件(包括环境)
意义:节约能源、节省资源、减少污染
(煤在气化过程中可以脱硫、除去灰分)
我们在生产、科研和生活中都需要控制
化学反应的条件。
有利的反应,要想办法增大反应速率:
(1)升高温度,使用催化剂,增大反应物浓度…
有害的反应,要设法降低反应速率:
(1)降低反应温度,使用负催化剂
(2)或隔离会引发反应的物质……
知识应用
同步导练/RJ·必修②
化学
经典品质/超越梦想
第2章 化学反应与能量
第三节 化学反应的速率和限度
第一课时 化学反应的限度
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
典型的可逆反应还有:
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
SO2 +H2O H2SO3
NH3 +H2O NH3 ·H2O
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
一 可逆反应
在同一条件下, 既可以向正反应方向进行同时又可以向逆反应方向进行的反应。
1 概念:
正反应:反应物→生成物
逆反应:生成物→反应物
2 特征:
②反应物、生成物共同存在;
①正、逆反应发生的条件相同;
③可逆反应有一定的限度。
3 限度表示:
1) 反应物转化率(α)
2) 产物产率
已转化量
起始总量
100%
实际产量
理论产量
100%
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
最大
减少
不变
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
最大
最大
减少
减少
不变
不变
思考: 在一定条件下3 mol H2和1mol N2置于容积为1L的密闭容器中, 1)试分析反应过程中N2, H2, NH3浓度变化情况? 2)最终能否生成 2 molNH3?
c(N2) c(H2) c(NH3)
起 始
过 程
最 终
最大
最大
0
减少
减少
增大
不变
不变
不变
H2(g) + I2 (g) 2HI(g)
正向反应
逆向反应
对于以上反应,请分析:
(1)当反应刚开始时,反应物和生成物的浓
度哪个大?
(2)当反应刚开始时,正反应与逆反应哪个
反应速率大?
(3)随着反应的进行,反应物和生成物浓度
如何变化?
(4)随着反应的进行,v(正)与v(逆)怎样变化?
在密闭容器中加入1molH2和1mol I2发生反应
H2(g) + I2 (g) 2HI(g)
正向反应
逆向反应
请继续分析:
(5)反应进行到什么时候会“停止”?
当正反应速率与逆反应速率相等时
(6)此时,反应物和生成物浓度如何变化?
反应物和生成物浓度均不再改变
(7)给这个状态命名
平衡状态
(8)反应真的停止了吗?
NO
处于动态平衡
反应速率
υ(正)
υ(逆)
t1
时间(t)
0
(1) 0~t1: υ(正)>υ(逆)
(2) t1~ : υ(正)=υ(逆)
(平衡状态)
交流与讨论: 反应过程中正逆反应速率变化
1 概念: 在一定条件下, 可逆反应进行到一定程度时, 正反应速率和逆反应速率相等, 反应物和生成物的浓度保持不变的状态。
1) 平衡状态时, 可逆反应进行到最大程度
二 化学平衡状态
注意:
2) 催化剂只能改变反应速率, 不能改变限度
2 化学平衡状态的特征
适用范围: 可逆反应
内在本质: υ(正)=υ(逆)
外在标志: 反应物和生成物各组分 的浓度、各组分的含量保持不变
1) 逆:
2) 等:
3) 动:
4) 定:
υ(正)=υ(逆)>0
动态平衡:
5) 变:
条件改变, 原平衡被破坏, 在新的条件下建立新的平衡
3 判断化学平衡状态的方法
①υ正(A)=υ逆(A)
正逆
速率
关系
(1)
平衡
②pυ正(A)=mυ逆(C)
平衡
③pυ逆(A)=mυ逆(C)
不一定
3 判断化学平衡状态的方法
①各物质的浓度一定
体系
各组
分量
关系
(2)
平衡
②各物质的质量(分数)一定
平衡
③各气体的体积(分数)一定
不一定
平衡
④n(总), m(总), V(总)一定
3 判断化学平衡状态的方法
压
强
(3)
平衡
不一定
② 总压一定
① 总压一定
(4)
平衡
不一定
① 一定
② 一定
3 判断化学平衡状态的方法
体系温度一定时
平衡
(5)温度
体系密度一定时
不一定
(6)密度
体系颜色一定时
平衡
(7)颜色
A. C生成的速率与分解的速率相等
B. A、B、C的浓度不再发生变化
C. 单位时间内、生成a mol A同时生成
3a mol B
D. A、B、C的分子数之比为1:3:2
1.在一定温度下, 可逆反应A+3B 2C
达到平衡状态的标志是( )
化学平衡状态的判断练习
A. C生成的速率与分解的速率相等
B. A、B、C的浓度不再发生变化
C. 单位时间内、生成a mol A同时生成
3a mol B
D. A、B、C的分子数之比为1:3:2
A. B
1.在一定温度下, 可逆反应A+3B 2C
达到平衡状态的标志是( )
化学平衡状态的判断练习
2. 对于一定条件下的可逆反应 N2(g)+3H2(g)
2NH3(g) 能说明反应已达到平衡状态
的是 ( )
A. 体积分数φNH3%=φN2%
B. c(NH3)保持不变
C. 反应体系的压强不变
D. c(NH3):c(N2):c(H2)=2:1:3
2. 对于一定条件下的可逆反应 N2(g)+3H2(g)
2NH3(g) 能说明反应已达到平衡状态
的是 ( )
A. 体积分数φNH3%=φN2%
B. c(NH3)保持不变
C. 反应体系的压强不变
D. c(NH3):c(N2):c(H2)=2:1:3
B C
3. 一定温度下, 反应A2(g)+B2(g) 2AB(g)
达到平衡状态的标志是( )
A. 单位时间生成1 molA2同时生成1 molAB
B. 容器内的总压强不随时间变化
C. 单位时间生成2 molAB同时生成1 molB2
D. 单位时间生成1 molA2同时生成1 molB2
3. 一定温度下, 反应A2(g)+B2(g) 2AB(g)
达到平衡状态的标志是( )
A. 单位时间生成1 molA2同时生成1 molAB
B. 容器内的总压强不随时间变化
C. 单位时间生成2 molAB同时生成1 molB2
D. 单位时间生成1 molA2同时生成1 molB2
C
例: 某温度时, 将1mol NO2分解:
2NO2 2NO+O2, 并达到平衡,
此时NO的体积分数为 40%, 求:
(1)平衡时NO的物质的量;
(2)平衡时NO2、O2的体积分数。
关于化学平衡的简单计算
三 化学平衡计算(三行法)
求 1) α ; 2) ρ ; 3) φ ; 4)
化学平衡计算的一般步骤: “三步曲”
1.写出有关平衡的化学方程式
2.找出各物质的 起始量 转化量 平衡量
3. 根据已知条件列式:
⑴各组分的含量
⑵名组分百分含量
⑶平衡混合物的平均量
⑷反应物的转化率及产物的产率等.
㈢.有关化学平衡的计算
例1.在一定温度下,发生如下反应:N2+3H2 2NH3,起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,平衡时生成NH3的物质的量是2.4 mol。已知容器的容积为5.0 L,试求: (1)H2的转化率。(2)平衡时混合气体中N2的体积分数。
【解析】 N2 + 3H2 2NH3
起始量: 3.0 mol 6.0 mol 0 mol
转化量: 1.2 mol 3.6 mol 2.4 mol
平衡量: 1.8 mol 2.4 mol 2.4 mol
(1)H2的转化率= 。
(2)N2的体积分数=
三、化学反应条件的控制
在生产和生活中,人们希望促进有利的化
学反应抑制有害的化学反应,这就涉及到反
应条件的控制
下面以“提高煤的燃烧效率”为例
(1)将煤气化比固态煤燃烧速率更快且使煤
充分燃烧。
(4)将废气通过装有冷却水的管道,充分吸收
还可以使用助燃剂等
(2)空气不足,煤得不到充分燃烧;且污染环境。
空气过量,废气要带走能量,浪费能源。
(3)应选择保温性能好,提高炉膛温度的材料
归纳:提高煤的燃烧效率的措施
(1)尽可能使燃料充分燃烧,提高能量的转化率.关键是燃料与空气或氧气要尽可能充分地接触,且空气要适当过量。
(2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
提高燃料的燃烧效率实质上是从多方面控制燃烧反应的条件(包括环境)
意义:节约能源、节省资源、减少污染
(煤在气化过程中可以脱硫、除去灰分)
我们在生产、科研和生活中都需要控制
化学反应的条件。
有利的反应,要想办法增大反应速率:
(1)升高温度,使用催化剂,增大反应物浓度…
有害的反应,要设法降低反应速率:
(1)降低反应温度,使用负催化剂
(2)或隔离会引发反应的物质……
知识应用
