人教版高中化学必修一 第四章第二节富集在海水中的元素——氯 (共32张PPT)
文档属性
| 名称 | 人教版高中化学必修一 第四章第二节富集在海水中的元素——氯 (共32张PPT) | 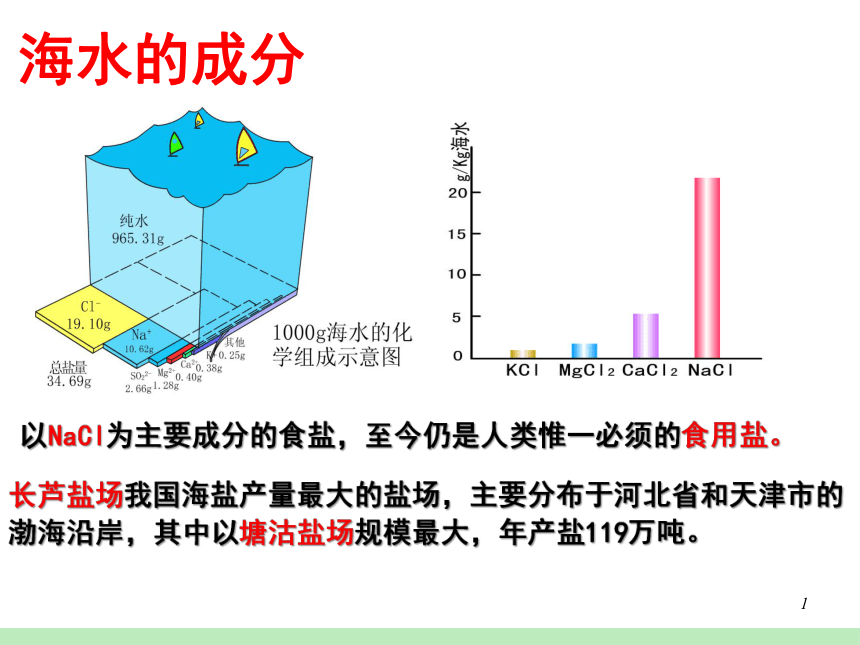 | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-01 21:09:16 | ||
图片预览











文档简介
(共32张PPT)
*
海水的成分
长芦盐场我国海盐产量最大的盐场,主要分布于河北省和天津市的渤海沿岸,其中以塘沽盐场规模最大,年产盐119万吨。
以NaCl为主要成分的食盐,至今仍是人类惟一必须的食用盐。
认识氯气的存在、用途,掌握氯的重要性质。
掌握氯的化合物(NaCl、HCl、HClO、Ca(ClO)2等)的性质,并熟练书写有关的化学方程式及离子方程式,并在理解的基础上记忆其用途。
学会鉴别氯离子。
[学习目标]
一、 氯元素的原子结构与自然界的存在
1、氯的原子结构和性质
性质:化合价:-1,+1,+3,+5,+7
得电子能力强,非金属性强
氯气
2、氯元素在自然界的存在
主要以化合态的形式存在
-1-
阅读:P82 科学史话
氯气的发现和确认
思考与交流
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理
论,建立正确的理论或推动科学理论的发展。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
*
仪器组装顺序:自下而上、从左到右
收集装置:
尾气处理装置:
发生装置:
固、液加热
向上排气法(或排饱和食盐水法)
碱液(NaOH)吸收
氯气的实验室制法
根据反应原理选择反应装置
净化装置:
洗气瓶:饱和食盐水(HCl)、浓硫酸(H2O)
能否用澄清石灰水代替NaOH?为什么?
如何检验氯气已收集满?
多余氯气能否直接排放到空气中?应如何处理?
MnO2
浓HCl
饱和食盐水(除HCl)
浓硫酸
(除H2O)
注意导气管的进出方式(长进短出)
为什么?
氯气的检验
[思考与交流1]你对氯气了解多少?氯气是一种什么样的物质?有什么样的性质?
*
历史事件
1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场,德国军队在与英法联军作战中,首次使用氯气攻击对方,开了战争史上使用化学武器的先例。
一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。”
重庆天原化工总厂发生氯气泄漏事件
氯气的化学活泼性使得它的毒性很强,可损害全身器官和系统。
氯气还对皮肤、衣物等具有强烈腐蚀、损毁作用
能破坏环境、能剿灭触及的所有生命——所有植物和动物,尤其是动物致死率几乎100%,只有天上能高飞的鸟勉强得逃脱。
液氯是纯氯气加压后液化所得
*
1、氯气的分子结构
氯气属于双原子分子结构
2、氯气的物理性质
(色、状、味、水溶性、密度、毒性)
(1)氯气是黄绿色有刺激性气味的有毒气体
(2)氯气可溶于水,氯水呈浅黄绿色
(常温常压下,1体积水可溶解2体积氯气)
(3)密度比空气大——向上排空气法收集
二、 活泼的黄绿色气体——氯气
实验室里闻有毒气体及未知气体气味的方法?
(4)易液化 ——加压液化,贮存在钢瓶中
-1-
3、氯气的化学性质
(氧化剂,强氧化性)
(1)氯气与金属反应
Cl2有很强的氧化性,能与多数金属反应生成相应的金属氯化物,尤其要注意的是:它和变价金属反应,生成高价的金属氯化物,如:CuCl2、FeCl3
(现象:产生白烟)
(现象:产生棕黄色的烟)
(现象:产生棕黄色的烟)
点燃:发出苍白色火焰,有白雾,工业制盐酸;
光照:会发生爆炸。
(2)跟非金属反应
(液态)
(固态)
P在氯气中燃烧的现象是:
有白色烟雾生成
思考与交流:通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。
【化学与生活】
当我们一大早打开自来水龙头时,常常会闻到一股刺激性气味,你知道这是为什么吗?氯气能与水反应吗?
假设一:氯气和水不反应
成分: Cl2、H2O
假设二:氯气和水会反应
可能成分:Cl2、H2O、HCl(Cl- 、 H+)
方案1:氯水中滴加几滴石蕊试液。
现象:溶液先变红后迅速褪色。
结论:氯水中有H+ ,同时还有种能使石蕊褪色的物质。
探究二:氯水中有?无H+
方案:氯水与硝酸银(酸化)溶液反应
现象:有白色沉淀生成
结论:氯水中有?Cl- , 假设二成立。
探究一:氯水中有?无Cl-
资
料
卡
片
一般有机色素比如酸碱指示剂或有色布条、花朵通常具有很强的还原性,当它们遇到氧化性强的物质会发生氧化还原反应使得有机色素褪色,这个过程称为漂白,所以氧化性强的物质通常具有漂白性。
Cl2 + H2O = HCl+ ?
漂白性?
漂白性?
探究氯水中漂白性的物质
现象:干燥的有色布条或花朵不褪色;而潮湿的有色布条或花朵却褪色了
结论:氯气无漂白作用,氯水具有漂白是因为氯气和水生成了一种新的物质HClO
(3)氯气与水的反应
关于次氯酸(HClO)的性质
Cl2+H2O = H++Cl-+HClO
离子方程式:
(常考)
1、弱酸性
2、不稳定易分解
3、强氧化性
4、漂白性
酸性:H2CO3 >HClO
HClO+H2SO3==HClO+H2SO4
整理总结:液氯、新制氯水、久置氯水比较
液氯
新制氯水
久置氯水
颜色、状态
主要存
在的微粒
物质的类别
遇干燥的蓝
色石蕊试纸
黄绿色液体
Cl2分子
Cl2 、H2O 、 HClO
Cl-、 H+ 、ClO-、OH-
纯净物
无明显变化
先变红后褪色
混合物
淡黄绿色溶液
无色液体
H2O 、Cl-、
H+ 、OH-
变红
混合物
主要性质
Cl2的性质
Cl2、HClO、HCl的性质
HCl的性质
保存方法
干燥钢瓶中
密封、避光、阴暗
例1、下列说法正确的是: A、Cl2有毒,Cl-也有毒 B、Cl和Cl-化学性质一样
C、 Cl2和Cl-都是黄绿色 D、液氯并非氯水
例2.将新制的氯水缓缓滴入预先滴有酚酞的 NaOH溶液中,当滴到一定量时红色完全褪去。产生这一现象的原因可能有两种:
(1)是______________________________________
(2)是_____________________________________________
新制氯水中的HCl、HClO与 NaOH发生中和反应,使NaOH无剩余。
新制氯水中HClO具有漂白性,使红色溶液褪色
D
*
(4)与碱溶液的反应
Cl2 + 2OH- === Cl- + ClO- + H2O
实验室制氯气时,多余的氯气用NaOH溶液吸收
关于漂白粉的制取、成分、漂白原理:
2Ca(OH)2 + 2Cl2 === CaCl2 + Ca(ClO)2 + 2H2O
漂白粉的成分
漂白粉的有效成分
CaCl2 和 Ca(ClO)2的混合物
Ca(ClO)2
漂白粉的漂白原理:它的水溶液与空气中的CO2接触反应生成次氯酸的过程。
Ca(ClO)2 + CO2 + H2O === CaCO3 ↓+ 2HClO
漂白粉的保存: 密封,隔绝空气!
Cl2与热的浓碱反应的方程式?
(5)与还原性物质的反应
与FeCl2 、NaBr、KI、H2S、SO2等物质反应(表现氯气的强氧化性)
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
Cl2 + 2Br- === 2Cl- + Br2
Cl2 + 2 I- === 2Cl- + I2
Cl2+H2S=2HCl+S
Cl2+SO2+2H2O=2HCl+H2SO4
3Cl2+2NH3=N2+6HCl
(少量的NH3)
3Cl2+8NH3=N2+6NH4Cl
(过量的NH3)
若Cl2管道泄漏,可用沾有氨的玻璃棒靠近即可。
-1-
氯气的用途
杀菌消毒
制漂白粉(液)
作制高纯硅、锗和钛的中间物质
合成塑料、橡胶、农药、药品等
[实验4—6]在下列溶液中各滴入几滴AgNO3溶液,观察现象。然后再分别加入少量稀硝酸,观察现象。
白色↓
白色↓
白色↓
轻微白色↓
不溶解
不溶解
产生大量气泡并溶解
不溶解
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
2Ag++CO32- =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2 ↑+H2O
二、氯离子(Cl-)的检验
实验现象 解释或
离子方程式
加入AgNO3溶液后 加入稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
有关反应的离子方程式是:
Ag+ + Cl– = AgCl ↓
2Ag+ + CO32- = Ag2CO3 ↓
Ag2CO3 + 2H+ = 2Ag+ + CO2 ↑+ H2O
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
或在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
检验Cl-时,为什么滴加AgNO3溶液后再加稀硝酸呢?
排除CO32-等的干扰
思考
思考
卤素单质在不同溶剂中的颜色:
-1-
3.卤素单质的化学性质
(1)能与金属反应
与可变价的金属反应时,碘表现较弱的氧化性。如与铁反应:
-1-
卤素原子结构有何相似点和不同点?
氟 (F) 氯( Cl ) 溴 (Br)
稳定性:HF>HCl>HBr>HI HX水溶液的酸性:HFF2+H2===2HF
(2)卤素单质都能与氢气反应
(冷、暗的地方就会爆炸)
2F2+2H2O===4HF+O2 (置换反应)
X2+H2O HX+HXO(X代表Cl?Br?I)
(3)卤素与水反应
X2+2NaOH====NaX+NaXO+H2O(X代表Cl?Br?I)
氟?氯?溴?碘与水反应的剧烈程度减弱?
(4)与碱反应(氟除外)
3X2+6NaOH(热、浓)=5NaX+NaXO3+3H2O(X代表Cl?Br?I)
X-+XO3-
X-+XO-
X2
OH-
H+
(X代表Cl?Br?I)
-1-
(1)F原子半径小,得电子能力强,无正价,无含氧酸,F2是氧化性最强的非金属单质?
(2)F2与H2反应剧烈,低温?暗处即发生爆炸?
3.卤素及其化合物的特性
(3)F2可以与稀有气体中的Xe?Kr等作用生成相应的氟化物XeF2?XeF4?XeF6?KrF2等,它们在常温下都是白色固体? (4)卤化氢均易溶于水,在空气中形成白雾,其中只有HF有剧毒,但HX都是大气污染物,水溶液均呈酸性;只有氢氟酸是弱酸,从HF到HI,酸性逐渐增强?
-1-
(5) HF气体及氢氟酸均能腐蚀玻璃,不能用玻璃容器盛装,应保存在塑料瓶或铅制器皿中?
(6)F2能与水反应放出O2,故F2不能从其他卤素化合物的水溶液中将卤素单质置换出来?
(7)Br2常温下呈液态,且是唯一的液态非金属单质?Cl2易液化?
(8)液态Br2有剧毒,易挥发,故要用蜡密封保存在磨口玻璃瓶中,还可加少许水做保护剂抑制Br2挥发,不能用橡胶塞?(液封)
-1-
(9)碘水能使淀粉变蓝,I2晶体易升华,是常温下固体单质中唯一的双原子分子,与Fe反应生成FeI2而非FeI3(因I2的氧化性弱)?
(10)AgX中只有AgF可溶,其余溶解度逐渐减小;AgX均具感光性,且感光下增强;AgBr做感光材料,AgI做人工降雨材料?
(11)AgX的颜色:AgF(白色)AgCl(白色)AgBr(浅黄色)AgI(黄色)
(12)CaF2难溶于水,其余CaX2都易溶于水
(13)HX的制取
(14)HX的沸点:HF中有氢键,故沸点: HF>HI>HBr>HCl
-1-
1.银盐法——沉淀法
卤素离子的检验
-1-
2.置换——萃取法
3.置换——淀粉法检验I-
能使湿润的淀粉KI试纸变蓝的物质:Cl2、O3、Br2、NO2、H2O2、Fe3+
-1-
2、按要求填空
橙黄色
橙
蓝
黄
蓝
-1-
1.已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
D
-1-
选项 实验现象 结论
A 滴有KSCN的FeCl2溶液变红色 Cl2具有还原性
B 滴有酚酞的NaOH溶液褪色 Cl2具有酸性
C 石蕊溶液先变为红色后褪色 Cl2具有漂白性
D 淀粉KI溶液中变蓝色 Cl2具有氧化性
*
海水的成分
长芦盐场我国海盐产量最大的盐场,主要分布于河北省和天津市的渤海沿岸,其中以塘沽盐场规模最大,年产盐119万吨。
以NaCl为主要成分的食盐,至今仍是人类惟一必须的食用盐。
认识氯气的存在、用途,掌握氯的重要性质。
掌握氯的化合物(NaCl、HCl、HClO、Ca(ClO)2等)的性质,并熟练书写有关的化学方程式及离子方程式,并在理解的基础上记忆其用途。
学会鉴别氯离子。
[学习目标]
一、 氯元素的原子结构与自然界的存在
1、氯的原子结构和性质
性质:化合价:-1,+1,+3,+5,+7
得电子能力强,非金属性强
氯气
2、氯元素在自然界的存在
主要以化合态的形式存在
-1-
阅读:P82 科学史话
氯气的发现和确认
思考与交流
启示1:科学研究需要有正确的理论作指导,错误的理论只能浪费时间和精力。
启示2:科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理
论,建立正确的理论或推动科学理论的发展。
启示3:科学研究需要有热爱科学的思想和奉献科学的精神。
1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。我国早年译文将其译成“绿气”,后改为氯气。
*
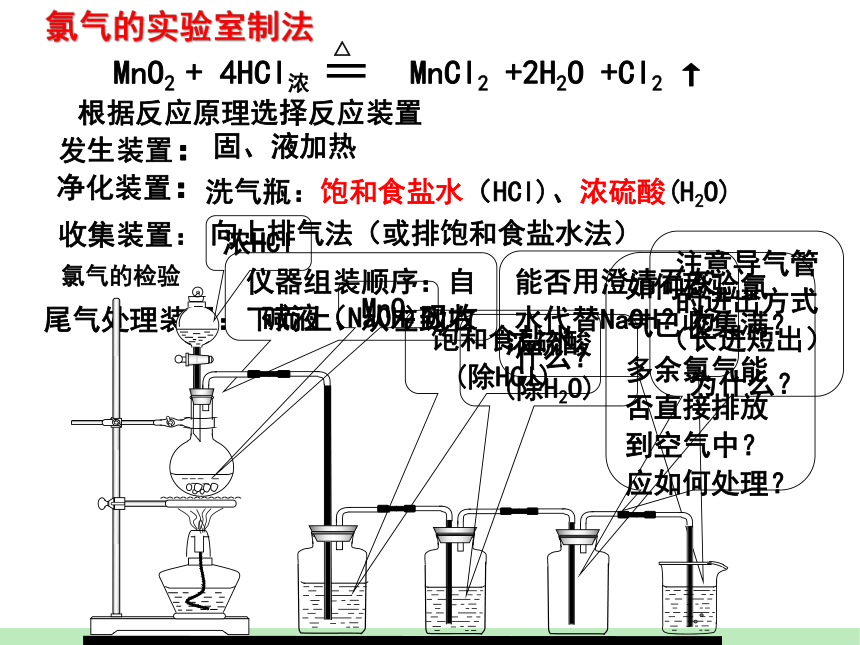
仪器组装顺序:自下而上、从左到右
收集装置:
尾气处理装置:
发生装置:
固、液加热
向上排气法(或排饱和食盐水法)
碱液(NaOH)吸收
氯气的实验室制法
根据反应原理选择反应装置
净化装置:
洗气瓶:饱和食盐水(HCl)、浓硫酸(H2O)
能否用澄清石灰水代替NaOH?为什么?
如何检验氯气已收集满?
多余氯气能否直接排放到空气中?应如何处理?
MnO2
浓HCl
饱和食盐水(除HCl)
浓硫酸
(除H2O)
注意导气管的进出方式(长进短出)
为什么?
氯气的检验
[思考与交流1]你对氯气了解多少?氯气是一种什么样的物质?有什么样的性质?
*
历史事件
1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场,德国军队在与英法联军作战中,首次使用氯气攻击对方,开了战争史上使用化学武器的先例。
一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。”
重庆天原化工总厂发生氯气泄漏事件
氯气的化学活泼性使得它的毒性很强,可损害全身器官和系统。
氯气还对皮肤、衣物等具有强烈腐蚀、损毁作用
能破坏环境、能剿灭触及的所有生命——所有植物和动物,尤其是动物致死率几乎100%,只有天上能高飞的鸟勉强得逃脱。
液氯是纯氯气加压后液化所得
*
1、氯气的分子结构
氯气属于双原子分子结构
2、氯气的物理性质
(色、状、味、水溶性、密度、毒性)
(1)氯气是黄绿色有刺激性气味的有毒气体
(2)氯气可溶于水,氯水呈浅黄绿色
(常温常压下,1体积水可溶解2体积氯气)
(3)密度比空气大——向上排空气法收集
二、 活泼的黄绿色气体——氯气
实验室里闻有毒气体及未知气体气味的方法?
(4)易液化 ——加压液化,贮存在钢瓶中
-1-
3、氯气的化学性质
(氧化剂,强氧化性)
(1)氯气与金属反应
Cl2有很强的氧化性,能与多数金属反应生成相应的金属氯化物,尤其要注意的是:它和变价金属反应,生成高价的金属氯化物,如:CuCl2、FeCl3
(现象:产生白烟)
(现象:产生棕黄色的烟)
(现象:产生棕黄色的烟)
点燃:发出苍白色火焰,有白雾,工业制盐酸;
光照:会发生爆炸。
(2)跟非金属反应
(液态)
(固态)
P在氯气中燃烧的现象是:
有白色烟雾生成
思考与交流:通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?
燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。
【化学与生活】
当我们一大早打开自来水龙头时,常常会闻到一股刺激性气味,你知道这是为什么吗?氯气能与水反应吗?
假设一:氯气和水不反应
成分: Cl2、H2O
假设二:氯气和水会反应
可能成分:Cl2、H2O、HCl(Cl- 、 H+)
方案1:氯水中滴加几滴石蕊试液。
现象:溶液先变红后迅速褪色。
结论:氯水中有H+ ,同时还有种能使石蕊褪色的物质。
探究二:氯水中有?无H+
方案:氯水与硝酸银(酸化)溶液反应
现象:有白色沉淀生成
结论:氯水中有?Cl- , 假设二成立。
探究一:氯水中有?无Cl-
资
料
卡
片
一般有机色素比如酸碱指示剂或有色布条、花朵通常具有很强的还原性,当它们遇到氧化性强的物质会发生氧化还原反应使得有机色素褪色,这个过程称为漂白,所以氧化性强的物质通常具有漂白性。
Cl2 + H2O = HCl+ ?
漂白性?
漂白性?
探究氯水中漂白性的物质
现象:干燥的有色布条或花朵不褪色;而潮湿的有色布条或花朵却褪色了
结论:氯气无漂白作用,氯水具有漂白是因为氯气和水生成了一种新的物质HClO
(3)氯气与水的反应
关于次氯酸(HClO)的性质
Cl2+H2O = H++Cl-+HClO
离子方程式:
(常考)
1、弱酸性
2、不稳定易分解
3、强氧化性
4、漂白性
酸性:H2CO3 >HClO
HClO+H2SO3==HClO+H2SO4
整理总结:液氯、新制氯水、久置氯水比较
液氯
新制氯水
久置氯水
颜色、状态
主要存
在的微粒
物质的类别
遇干燥的蓝
色石蕊试纸
黄绿色液体
Cl2分子
Cl2 、H2O 、 HClO
Cl-、 H+ 、ClO-、OH-
纯净物
无明显变化
先变红后褪色
混合物
淡黄绿色溶液
无色液体
H2O 、Cl-、
H+ 、OH-
变红
混合物
主要性质
Cl2的性质
Cl2、HClO、HCl的性质
HCl的性质
保存方法
干燥钢瓶中
密封、避光、阴暗
例1、下列说法正确的是: A、Cl2有毒,Cl-也有毒 B、Cl和Cl-化学性质一样
C、 Cl2和Cl-都是黄绿色 D、液氯并非氯水
例2.将新制的氯水缓缓滴入预先滴有酚酞的 NaOH溶液中,当滴到一定量时红色完全褪去。产生这一现象的原因可能有两种:
(1)是______________________________________
(2)是_____________________________________________
新制氯水中的HCl、HClO与 NaOH发生中和反应,使NaOH无剩余。
新制氯水中HClO具有漂白性,使红色溶液褪色
D
*
(4)与碱溶液的反应
Cl2 + 2OH- === Cl- + ClO- + H2O
实验室制氯气时,多余的氯气用NaOH溶液吸收
关于漂白粉的制取、成分、漂白原理:
2Ca(OH)2 + 2Cl2 === CaCl2 + Ca(ClO)2 + 2H2O
漂白粉的成分
漂白粉的有效成分
CaCl2 和 Ca(ClO)2的混合物
Ca(ClO)2
漂白粉的漂白原理:它的水溶液与空气中的CO2接触反应生成次氯酸的过程。
Ca(ClO)2 + CO2 + H2O === CaCO3 ↓+ 2HClO
漂白粉的保存: 密封,隔绝空气!
Cl2与热的浓碱反应的方程式?
(5)与还原性物质的反应
与FeCl2 、NaBr、KI、H2S、SO2等物质反应(表现氯气的强氧化性)
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
Cl2 + 2Br- === 2Cl- + Br2
Cl2 + 2 I- === 2Cl- + I2
Cl2+H2S=2HCl+S
Cl2+SO2+2H2O=2HCl+H2SO4
3Cl2+2NH3=N2+6HCl
(少量的NH3)
3Cl2+8NH3=N2+6NH4Cl
(过量的NH3)
若Cl2管道泄漏,可用沾有氨的玻璃棒靠近即可。
-1-
氯气的用途
杀菌消毒
制漂白粉(液)
作制高纯硅、锗和钛的中间物质
合成塑料、橡胶、农药、药品等
[实验4—6]在下列溶液中各滴入几滴AgNO3溶液,观察现象。然后再分别加入少量稀硝酸,观察现象。
白色↓
白色↓
白色↓
轻微白色↓
不溶解
不溶解
产生大量气泡并溶解
不溶解
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
2Ag++CO32- =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2 ↑+H2O
二、氯离子(Cl-)的检验
实验现象 解释或
离子方程式
加入AgNO3溶液后 加入稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
有关反应的离子方程式是:
Ag+ + Cl– = AgCl ↓
2Ag+ + CO32- = Ag2CO3 ↓
Ag2CO3 + 2H+ = 2Ag+ + CO2 ↑+ H2O
在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。
或在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。
某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
检验Cl-时,为什么滴加AgNO3溶液后再加稀硝酸呢?
排除CO32-等的干扰
思考
思考
卤素单质在不同溶剂中的颜色:
-1-
3.卤素单质的化学性质
(1)能与金属反应
与可变价的金属反应时,碘表现较弱的氧化性。如与铁反应:
-1-
卤素原子结构有何相似点和不同点?
氟 (F) 氯( Cl ) 溴 (Br)
稳定性:HF>HCl>HBr>HI HX水溶液的酸性:HF
(2)卤素单质都能与氢气反应
(冷、暗的地方就会爆炸)
2F2+2H2O===4HF+O2 (置换反应)
X2+H2O HX+HXO(X代表Cl?Br?I)
(3)卤素与水反应
X2+2NaOH====NaX+NaXO+H2O(X代表Cl?Br?I)
氟?氯?溴?碘与水反应的剧烈程度减弱?
(4)与碱反应(氟除外)
3X2+6NaOH(热、浓)=5NaX+NaXO3+3H2O(X代表Cl?Br?I)
X-+XO3-
X-+XO-
X2
OH-
H+
(X代表Cl?Br?I)
-1-
(1)F原子半径小,得电子能力强,无正价,无含氧酸,F2是氧化性最强的非金属单质?
(2)F2与H2反应剧烈,低温?暗处即发生爆炸?
3.卤素及其化合物的特性
(3)F2可以与稀有气体中的Xe?Kr等作用生成相应的氟化物XeF2?XeF4?XeF6?KrF2等,它们在常温下都是白色固体? (4)卤化氢均易溶于水,在空气中形成白雾,其中只有HF有剧毒,但HX都是大气污染物,水溶液均呈酸性;只有氢氟酸是弱酸,从HF到HI,酸性逐渐增强?
-1-
(5) HF气体及氢氟酸均能腐蚀玻璃,不能用玻璃容器盛装,应保存在塑料瓶或铅制器皿中?
(6)F2能与水反应放出O2,故F2不能从其他卤素化合物的水溶液中将卤素单质置换出来?
(7)Br2常温下呈液态,且是唯一的液态非金属单质?Cl2易液化?
(8)液态Br2有剧毒,易挥发,故要用蜡密封保存在磨口玻璃瓶中,还可加少许水做保护剂抑制Br2挥发,不能用橡胶塞?(液封)
-1-
(9)碘水能使淀粉变蓝,I2晶体易升华,是常温下固体单质中唯一的双原子分子,与Fe反应生成FeI2而非FeI3(因I2的氧化性弱)?
(10)AgX中只有AgF可溶,其余溶解度逐渐减小;AgX均具感光性,且感光下增强;AgBr做感光材料,AgI做人工降雨材料?
(11)AgX的颜色:AgF(白色)AgCl(白色)AgBr(浅黄色)AgI(黄色)
(12)CaF2难溶于水,其余CaX2都易溶于水
(13)HX的制取
(14)HX的沸点:HF中有氢键,故沸点: HF>HI>HBr>HCl
-1-
1.银盐法——沉淀法
卤素离子的检验
-1-
2.置换——萃取法
3.置换——淀粉法检验I-
能使湿润的淀粉KI试纸变蓝的物质:Cl2、O3、Br2、NO2、H2O2、Fe3+
-1-
2、按要求填空
橙黄色
橙
蓝
黄
蓝
-1-
1.已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
D
-1-
选项 实验现象 结论
A 滴有KSCN的FeCl2溶液变红色 Cl2具有还原性
B 滴有酚酞的NaOH溶液褪色 Cl2具有酸性
C 石蕊溶液先变为红色后褪色 Cl2具有漂白性
D 淀粉KI溶液中变蓝色 Cl2具有氧化性
