鲁教版九年级化学下册7.1-酸及性质-第1课时-课件(共24张PPT)
文档属性
| 名称 | 鲁教版九年级化学下册7.1-酸及性质-第1课时-课件(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 740.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-02 11:33:45 | ||
图片预览







文档简介
(共24张PPT)
( 第一课时 )
第七单元 常见的酸和碱
课题1 酸及其性质
学习目标:
1.能记住盐酸硫酸的主要物理性质和用途
2.能说出浓硫酸的特性和稀释方法
学习重点:
盐酸、硫酸的物理性质
同学们:
请大家想一想,日常生活中 有哪些食物给你留下这种印象?
吃起来有酸味
酸性物质有酸味
含有酸
碱面放多了的馒头
皮蛋
吃起来有涩味
碱性物质有涩味
含有碱
酸
盐酸、硫酸溶液、碳酸溶液都导电。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
H2CO3 === 2H+ + CO32-
—— 其溶液中阳离子全是H+的化合物。
酸的组成:
Cl —— 盐酸根
Cl- —— 盐酸根离子
( 一般 “ H开头 ”,
除H2O、H2O2 )
酸根离子
— “ H-酸根 ”
H
H
H
酸的定义:由H+和酸根离子构成的化合物。
阳离子全是H+
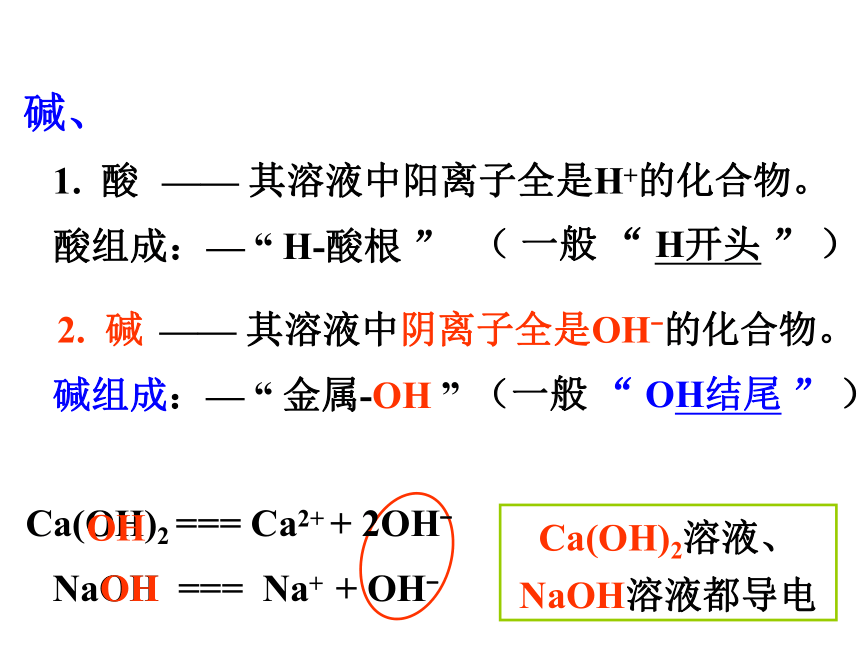
碱、
Ca(OH)2溶液、NaOH溶液都导电
NaOH === Na+ + OH-
1. 酸
—— 其溶液中阳离子全是H+的化合物。
Ca(OH)2 === Ca2+ + 2OH-
2. 碱
—— 其溶液中阴离子全是OH-的化合物。
碱组成:— “ 金属-OH ”
(一般 “ OH结尾 ” )
酸组成:— “ H-酸根 ”
( 一般 “ H开头 ” )
OH
OH
一. 盐酸
—— HCl气体 的水溶液
溶 液
(混合物)
溶质
一. 常见的酸
盐酸 HCl 硫酸H2SO4
硝酸 HNO3 碳酸 H2CO3
草酸 H2C2O4 醋酸CH3COOH......
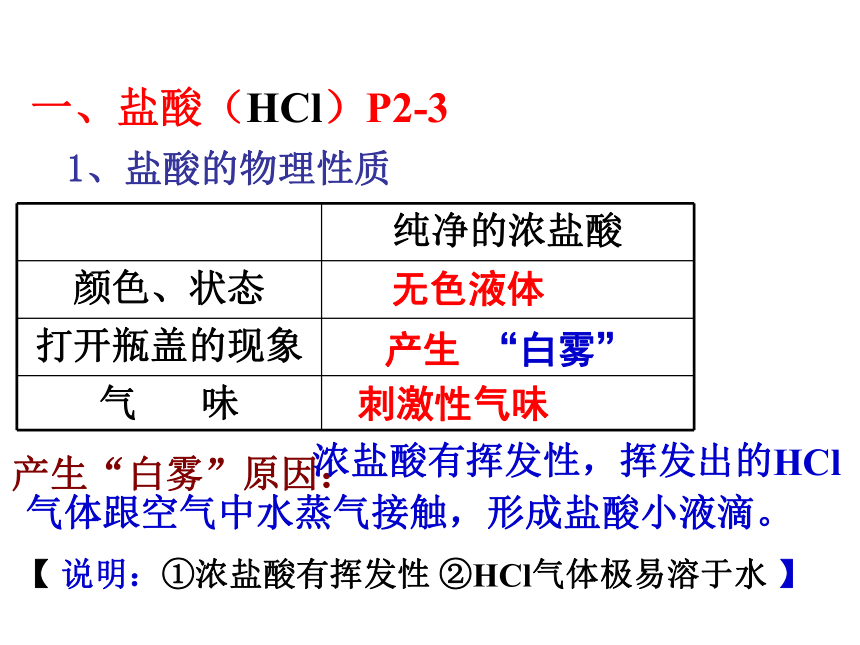
一、盐酸(HCl)P2-3
1、盐酸的物理性质
纯净的浓盐酸
颜色、状态
打开瓶盖的现象
气 味
无色液体
产生 “白雾”
刺激性气味
产生“白雾”原因:
浓盐酸有挥发性,挥发出的HCl 气体跟空气中水蒸气接触,形成盐酸小液滴。
【 说明:①浓盐酸有挥发性 ②HCl气体极易溶于水 】
问1:实验室制CO2、H2为什么不用浓盐酸?
浓盐酸有强挥发性,挥发出
HCl气体使制取的气体不纯
问2:如何区别浓盐酸和稀盐酸?
打开瓶塞,有白雾的是浓盐酸;没有的为稀盐酸
闻气味,有刺激性气味的是浓盐酸;没有的为稀盐酸
问3:敞口放置浓盐酸,溶质的质量会 ,
溶质质量分数会 。
减小
减小
讨论
问4:在干燥的空气中打开浓盐酸的瓶盖,浓盐酸会不会挥发?会不会看到白雾?溶质质量分数有什么变化
浓盐酸会挥发出无色、 刺激性的HCl气体;
看不到;
溶质质量分数会减小
问5:收集氯化氢气体可以用什么方法进行收集? (H-1 Cl-35.5)
向上排空气法
硫酸
—世界上产量最大、用途最广、消耗最多的酸
—硫酸的用途P5
(二)硫酸 ( H2SO4)
无色、粘稠、油状、液体,
溶于水并放大量热,不易挥发;
1、浓硫酸的物理性质
有吸水性。
浓H2SO4可以干燥O2 、H2、CO2等气体,
但不能干燥碱性气体(氨气:NH3)。
—— 常做某些气体的干燥剂
·干燥剂的选择原则:有吸水性;
不和被干燥的物质反应。
① 吸水性
(二)硫酸
2、浓H2SO4的特性
浓硫酸
洗气瓶
被干燥的气体
干燥的气体
—— 做某些气体的干燥剂
① 吸水性
2、浓H2SO4的特性
① 吸水性
浓硫酸敞口放置:
溶质质量 溶剂质量 溶液质量 ,w% 。
浓盐酸敞口放置:
溶质质量 溶剂质量 溶液质量 ,w% 。
(二)硫酸
2、浓H2SO4的特性
—— 物理性质
② 强烈的腐蚀性
·脱水性
—— 做某些气体的干燥剂
① 吸水性
2、浓H2SO4的特性
现 象:变黑、炭化
注:吸水性 —— 物理性质
脱水性 —— 化学性质
(书:P3)
·稀硫酸滴到纸张或衣服上,水分逐渐蒸发,慢慢变成浓硫酸,同样会使纸张、衣服逐渐炭化。
② 强烈的腐蚀性
·脱水性
—— 做某些气体的干燥剂
① 吸水性
2、浓H2SO4的特性
浓硫酸能和金属反应,但不生产H2 ,也不是置换反应。
③ 强氧化性
★
———
★
———
【问题】若不慎将浓硫酸沾到皮肤或衣服上,应如何处理?(P3)
浓、稀硫酸的处理方法一样,(先用帕子擦干)立即用大量水冲洗,再涂上3%~5%的碳酸氢钠(NaHCO3)溶液。
显碱性
(1)注意!
稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并用玻璃棒不断搅拌。
切不可将水倒进浓硫酸里!
3、浓H2SO4的稀释( P3 )
(3)手的感觉:
分析:
(2)玻璃棒的作用:搅拌,散热
浓硫酸溶于水,要放热
发热、发烫
现象:
原因:
液滴飞溅
水的密度较小,
浮在浓硫酸上面,
溶解时放热使水沸腾,
造成硫酸液滴飞溅。
3、浓H2SO4的稀释
导管的作用:
保持气体流通,
维持压强平衡。
1)必须在广口瓶中配制,便于散热、搅拌
3、浓H2SO4的稀释 注意事项
2)必须酸沿器壁缓慢入水,边倒边搅拌,以免热量积累使液体飞溅
3)不能在量筒中稀释、配制。
4)不能在集气瓶等厚玻璃仪器稀释与配制。厚玻璃仪器如果内外受热不均会炸裂。
作业:
1.浓盐酸在空气中会形成_____,这是因为浓盐酸挥发出来的______跟空气中的水蒸气接触,形成__________________的缘故。
2.浓硫酸敞口放置在空气中,能吸收空气中的_______,说明浓硫酸具有______性。故可做某些气体的______剂。浓硫酸溶于水,____出热量,故稀释浓硫酸时,一定要把______沿器壁慢慢注入______里,并用玻璃棒不断搅拌。切不可将_____倒进_________里!
3.下列说法错误的是( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,字迹会慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水里,并用玻璃棒不断搅拌。
D.稀硫酸稀盐酸都具有较强的腐蚀性。
( 第一课时 )
第七单元 常见的酸和碱
课题1 酸及其性质
学习目标:
1.能记住盐酸硫酸的主要物理性质和用途
2.能说出浓硫酸的特性和稀释方法
学习重点:
盐酸、硫酸的物理性质
同学们:
请大家想一想,日常生活中 有哪些食物给你留下这种印象?
吃起来有酸味
酸性物质有酸味
含有酸
碱面放多了的馒头
皮蛋
吃起来有涩味
碱性物质有涩味
含有碱
酸
盐酸、硫酸溶液、碳酸溶液都导电。
H2SO4 === 2H+ + SO42-
HCl === H+ + Cl-
H2CO3 === 2H+ + CO32-
—— 其溶液中阳离子全是H+的化合物。
酸的组成:
Cl —— 盐酸根
Cl- —— 盐酸根离子
( 一般 “ H开头 ”,
除H2O、H2O2 )
酸根离子
— “ H-酸根 ”
H
H
H
酸的定义:由H+和酸根离子构成的化合物。
阳离子全是H+
碱、
Ca(OH)2溶液、NaOH溶液都导电
NaOH === Na+ + OH-
1. 酸
—— 其溶液中阳离子全是H+的化合物。
Ca(OH)2 === Ca2+ + 2OH-
2. 碱
—— 其溶液中阴离子全是OH-的化合物。
碱组成:— “ 金属-OH ”
(一般 “ OH结尾 ” )
酸组成:— “ H-酸根 ”
( 一般 “ H开头 ” )
OH
OH
一. 盐酸
—— HCl气体 的水溶液
溶 液
(混合物)
溶质
一. 常见的酸
盐酸 HCl 硫酸H2SO4
硝酸 HNO3 碳酸 H2CO3
草酸 H2C2O4 醋酸CH3COOH......
一、盐酸(HCl)P2-3
1、盐酸的物理性质
纯净的浓盐酸
颜色、状态
打开瓶盖的现象
气 味
无色液体
产生 “白雾”
刺激性气味
产生“白雾”原因:
浓盐酸有挥发性,挥发出的HCl 气体跟空气中水蒸气接触,形成盐酸小液滴。
【 说明:①浓盐酸有挥发性 ②HCl气体极易溶于水 】
问1:实验室制CO2、H2为什么不用浓盐酸?
浓盐酸有强挥发性,挥发出
HCl气体使制取的气体不纯
问2:如何区别浓盐酸和稀盐酸?
打开瓶塞,有白雾的是浓盐酸;没有的为稀盐酸
闻气味,有刺激性气味的是浓盐酸;没有的为稀盐酸
问3:敞口放置浓盐酸,溶质的质量会 ,
溶质质量分数会 。
减小
减小
讨论
问4:在干燥的空气中打开浓盐酸的瓶盖,浓盐酸会不会挥发?会不会看到白雾?溶质质量分数有什么变化
浓盐酸会挥发出无色、 刺激性的HCl气体;
看不到;
溶质质量分数会减小
问5:收集氯化氢气体可以用什么方法进行收集? (H-1 Cl-35.5)
向上排空气法
硫酸
—世界上产量最大、用途最广、消耗最多的酸
—硫酸的用途P5
(二)硫酸 ( H2SO4)
无色、粘稠、油状、液体,
溶于水并放大量热,不易挥发;
1、浓硫酸的物理性质
有吸水性。
浓H2SO4可以干燥O2 、H2、CO2等气体,
但不能干燥碱性气体(氨气:NH3)。
—— 常做某些气体的干燥剂
·干燥剂的选择原则:有吸水性;
不和被干燥的物质反应。
① 吸水性
(二)硫酸
2、浓H2SO4的特性
浓硫酸
洗气瓶
被干燥的气体
干燥的气体
—— 做某些气体的干燥剂
① 吸水性
2、浓H2SO4的特性
① 吸水性
浓硫酸敞口放置:
溶质质量 溶剂质量 溶液质量 ,w% 。
浓盐酸敞口放置:
溶质质量 溶剂质量 溶液质量 ,w% 。
(二)硫酸
2、浓H2SO4的特性
—— 物理性质
② 强烈的腐蚀性
·脱水性
—— 做某些气体的干燥剂
① 吸水性
2、浓H2SO4的特性
现 象:变黑、炭化
注:吸水性 —— 物理性质
脱水性 —— 化学性质
(书:P3)
·稀硫酸滴到纸张或衣服上,水分逐渐蒸发,慢慢变成浓硫酸,同样会使纸张、衣服逐渐炭化。
② 强烈的腐蚀性
·脱水性
—— 做某些气体的干燥剂
① 吸水性
2、浓H2SO4的特性
浓硫酸能和金属反应,但不生产H2 ,也不是置换反应。
③ 强氧化性
★
———
★
———
【问题】若不慎将浓硫酸沾到皮肤或衣服上,应如何处理?(P3)
浓、稀硫酸的处理方法一样,(先用帕子擦干)立即用大量水冲洗,再涂上3%~5%的碳酸氢钠(NaHCO3)溶液。
显碱性
(1)注意!
稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并用玻璃棒不断搅拌。
切不可将水倒进浓硫酸里!
3、浓H2SO4的稀释( P3 )
(3)手的感觉:
分析:
(2)玻璃棒的作用:搅拌,散热
浓硫酸溶于水,要放热
发热、发烫
现象:
原因:
液滴飞溅
水的密度较小,
浮在浓硫酸上面,
溶解时放热使水沸腾,
造成硫酸液滴飞溅。
3、浓H2SO4的稀释
导管的作用:
保持气体流通,
维持压强平衡。
1)必须在广口瓶中配制,便于散热、搅拌
3、浓H2SO4的稀释 注意事项
2)必须酸沿器壁缓慢入水,边倒边搅拌,以免热量积累使液体飞溅
3)不能在量筒中稀释、配制。
4)不能在集气瓶等厚玻璃仪器稀释与配制。厚玻璃仪器如果内外受热不均会炸裂。
作业:
1.浓盐酸在空气中会形成_____,这是因为浓盐酸挥发出来的______跟空气中的水蒸气接触,形成__________________的缘故。
2.浓硫酸敞口放置在空气中,能吸收空气中的_______,说明浓硫酸具有______性。故可做某些气体的______剂。浓硫酸溶于水,____出热量,故稀释浓硫酸时,一定要把______沿器壁慢慢注入______里,并用玻璃棒不断搅拌。切不可将_____倒进_________里!
3.下列说法错误的是( )
A.打开浓盐酸的试剂瓶盖,瓶口出现白烟
B.用浓硫酸在白纸上写字,字迹会慢慢变黑
C.稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水里,并用玻璃棒不断搅拌。
D.稀硫酸稀盐酸都具有较强的腐蚀性。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
