人教版 高一化学 必修2 第二章-第二节-化学能与电能(共39张PPT)
文档属性
| 名称 | 人教版 高一化学 必修2 第二章-第二节-化学能与电能(共39张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-04-01 00:00:00 | ||
图片预览





文档简介
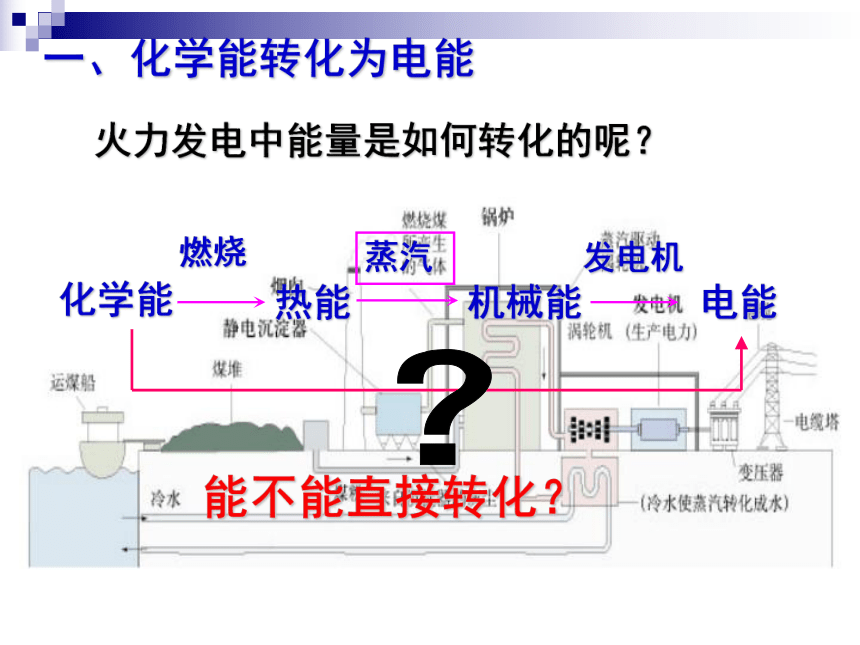
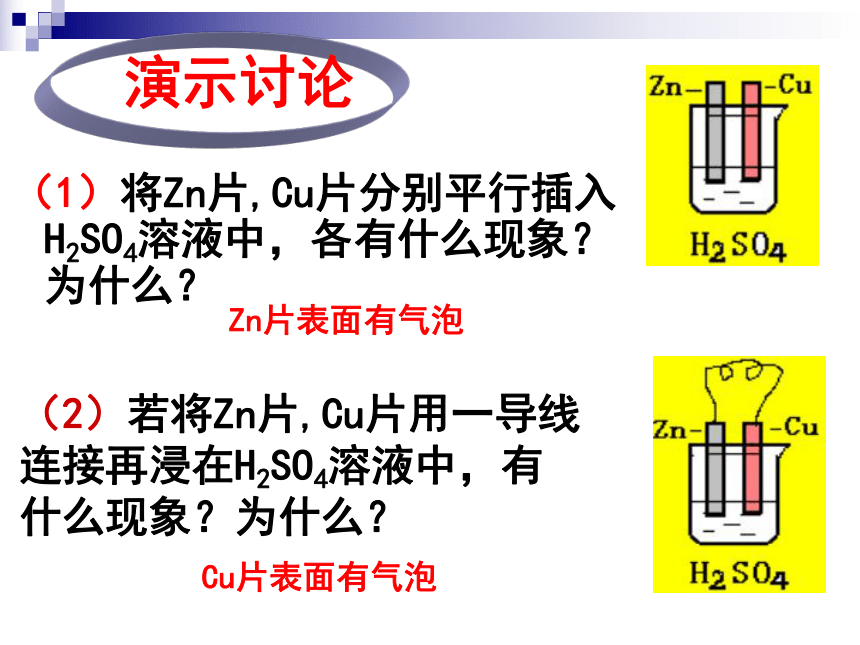
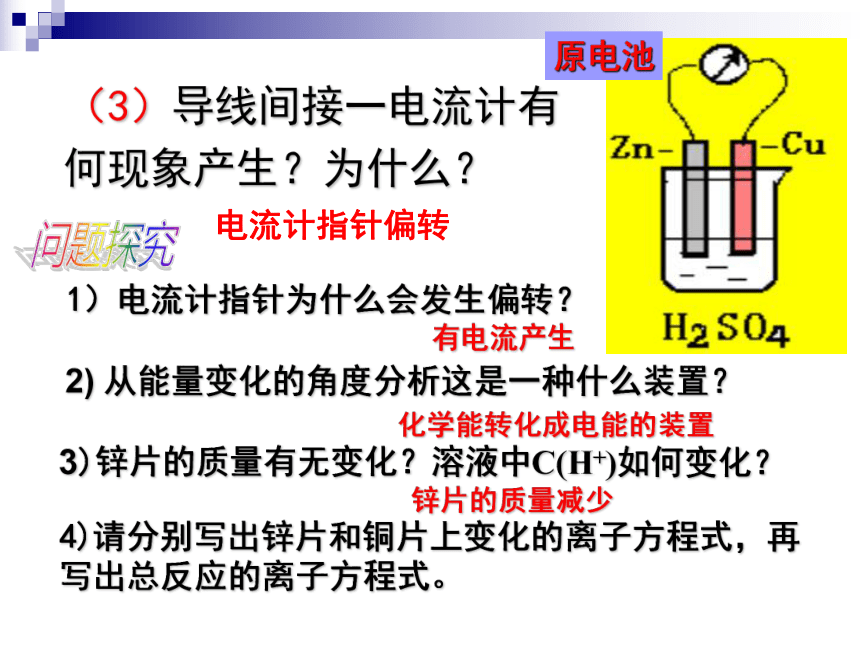
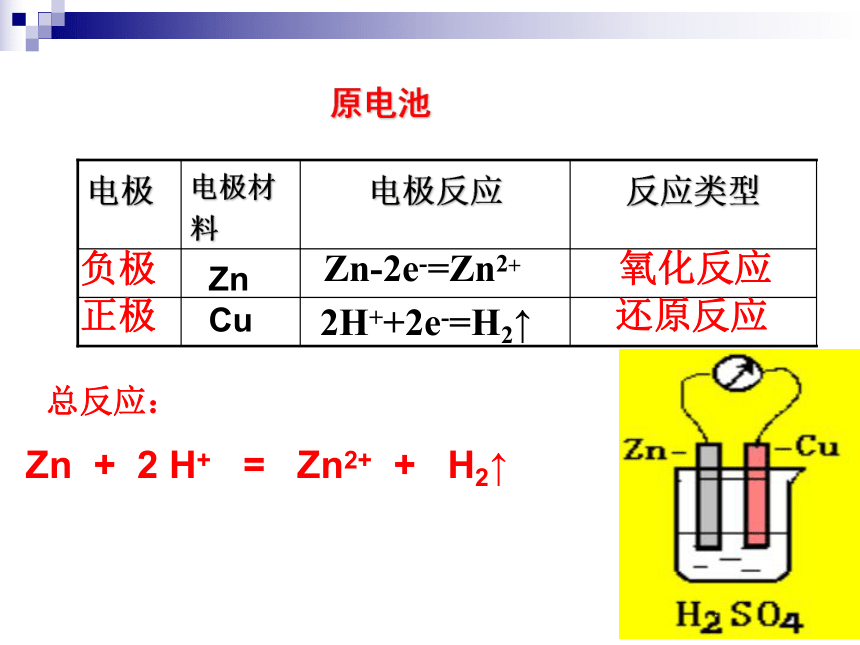
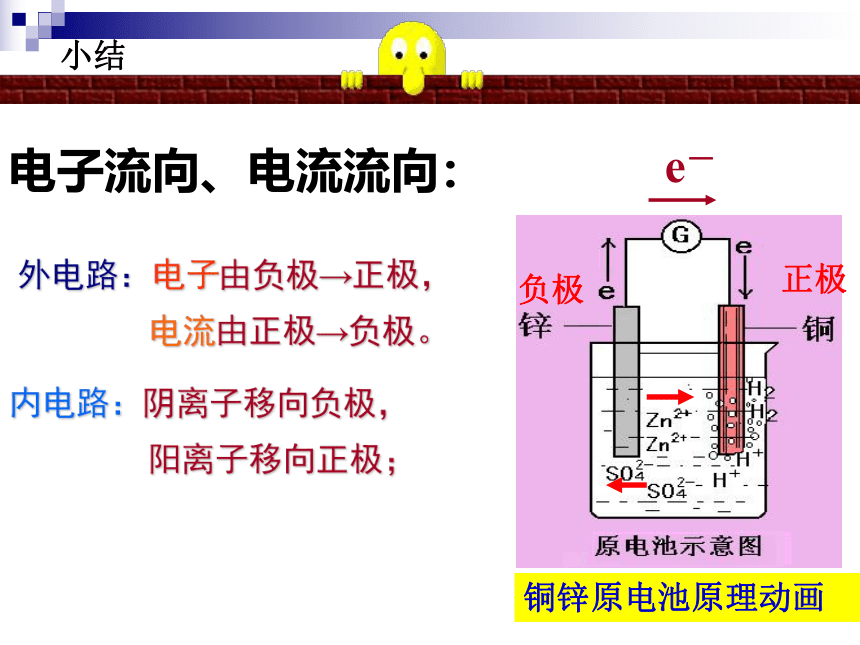
课件39张PPT。2-2 化学能与电能水力发电站火力发电站二次能源:一次能源经加工、转换得到的能源。一次能源:直接从自然界取得的能源。阅读教材P39 资料卡片指出下列哪些是二次能源?一、化学能转化为电能火力发电中能量是如何转化的呢?燃烧发电机 化学能 热能机械能电能(2)若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?(1)将Zn片,Cu片分别平行插入H2SO4溶液中,各有什么现象?为什么?演示讨论Zn片表面有气泡Cu片表面有气泡(3)导线间接一电流计有何现象产生?为什么?1)电流计指针为什么会发生偏转?3)锌片的质量有无变化?溶液中C(H+)如何变化?4)请分别写出锌片和铜片上变化的离子方程式,再写出总反应的离子方程式。2) 从能量变化的角度分析这是一种什么装置?问题探究电流计指针偏转有电流产生化学能转化成电能的装置锌片的质量减少原电池Zn-2e-=Zn2+氧化反应 2H++2e-=H2↑还原反应负极正极总反应:Zn + 2 H+ = Zn2+ + H2↑ZnCu原电池5)电子流动的方向如何?电子由锌片经导线流向铜片6)电流流动的方向如何?电流由铜片经导线流向锌片7)硫酸溶液中的阴、阳离子应该怎样运动?为什么?H+向Cu片定向移动;SO42-向Zn片定向移动;
保证电解质溶液中“电荷守恒”。 外电路:电子由负极→正极,
电流由正极→负极。
内电路:阴离子移向负极,
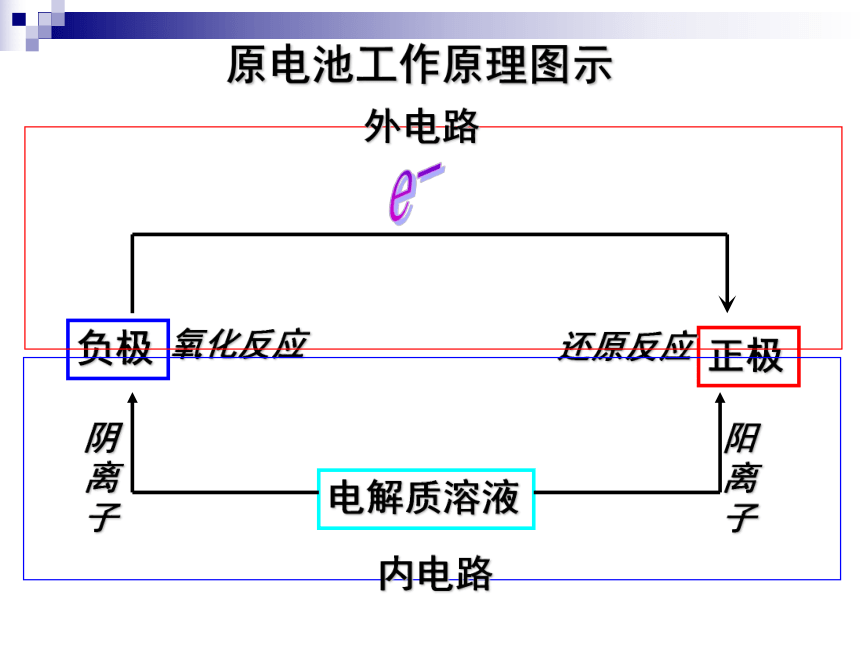
阳离子移向正极; 电子流向、电流流向:负极正极小结铜锌原电池原理动画原电池工作原理图示外电路内电路1、原电池:
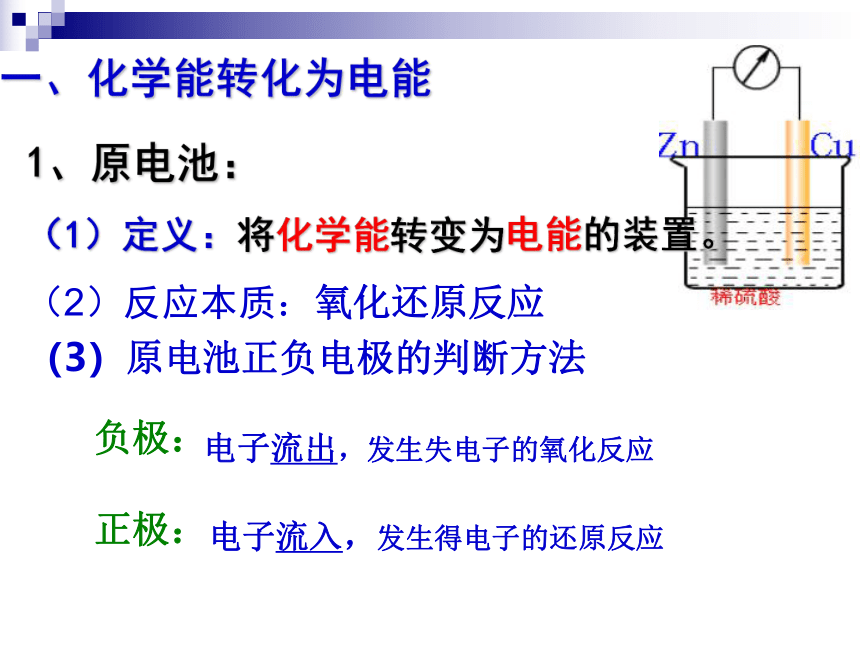
(1)定义:将化学能转变为电能的装置。(2)反应本质:氧化还原反应一、化学能转化为电能(3)原电池正负电极的判断方法负极:
正极: 电子流出,发生失电子的氧化反应电子流入,发生得电子的还原反应①根据电极材料判断负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体-+-+-+-+③根据电子或电流流动方向判断(外电路):④根据离子的定向移动方向(内电路)阳离子向正极移动阴离子向负极移动②根据电极反应判断失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极⑥根据现象判断电极不断溶解:负极有气泡冒出、有固体析出:正极⑤根据离子方程式判断(负极)(在正极)CH2SO4(不可以)(不可以)(可以)(不可以)2、原电池的构成条件1)两种活泼性不同的金属(或导电非金属) 作电极。3)两极相连形成闭合回路。2)电极材料均插到电解质溶液。 (负极在电解质溶液中能够输出电子。)两极一液成回路ABCDE√[练习1] 下列哪些装置能构成原电池?√F√√CFe酒精 J√3、原电池工作原理 ①在负极,物质失去电子发生氧化反应;
②电子通过导体经外电路由负极传导至正极;
③在正极,物质得到电子发生还原反应;
④电解质溶液中,阳离子向正极移动,阴离子向负极移动。实践活动
自制电池——水果电池。如下图:[例] X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>XC因为X置换出Z,所以金属性X>Z负极的金属较活泼,所以Y>X③判断金属活动性的强弱一般说来: 活泼金属作负极,较不活泼的金属作正极 请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: . 1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属 Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu ④制作化学电源[练习]把A,B两种不同的未知活泼性的金属用导线连接后同时插入稀硫酸中,结果发现A金属上有气体产生,则下列说法正确的是( )
A. A为正极,A较活泼 B. B为负极,B较活泼 C. A上发生的是氧化反应 D. A的质量减小B小结化
学
能
与
电
能间接:直接:装置原电池1.构成原电池的条件是什么?3.原电池的工作原理是什么?什么是原电池?4.2.将化学能转变为电能的装置原电池的正负极和电子流向如何判断?化学能与电能第二课时复习回忆1、简述原电池的工作原理; 氧化还原反应中,还原剂和氧化剂之间通过外电路间接地进行电子转移:
①在负极,物质失去电子发生氧化反应;
②电子通过导体经外电路由负极传导至正极;
③在正极,物质得到电子发生还原反应;
④电解质溶液中,阳离子向正极移动,阴离子向负极移动。 2、简述构成原电池必要条件;(1)两个电极(2)电解质溶液(3)形成闭合回路两极一液成回路1)化学电池有三大类型:
、 、 .
一次性电池 二次电池 燃料电池 2)特点:
①一次电池:不可充电,
如干电池(又称为锌锰电池,是最早使用的化学电池)
②二次电池:可循环利用,
放电过程是将 能转化为 能;
充电过程是将 能转化为 能。
③燃料电池:可不断充入氧化剂、还原剂连续使用,
最理想的燃料是 。(1)产物为水,无污染
(2)与其它能源比,反应相同质量,放出能量多
(3)来源广化学 电 电 化学H2 二、发展中的化学电源二、常见的化学电池1.干电池(一次性电池)电极:Zn为负极,碳棒为正极电解液:NH4Cl、ZnCl2和淀粉糊 另有黑色的MnO2粉末,吸收正极产生的H2,防止产生极化现象。电极方程式:负极(Zn):Zn-2e-=Zn2+正极(C):2MnO2 + 2NH4+ + 2e-= Mn2O3+2NH3+H2O(1)锌锰干电池(2)碱性锌锰干电池 随着用电器朝着小型化、多
功能化发展的要求,对电池的发
展也提出了小型化、多功能化发
展的要求。
体积小、性能好的碱性锌-锰电池应运而生。这类电池的重要特征是电解质溶液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。2、铅蓄电池(二次电池)铅蓄电池:
电极:Pb为负极, PbO2为正极.
电解液: 30%的H2SO4溶液
电极反应式:
放电时:为原电池
负极(Pb) :Pb+SO42--2e-=PbSO4
正极(PbO2) PbO2+4H++SO42-+2e-=PbSO4+2H2O
总电池反应:PbO2+Pb+2H2SO4=2PbSO4↓+2H2O
充电时:为电解池
阴极(Pb): PbSO4 +2e- = Pb+SO42-
阳极(PbO2) PbSO4+2H2O-2e-=PbO2+4H++SO42-
总电解反应:
2PbSO4+2H2O = PbO2+Pb+2H2SO4
通电3、锂电池锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。4、新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。氢氧燃料电池工作原理氢氧燃料电池
电极:Pt制作的惰性电极
反应原理:
a.电解质溶液:KOH溶液
负极:
正极:
总反应:
b.电解质溶液: HCl (盐酸)
负极 :
正极:
总反应:
? 2H2+4OH--4e-=4H2OO2+2H2O + 4e-=4OH -2H2+O2=2H2O2H2-4e-=4H+O2+4H++4e- =2H2O2H2+O2=2H2O银锌电池Zn为负极, Ag2O为正极
电解液: KOH溶液
电极反应式:
负极:Zn+2OH--2e-=Zn(OH)2
正极:Ag2O+H2O+2e-=2Ag+2OH-
总反应式:
Zn+Ag2O+H2O=2Ag+Zn(OH)2氢氧燃料电池:2H2+O2=2H2O银锌电池:Zn+Ag2O+H2O=2Ag+Zn(OH)2铅蓄电池:
保证电解质溶液中“电荷守恒”。 外电路:电子由负极→正极,
电流由正极→负极。
内电路:阴离子移向负极,
阳离子移向正极; 电子流向、电流流向:负极正极小结铜锌原电池原理动画原电池工作原理图示外电路内电路1、原电池:
(1)定义:将化学能转变为电能的装置。(2)反应本质:氧化还原反应一、化学能转化为电能(3)原电池正负电极的判断方法负极:
正极: 电子流出,发生失电子的氧化反应电子流入,发生得电子的还原反应①根据电极材料判断负极: 较活泼的金属
正极: 较不活泼的金属或非金属导体-+-+-+-+③根据电子或电流流动方向判断(外电路):④根据离子的定向移动方向(内电路)阳离子向正极移动阴离子向负极移动②根据电极反应判断失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极⑥根据现象判断电极不断溶解:负极有气泡冒出、有固体析出:正极⑤根据离子方程式判断(负极)(在正极)CH2SO4(不可以)(不可以)(可以)(不可以)2、原电池的构成条件1)两种活泼性不同的金属(或导电非金属) 作电极。3)两极相连形成闭合回路。2)电极材料均插到电解质溶液。 (负极在电解质溶液中能够输出电子。)两极一液成回路ABCDE√[练习1] 下列哪些装置能构成原电池?√F√√CFe酒精 J√3、原电池工作原理 ①在负极,物质失去电子发生氧化反应;
②电子通过导体经外电路由负极传导至正极;
③在正极,物质得到电子发生还原反应;
④电解质溶液中,阳离子向正极移动,阴离子向负极移动。实践活动
自制电池——水果电池。如下图:[例] X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>XC因为X置换出Z,所以金属性X>Z负极的金属较活泼,所以Y>X③判断金属活动性的强弱一般说来: 活泼金属作负极,较不活泼的金属作正极 请结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+设计成一个原电池。1、电解液: 。
2、电极材料:
正极 ,负极 。
3、电极反应式 :
负极: .
正极: . 1、电解液:
硫酸铜、氯化铜、硝酸铜等可溶性铜盐溶液
2、电极材料:
负极:铁,
正极:铜、石墨或比铁不活泼的其他金属 Fe - 2e - = Fe 2+
Cu2+ +2e - = Cu ④制作化学电源[练习]把A,B两种不同的未知活泼性的金属用导线连接后同时插入稀硫酸中,结果发现A金属上有气体产生,则下列说法正确的是( )
A. A为正极,A较活泼 B. B为负极,B较活泼 C. A上发生的是氧化反应 D. A的质量减小B小结化
学
能
与
电
能间接:直接:装置原电池1.构成原电池的条件是什么?3.原电池的工作原理是什么?什么是原电池?4.2.将化学能转变为电能的装置原电池的正负极和电子流向如何判断?化学能与电能第二课时复习回忆1、简述原电池的工作原理; 氧化还原反应中,还原剂和氧化剂之间通过外电路间接地进行电子转移:
①在负极,物质失去电子发生氧化反应;
②电子通过导体经外电路由负极传导至正极;
③在正极,物质得到电子发生还原反应;
④电解质溶液中,阳离子向正极移动,阴离子向负极移动。 2、简述构成原电池必要条件;(1)两个电极(2)电解质溶液(3)形成闭合回路两极一液成回路1)化学电池有三大类型:
、 、 .
一次性电池 二次电池 燃料电池 2)特点:
①一次电池:不可充电,
如干电池(又称为锌锰电池,是最早使用的化学电池)
②二次电池:可循环利用,
放电过程是将 能转化为 能;
充电过程是将 能转化为 能。
③燃料电池:可不断充入氧化剂、还原剂连续使用,
最理想的燃料是 。(1)产物为水,无污染
(2)与其它能源比,反应相同质量,放出能量多
(3)来源广化学 电 电 化学H2 二、发展中的化学电源二、常见的化学电池1.干电池(一次性电池)电极:Zn为负极,碳棒为正极电解液:NH4Cl、ZnCl2和淀粉糊 另有黑色的MnO2粉末,吸收正极产生的H2,防止产生极化现象。电极方程式:负极(Zn):Zn-2e-=Zn2+正极(C):2MnO2 + 2NH4+ + 2e-= Mn2O3+2NH3+H2O(1)锌锰干电池(2)碱性锌锰干电池 随着用电器朝着小型化、多
功能化发展的要求,对电池的发
展也提出了小型化、多功能化发
展的要求。
体积小、性能好的碱性锌-锰电池应运而生。这类电池的重要特征是电解质溶液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。2、铅蓄电池(二次电池)铅蓄电池:
电极:Pb为负极, PbO2为正极.
电解液: 30%的H2SO4溶液
电极反应式:
放电时:为原电池
负极(Pb) :Pb+SO42--2e-=PbSO4
正极(PbO2) PbO2+4H++SO42-+2e-=PbSO4+2H2O
总电池反应:PbO2+Pb+2H2SO4=2PbSO4↓+2H2O
充电时:为电解池
阴极(Pb): PbSO4 +2e- = Pb+SO42-
阳极(PbO2) PbSO4+2H2O-2e-=PbO2+4H++SO42-
总电解反应:
2PbSO4+2H2O = PbO2+Pb+2H2SO4
通电3、锂电池锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。4、新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。氢氧燃料电池工作原理氢氧燃料电池
电极:Pt制作的惰性电极
反应原理:
a.电解质溶液:KOH溶液
负极:
正极:
总反应:
b.电解质溶液: HCl (盐酸)
负极 :
正极:
总反应:
? 2H2+4OH--4e-=4H2OO2+2H2O + 4e-=4OH -2H2+O2=2H2O2H2-4e-=4H+O2+4H++4e- =2H2O2H2+O2=2H2O银锌电池Zn为负极, Ag2O为正极
电解液: KOH溶液
电极反应式:
负极:Zn+2OH--2e-=Zn(OH)2
正极:Ag2O+H2O+2e-=2Ag+2OH-
总反应式:
Zn+Ag2O+H2O=2Ag+Zn(OH)2氢氧燃料电池:2H2+O2=2H2O银锌电池:Zn+Ag2O+H2O=2Ag+Zn(OH)2铅蓄电池:
