第五单元同步测试(苏教版八年级下)
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
安徽省新安中学2008—2009学年度第二学期高二年级期末考试
化学试卷(命题人:李永志090622)
★温馨提示:
①可能用到的相对原子质量:H 1 0 16 Ca 40 C 12 Na 23 N 14 Zn 65 S 32
②答案均填入答题卡,否则一律不得分
③考试时间:100分钟. 该卷为综合卷但以选修4知识点为主.
④认真审题,细心答卷.
第Ⅰ卷选择题(54分)
一、选择题(18×3分=54分, 每题只有一个正确答案)
1.6月14日世界卫生组织把H1N1流感流行级别上升到第六级,达菲(Tamiflu)目前被世界卫生组织推荐作为治疗和预防甲型H1N1流感病的有效药物之一,它是由我国特有中药材八角的提取物——莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下:
( http: / / www.21cnjy.com / ) ( http: / / www. / )
下列判断正确的是 ( )
A.它们互为同系物 B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲在热的NaOH溶液中能稳定存在 D.莽草酸的分子式为C7H10O5
2. 《中华食谱》中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有较多的维生素C,两者同食时,五价砷和维生素C会发生反应生成有毒的三价砷。下列说法中正确的是( )w.w.w.k.s.5.u.c.o.m
A. 在该反应中维生素C作催化剂
B. 因为三价砷的氧化性强于五价砷,所以三价砷毒性更强
C. 五价砷的氧化性较强,三价砷为其还原产物
D.砷与氮位于同一主族,可知砷酸的酸性强于硝酸
3. CCTV—10的《走近科学》栏目曾报道过某地一风水师帮一农妇家除“水鬼”的事。除“水鬼”过程中风水师围着一盆水慢慢走动,嘴中还念念有词,不一会儿他把手往水中一指,水中突然出现一物体在水面上四处游动,并发出“咝咝”的响声,不久后它便消失了。风水师说这是“水鬼”作怪,实际上是他往水中扔了一种金属单质,这种金属单质可能是( )
A. 钠 B. 镁 C. 铝 D. 铁
4.下列化学用语的表达中正确的是( )
( http: / / www. / )
5. 下列离子方程式书写正确的是( )
A. 用食醋除去水壶内的水垢:CaCO3 + 2H+ == Ca2+ + CO2↑+ H2O
B. 向AgCl的悬浊液中加入KI溶液生成黄色沉淀:AgCl + I- AgI + Cl-
C. 用石墨作电极电解MgCl2溶液:2Cl-+ H2O ==== Cl2↑+ H2↑+ 2OH-
D. Ba(OH)2溶液与CuSO4溶液混合:Ba2+ + SO42-== BaSO4↓
6. 一定温度下,某密闭容器中存在可逆反应:X Y + Z,其化学反应速率随时间变化的图像如下图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法中不正确的是( )
A. X在该条件下一定不是气体
B. Y和Z在该条件下至少有一种是气体
C. 由t1到t3,平衡并未发生移动
D. t3时刻达到平衡时与t1时刻平衡时,
气态物质的浓度相同
7.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
8、下列叙述中,正确的是( )
A.溶度积大的化合物溶解度肯定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
9. 有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强到弱的顺序是 ( )21世纪教育网
A. HX. HY. HZ B. HZ. HY. HX
C. HX. HZ. HY D. HY. HZ. HX
10.下列叙述正确的是(用NA代表阿伏加德罗常数的值) ( )
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
11.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.[NO3-]>[OH-]>[NH4+]>[Ba2+] B.[NO3-]>[Ba2+]>[OH-]>[NH4+]
C.[Ba2+]>[NO3-]>[OH-]>[NH4+] D.[NO3-]>[Ba2+]>[NH4+]>[OH-]
12. 已知25℃时某些弱酸的电离常数如下表:
弱酸 CH3COOH HCN H2CO3
电离常数 1.8×10-5 4.9×10-10 K1=4.4×10-7K2=4.7×10-11
则下列说法中不正确的是( )21世纪教育网
A. 25℃时,等物质的量浓度的各溶液的pH:Na2CO3>NaCN>CH3COONa
B. a mol·L-1的HCN溶液与b mol·L-1的NaOH溶液等体积混合后,若所得溶液中c (Na+) = c (CN-),则a 一定大于b
C. 25℃时,若向0.1mol·L-1的醋酸溶液中逐滴加水,则醋酸溶液的导电性、溶液的pH均增大
D.将一定量CO2通入NaOH溶液后,所得溶液中一定存在:c(Na+) + c(H+) 2c(CO32-) + c(HCO3-) + c(OH-)
13.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li的高分子材料。这种锂离子电池的电池反应为:
Li+2Li
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e=Li
B.充电时,Li既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li向负极移动
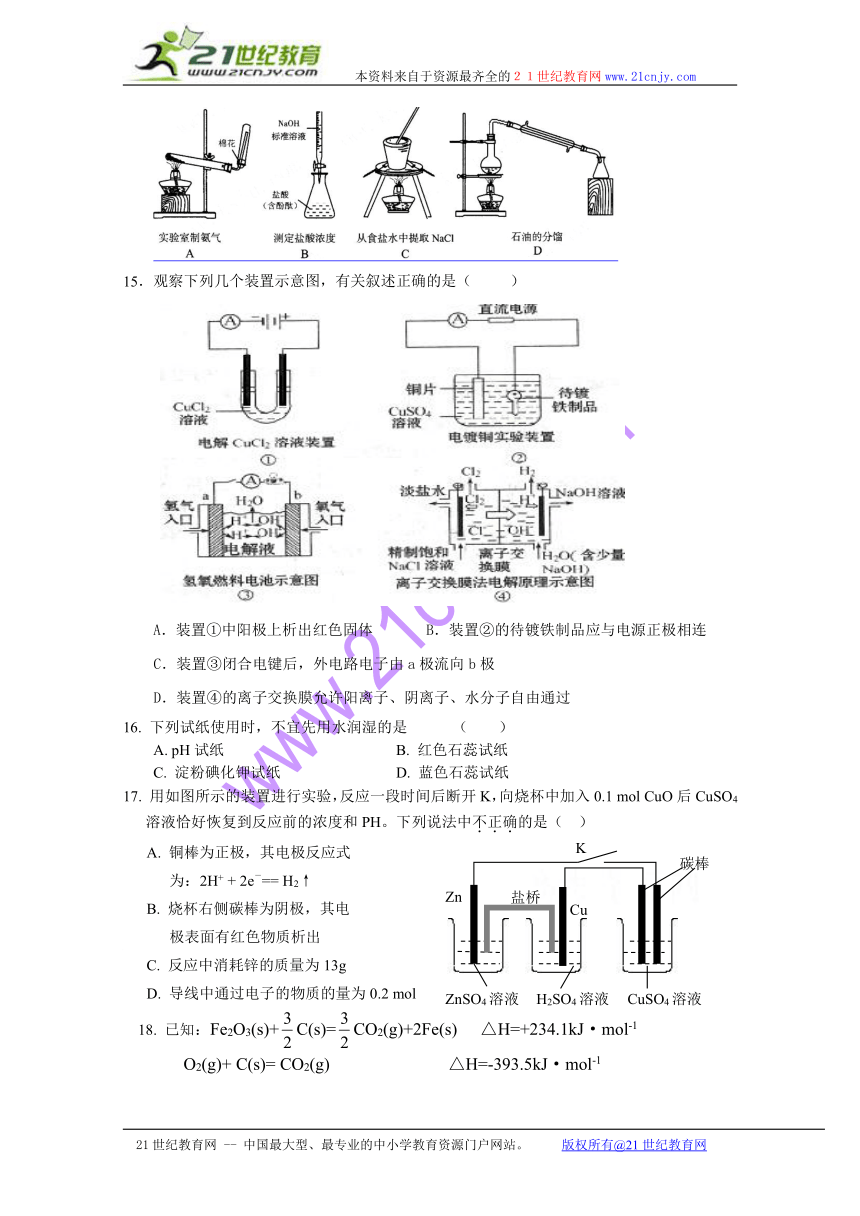
14.下列实验装置设计正确,且能达到目的的是:( )
( http: / / www.21cnjy.com / )
15.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
16. 下列试纸使用时,不宜先用水润湿的是 ( )21世纪教育网
A. pH试纸 B. 红色石蕊试纸
C. 淀粉碘化钾试纸 D. 蓝色石蕊试纸
17. 用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和PH。下列说法中不正确的是( )
A. 铜棒为正极,其电极反应式
为:2H+ + 2e-== H2↑
B. 烧杯右侧碳棒为阴极,其电
极表面有红色物质析出
C. 反应中消耗锌的质量为13g
D. 导线中通过电子的物质的量为0.2 mol
18. 已知:Fe2O3(s)+C(s)=CO2(g)+2Fe(s) △H=+234.1kJ·mol-1
O2(g)+ C(s)= CO2(g) △H=-393.5kJ·mol-1
则:2Fe(s)+O2(g) =Fe2O3(s)的△H是( )
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
第Ⅱ卷(非选择题,共46分)
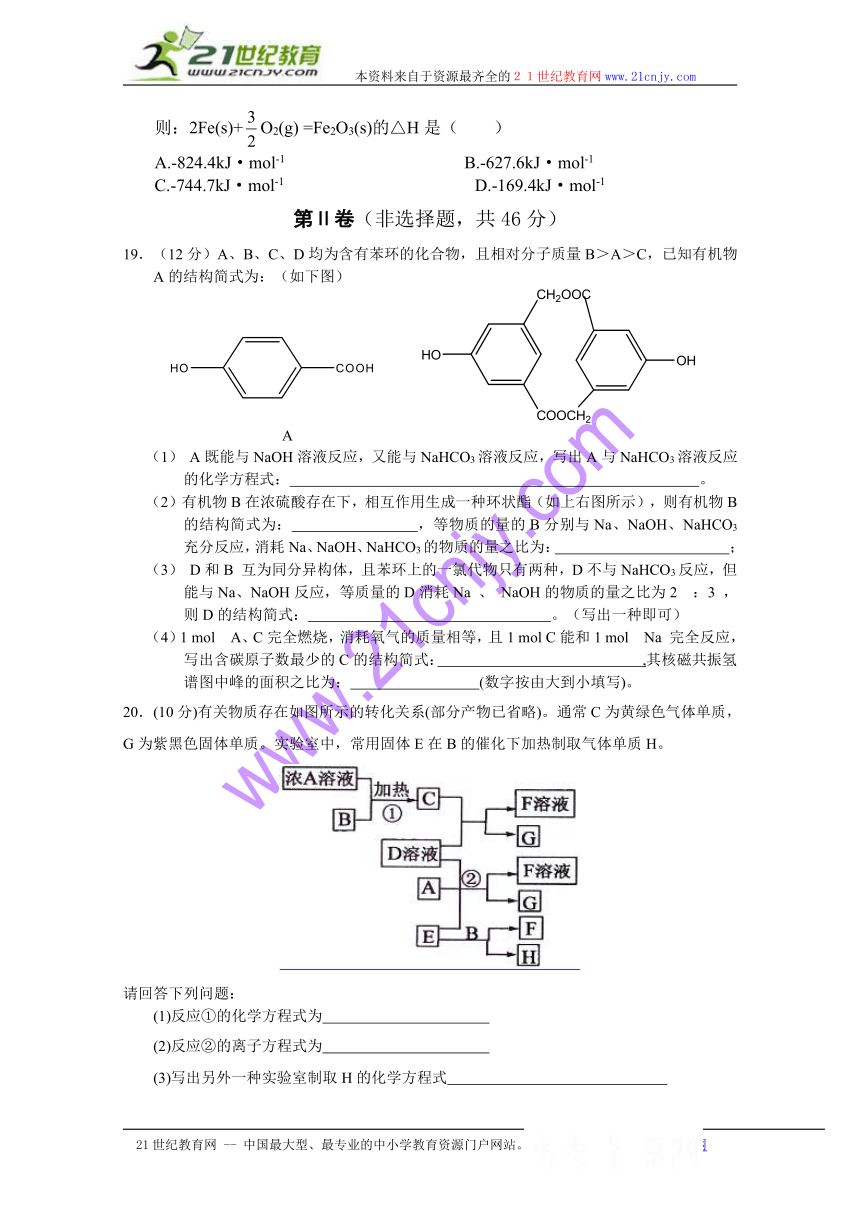
19.(12分)A、B、C、D均为含有苯环的化合物,且相对分子质量B>A>C,已知有机物A的结构简式为:(如下图)
A
(1) A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A与NaHCO3溶液反应的化学方程式: 。
(2)有机物B在浓硫酸存在下,相互作用生成一种环状酯(如上右图所示),则有机物B的结构简式为: ,等物质的量的B分别与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为: ;
(3) D和B 互为同分异构体,且苯环上的一氯代物只有两种,D不与NaHCO3反应,但能与Na、NaOH反应,等质量的D消耗Na 、 NaOH的物质的量之比为2 :3 ,则D的结构简式: 。(写出一种即可)
(4)1 mol A、C完全燃烧,消耗氧气的质量相等,且1 mol C能和1 mol Na 完全反应,写出含碳原子数最少的C的结构简式: ,其核磁共振氢谱图中峰的面积之比为: (数字按由大到小填写)。
20.(10分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C为黄绿色气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
( http: / / www.21cnjy.com / )
请回答下列问题:21世纪教育网
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
21.(12分)Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1) 甲同学取一束细铁丝用砂纸打磨后在酒精灯上加热至红热,再伸入到盛氯气的集气瓶中。在实验之前集气瓶底部应该放少量_________,该反应的化学方程式为________________________________。
(2) 乙同学为验证Fe在冷的浓硝酸中发生钝化但能和热的浓硝酸反应,设计了如图所示的实验,请你指出其中的一处错误_________________。
(3) 丙同学在Fe和浓硝酸反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一段时间后不再溶解。丙同学对该反应过程中使Cu溶解的氧化剂作了如下几种猜想:
猜想一:全部是HNO3
猜想二:全部是Fe3+
猜想三:________________________
(4)丁同学认为猜想一肯定错误,其理由是_________________________________。请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 __________________________________________________。
22.(12分)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O2NH3+O2.
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃ 30 40 50
生成NH3量/(10mo1) 4.8 5.9 6.0
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(2)该反应过程与能量关系可用右图表示.
完成反应的热化学方程式:
。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g)2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)N2(g)十3H2(g)的平衡常数为 。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mo1,H2为2.0 mol,则 , 。
21世纪教育网
安徽省新安中学2008—2009学年度第二学期高二年级期末考试21世纪教育网 化学试卷答题卡
第Ⅰ卷选择题(54分)
一、选择题(18×3分=54分, 每题只有一个正确答案)
题号 1 2 3 4 5 6 7 8 9
答案
题号 10 11 12 13 14 15 16 17 18
答案
第Ⅱ卷(非选择题,共46分)
19.(12分)21世纪教育网
(1)写出A与NaHCO3溶液反应的化学方程式:
。
(2)有机物B的结构简式为: ,等物质的量的B分别与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为: ;
(3)D的结构简式: 。(写出一种即可)
(4)写出含碳原子数最少的C的结构简式: ,其核磁共振氢谱图中峰的面积之比为: (数字按由大到小填写)。
20.(10分)
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
21.(12分)
(1)在实验之前集气瓶底部应该放少量_________,该反应的化学方程式为____________________________________________________________________________。
(2)请你指出其中的一处错误____________________________________________________
____________________________________________________________________________。
(3)猜想三:___________________________________________________________________。
(4)丁同学认为猜想一肯定错误,其理由是_________________________________________
___________________________________________________________________________。具体的操作和实验现象 ___________________________________________________
___________________________________________________________________________。
22.(12分)
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(2)该反应过程与能量关系可用右图表示.
完成反应的热化学方程式:
。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g)2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)N2(g)十3H2(g)的平衡常数为 。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mo1,H2为2.0 mol,则 , 。
21世纪教育网
安徽省新安中学2008—2009学年度第二学期高二年级期末考试21世纪教育网 化学参考答案
第I卷选择题(54分)
一、选择题(18×3分=54分, 每题只有一个正确答案)
题号 1 2 3 4 5 6 7 8 9
答案 D C A D B C D B B
题号 10 11 12 13 14 15 16 17 18
答案 C B C D A C A C A
第Ⅱ卷(非选择题,共46分)
19.(12分,每空2分) (1)
HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 3:2:1
(2)
(3) HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 或(HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 其它合理答案均可)
(4) HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 2:2:1:1
20(10分)21世纪教育网
(1)(2分)
(2) (3分)
(3)或(其他合理答案也给分)(2分)
(4)(3分)
21:(12分,每空2分). (1) 沙子(合理均可) 2Fe + 3Cl2 ==== 2FeCl3
(2)加热液体的试管应与桌面成450角向上倾斜而不应垂直向上。
(3) 既有HNO3又有Fe3+ (4) Fe和硝酸反应后的溶液中若有HNO3则一定有Fe3+,Fe3+也能氧化Cu; 取与Cu片反应完全后的溶液少许于试管中,滴加适量的KSCN溶液,不出现血红色,再滴加适量新制氯水,出现血红色
22.(12分,每空2分)(1)2.5×l0(2分)21世纪教育网
(2)N2(g)+3H2O(1)2NH3(g)+O2(g)△H=+765.2kJ·mol-1 (2分)
(3)升高温度;加压;不断移出生成物脱离反应体系(合理均可,2分)
(4)①0.9375 或 (2分)②0.7 (2分)3.2(2分)
解析:(1)
(3分)
(4)① N2(g)+ 3H2(g)2NH3(g)
起始/mol 0.80 1.60 0
转化/mol 3 2
平衡n/mol 0.80— 1.60一3 2
解得:
则HYPERLINK " http://www./" EMBED Equation.DSMT4
② 由温度相同知设平衡时N2物质的量为
HYPERLINK " http://www./" EMBED Equation.DSMT4
由等效转化可求起始时N2、H2的物质的量。
21世纪教育网
www.
www.
21世纪教育网
www.
电解
t1
t3
v (正)
v (逆)
v (正)
v (逆)
v
t2
t
Zn
K
盐桥
碳棒
ZnSO4溶液
H2SO4溶液
CuSO4溶液
Cu
足量的
NaOH溶液
装置1:Fe在冷的
浓HNO3中钝化
装置2:Fe和热的
浓HNO3反应
2NH3(g)+O2(g)
N2(g)+3H2O(l)
△H=765.2kJ·mol-1
能量
反应过程
2NH3(g)+O2(g)
N2(g)+3H2O(l)
△H=765.2kJ·mol-1
能量
反应过程
点燃
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
安徽省新安中学2008—2009学年度第二学期高二年级期末考试
化学试卷(命题人:李永志090622)
★温馨提示:
①可能用到的相对原子质量:H 1 0 16 Ca 40 C 12 Na 23 N 14 Zn 65 S 32
②答案均填入答题卡,否则一律不得分
③考试时间:100分钟. 该卷为综合卷但以选修4知识点为主.
④认真审题,细心答卷.
第Ⅰ卷选择题(54分)
一、选择题(18×3分=54分, 每题只有一个正确答案)
1.6月14日世界卫生组织把H1N1流感流行级别上升到第六级,达菲(Tamiflu)目前被世界卫生组织推荐作为治疗和预防甲型H1N1流感病的有效药物之一,它是由我国特有中药材八角的提取物——莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下:
( http: / / www.21cnjy.com / ) ( http: / / www. / )
下列判断正确的是 ( )
A.它们互为同系物 B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲在热的NaOH溶液中能稳定存在 D.莽草酸的分子式为C7H10O5
2. 《中华食谱》中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有较多的维生素C,两者同食时,五价砷和维生素C会发生反应生成有毒的三价砷。下列说法中正确的是( )w.w.w.k.s.5.u.c.o.m
A. 在该反应中维生素C作催化剂
B. 因为三价砷的氧化性强于五价砷,所以三价砷毒性更强
C. 五价砷的氧化性较强,三价砷为其还原产物
D.砷与氮位于同一主族,可知砷酸的酸性强于硝酸
3. CCTV—10的《走近科学》栏目曾报道过某地一风水师帮一农妇家除“水鬼”的事。除“水鬼”过程中风水师围着一盆水慢慢走动,嘴中还念念有词,不一会儿他把手往水中一指,水中突然出现一物体在水面上四处游动,并发出“咝咝”的响声,不久后它便消失了。风水师说这是“水鬼”作怪,实际上是他往水中扔了一种金属单质,这种金属单质可能是( )
A. 钠 B. 镁 C. 铝 D. 铁
4.下列化学用语的表达中正确的是( )
( http: / / www. / )
5. 下列离子方程式书写正确的是( )
A. 用食醋除去水壶内的水垢:CaCO3 + 2H+ == Ca2+ + CO2↑+ H2O
B. 向AgCl的悬浊液中加入KI溶液生成黄色沉淀:AgCl + I- AgI + Cl-
C. 用石墨作电极电解MgCl2溶液:2Cl-+ H2O ==== Cl2↑+ H2↑+ 2OH-
D. Ba(OH)2溶液与CuSO4溶液混合:Ba2+ + SO42-== BaSO4↓
6. 一定温度下,某密闭容器中存在可逆反应:X Y + Z,其化学反应速率随时间变化的图像如下图所示,其中t1时刻达到平衡,t2时刻缩小容器体积,t3时刻重新达到平衡,下列有关说法中不正确的是( )
A. X在该条件下一定不是气体
B. Y和Z在该条件下至少有一种是气体
C. 由t1到t3,平衡并未发生移动
D. t3时刻达到平衡时与t1时刻平衡时,
气态物质的浓度相同
7.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
8、下列叙述中,正确的是( )
A.溶度积大的化合物溶解度肯定大
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.AgCl水溶液的导电性很弱,所以AgCl为弱电解质
9. 有相同pH的三种酸HX、HY、HZ的溶液,稀释相同倍数后,pH的变化值依次增大,则HX、HY、HZ的酸性由强到弱的顺序是 ( )21世纪教育网
A. HX. HY. HZ B. HZ. HY. HX
C. HX. HZ. HY D. HY. HZ. HX
10.下列叙述正确的是(用NA代表阿伏加德罗常数的值) ( )
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
11.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.[NO3-]>[OH-]>[NH4+]>[Ba2+] B.[NO3-]>[Ba2+]>[OH-]>[NH4+]
C.[Ba2+]>[NO3-]>[OH-]>[NH4+] D.[NO3-]>[Ba2+]>[NH4+]>[OH-]
12. 已知25℃时某些弱酸的电离常数如下表:
弱酸 CH3COOH HCN H2CO3
电离常数 1.8×10-5 4.9×10-10 K1=4.4×10-7K2=4.7×10-11
则下列说法中不正确的是( )21世纪教育网
A. 25℃时,等物质的量浓度的各溶液的pH:Na2CO3>NaCN>CH3COONa
B. a mol·L-1的HCN溶液与b mol·L-1的NaOH溶液等体积混合后,若所得溶液中c (Na+) = c (CN-),则a 一定大于b
C. 25℃时,若向0.1mol·L-1的醋酸溶液中逐滴加水,则醋酸溶液的导电性、溶液的pH均增大
D.将一定量CO2通入NaOH溶液后,所得溶液中一定存在:c(Na+) + c(H+) 2c(CO32-) + c(HCO3-) + c(OH-)
13.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li的高分子材料。这种锂离子电池的电池反应为:
Li+2Li
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e=Li
B.充电时,Li既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li向负极移动
14.下列实验装置设计正确,且能达到目的的是:( )
( http: / / www.21cnjy.com / )
15.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
16. 下列试纸使用时,不宜先用水润湿的是 ( )21世纪教育网
A. pH试纸 B. 红色石蕊试纸
C. 淀粉碘化钾试纸 D. 蓝色石蕊试纸
17. 用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和PH。下列说法中不正确的是( )
A. 铜棒为正极,其电极反应式
为:2H+ + 2e-== H2↑
B. 烧杯右侧碳棒为阴极,其电
极表面有红色物质析出
C. 反应中消耗锌的质量为13g
D. 导线中通过电子的物质的量为0.2 mol
18. 已知:Fe2O3(s)+C(s)=CO2(g)+2Fe(s) △H=+234.1kJ·mol-1
O2(g)+ C(s)= CO2(g) △H=-393.5kJ·mol-1
则:2Fe(s)+O2(g) =Fe2O3(s)的△H是( )
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
第Ⅱ卷(非选择题,共46分)
19.(12分)A、B、C、D均为含有苯环的化合物,且相对分子质量B>A>C,已知有机物A的结构简式为:(如下图)
A
(1) A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A与NaHCO3溶液反应的化学方程式: 。
(2)有机物B在浓硫酸存在下,相互作用生成一种环状酯(如上右图所示),则有机物B的结构简式为: ,等物质的量的B分别与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为: ;
(3) D和B 互为同分异构体,且苯环上的一氯代物只有两种,D不与NaHCO3反应,但能与Na、NaOH反应,等质量的D消耗Na 、 NaOH的物质的量之比为2 :3 ,则D的结构简式: 。(写出一种即可)
(4)1 mol A、C完全燃烧,消耗氧气的质量相等,且1 mol C能和1 mol Na 完全反应,写出含碳原子数最少的C的结构简式: ,其核磁共振氢谱图中峰的面积之比为: (数字按由大到小填写)。
20.(10分)有关物质存在如图所示的转化关系(部分产物已省略)。通常C为黄绿色气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
( http: / / www.21cnjy.com / )
请回答下列问题:21世纪教育网
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
21.(12分)Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1) 甲同学取一束细铁丝用砂纸打磨后在酒精灯上加热至红热,再伸入到盛氯气的集气瓶中。在实验之前集气瓶底部应该放少量_________,该反应的化学方程式为________________________________。
(2) 乙同学为验证Fe在冷的浓硝酸中发生钝化但能和热的浓硝酸反应,设计了如图所示的实验,请你指出其中的一处错误_________________。
(3) 丙同学在Fe和浓硝酸反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一段时间后不再溶解。丙同学对该反应过程中使Cu溶解的氧化剂作了如下几种猜想:
猜想一:全部是HNO3
猜想二:全部是Fe3+
猜想三:________________________
(4)丁同学认为猜想一肯定错误,其理由是_________________________________。请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 __________________________________________________。
22.(12分)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O2NH3+O2.
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃ 30 40 50
生成NH3量/(10mo1) 4.8 5.9 6.0
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(2)该反应过程与能量关系可用右图表示.
完成反应的热化学方程式:
。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g)2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)N2(g)十3H2(g)的平衡常数为 。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mo1,H2为2.0 mol,则 , 。
21世纪教育网
安徽省新安中学2008—2009学年度第二学期高二年级期末考试21世纪教育网 化学试卷答题卡
第Ⅰ卷选择题(54分)
一、选择题(18×3分=54分, 每题只有一个正确答案)
题号 1 2 3 4 5 6 7 8 9
答案
题号 10 11 12 13 14 15 16 17 18
答案
第Ⅱ卷(非选择题,共46分)
19.(12分)21世纪教育网
(1)写出A与NaHCO3溶液反应的化学方程式:
。
(2)有机物B的结构简式为: ,等物质的量的B分别与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为: ;
(3)D的结构简式: 。(写出一种即可)
(4)写出含碳原子数最少的C的结构简式: ,其核磁共振氢谱图中峰的面积之比为: (数字按由大到小填写)。
20.(10分)
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
21.(12分)
(1)在实验之前集气瓶底部应该放少量_________,该反应的化学方程式为____________________________________________________________________________。
(2)请你指出其中的一处错误____________________________________________________
____________________________________________________________________________。
(3)猜想三:___________________________________________________________________。
(4)丁同学认为猜想一肯定错误,其理由是_________________________________________
___________________________________________________________________________。具体的操作和实验现象 ___________________________________________________
___________________________________________________________________________。
22.(12分)
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(2)该反应过程与能量关系可用右图表示.
完成反应的热化学方程式:
。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g)2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)N2(g)十3H2(g)的平衡常数为 。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mo1,H2为2.0 mol,则 , 。
21世纪教育网
安徽省新安中学2008—2009学年度第二学期高二年级期末考试21世纪教育网 化学参考答案
第I卷选择题(54分)
一、选择题(18×3分=54分, 每题只有一个正确答案)
题号 1 2 3 4 5 6 7 8 9
答案 D C A D B C D B B
题号 10 11 12 13 14 15 16 17 18
答案 C B C D A C A C A
第Ⅱ卷(非选择题,共46分)
19.(12分,每空2分) (1)
HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 3:2:1
(2)
(3) HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 或(HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 其它合理答案均可)
(4) HYPERLINK " http://www./" EMBED ChemDraw.Document.6.0 2:2:1:1
20(10分)21世纪教育网
(1)(2分)
(2) (3分)
(3)或(其他合理答案也给分)(2分)
(4)(3分)
21:(12分,每空2分). (1) 沙子(合理均可) 2Fe + 3Cl2 ==== 2FeCl3
(2)加热液体的试管应与桌面成450角向上倾斜而不应垂直向上。
(3) 既有HNO3又有Fe3+ (4) Fe和硝酸反应后的溶液中若有HNO3则一定有Fe3+,Fe3+也能氧化Cu; 取与Cu片反应完全后的溶液少许于试管中,滴加适量的KSCN溶液,不出现血红色,再滴加适量新制氯水,出现血红色
22.(12分,每空2分)(1)2.5×l0(2分)21世纪教育网
(2)N2(g)+3H2O(1)2NH3(g)+O2(g)△H=+765.2kJ·mol-1 (2分)
(3)升高温度;加压;不断移出生成物脱离反应体系(合理均可,2分)
(4)①0.9375 或 (2分)②0.7 (2分)3.2(2分)
解析:(1)
(3分)
(4)① N2(g)+ 3H2(g)2NH3(g)
起始/mol 0.80 1.60 0
转化/mol 3 2
平衡n/mol 0.80— 1.60一3 2
解得:
则HYPERLINK " http://www./" EMBED Equation.DSMT4
② 由温度相同知设平衡时N2物质的量为
HYPERLINK " http://www./" EMBED Equation.DSMT4
由等效转化可求起始时N2、H2的物质的量。
21世纪教育网
www.
www.
21世纪教育网
www.
电解
t1
t3
v (正)
v (逆)
v (正)
v (逆)
v
t2
t
Zn
K
盐桥
碳棒
ZnSO4溶液
H2SO4溶液
CuSO4溶液
Cu
足量的
NaOH溶液
装置1:Fe在冷的
浓HNO3中钝化
装置2:Fe和热的
浓HNO3反应
2NH3(g)+O2(g)
N2(g)+3H2O(l)
△H=765.2kJ·mol-1
能量
反应过程
2NH3(g)+O2(g)
N2(g)+3H2O(l)
△H=765.2kJ·mol-1
能量
反应过程
点燃
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
- 第一单元
- 一 海燕
- 二 白杨礼赞
- 三 石榴
- 四 马说
- 五 紫藤萝瀑布
- 诵读欣赏
- 第二单元
- 六 纪念白求恩
- 七 敬业与乐业
- 八 多一些宽容
- 九 人的高贵在于灵魂
- 十 陋室铭
- 诵读欣赏
- 第三单元
- 十一 沙漠里的奇怪现象
- 十二 我们的知识是有限的
- 十三 短文两篇
- 十四 叫三声夸克
- 十五 花儿为什么这样红
- 诵读欣赏
- 第四单元
- 十六 孔乙己
- 十七 范进中举
- 十八 口技
- 十九 变色龙
- 二十 窗
- 诵读欣赏
- 第五单元
- 二十一 错过
- 二十二 散步
- 二十三 送东阳马生序
- 二十四 我骄傲,我是一棵树
- 二十五 有的人
- 诵读欣赏
- 第六单元
- 二十六 悼念玛丽·居里
- 二十七 在莫泊桑葬礼上的演讲
- 二十八 在联邦德国海姆佗市市长接见仪式上的答词
- 二十九 在萧红墓前的五分钟讲演
- 三十 北京申奥陈述发言两篇
- 诵读欣赏
